骨巨细胞瘤基因组学研究进展
汪翔 杨少岩 张蒙 何安邦 吴松
骨巨细胞瘤(giant cell tumor of the bone,GCTB)因病变部位有局部侵袭骨质的趋势而通常被认为是一种以局部溶骨活动为特征的交界性骨肿瘤[1]。该肿瘤在欧美发病率约为5%,而在美国人口中GCTB 约占所有良性肿瘤中的20%,且好发于20~40岁的青壮年人群,女性稍多于男性。该肿瘤目前最主要的治疗手段为外科治疗,但原发GCTB手术治疗后复发率为18%~60%,甚至少数病例还会发生恶变[2,3]。国际上根据其侵袭及转移能力的强弱分为良性GCTB和恶性GCTB。在所有的GCTB中,恶性GCTB的发病率小于2%。恶性GCTB 分为原发性和继发性两种[4,5]。虽然目前临床上对于GCTB的流行病学及临床生物学行为有一定的研究,但是其发病机制至今仍未研究清楚。以前对于GCTB的研究仅局限于形态学、病理学或蛋白质组学等方面,近几年随着研究技术的进步,GCTB的基因组学研究有了许多新的发现,这些新发现对揭示其发病机制意义重大。而该领域的研究主要集中在以下四个研究方面:基因表达谱、基因突变、信号通路、基因转染。这些研究有助于找出关键致病基因,为从基因水平上早期诊断筛查及治疗提供理论基础(见图1)。
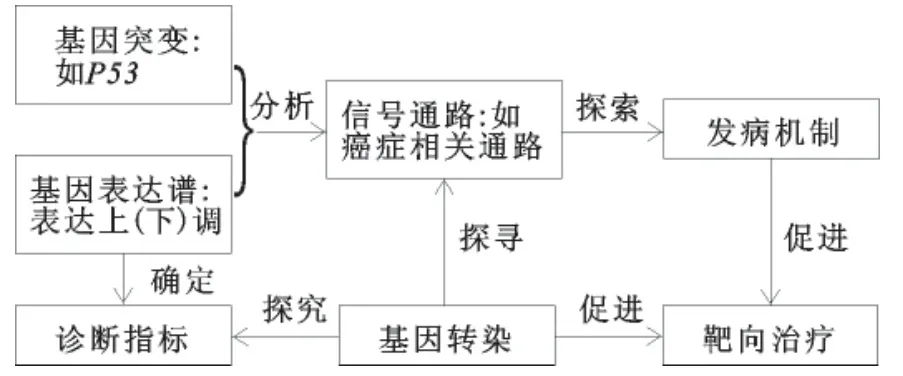
图1 GCTB基因组学主要研究内容
一、基因表达谱
GCTB的发生和发展是一个多基因、多阶段的过程,基因表达的差异性分析即基因表达谱为进一步研究GCTB 病理生理过程提供一个可行的技术手段。且随着快速减法杂交(rapid subtractive hybridization,RaSH)、实时定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)、免疫组织化学(immunohisto-chemistry)及多重QuantiGene 2.0 高通量核酸定量研究技术(QuantiGene 2.0 Multiplex Arrays)等新方法在识别和测量新基因中的运用,许多与GCTB相关的基因被发现[6],见表1。
在此条件 下Chen等[7]运 用QuantiGene 2.0 高通量核酸定量研究技术对24例复发GCTB患者的病变组织进行分析,发现了20种表达上调的基因及12种表达下调的基因,该研究为探索复发性GCTB的基因差异性表达做出了尝试。而Babeto等[6]通过对43例原发性GCTB 患者进行病变组织的RaSH、qRT-PCR 及免疫组织化学分析发现编码驱动结合蛋白-1(kinectin-1,KTN1)、NEB、ROCK1 和ZAK的表达量与正常骨组织相比显示出异常。其中ROCK1 和KTN1的表达上调,ZAK 表达明显下调,而其中NEB 通过qRT-PCR技术分析没有发现明显的差异表达。3种差异表达的基因中,ROCK1广泛涉及细胞的基本功能,如肌动蛋白细胞骨架的重组、血管生成、细胞移行和凋亡等,ROCK1的表达上调有助于GCTB细胞的侵袭和转移[8]。ZAK 功能涉及免疫反应、细胞增殖和细胞凋亡等诸多方面,该基因的表达下调会在肿瘤细胞中以细胞捕获的方式降低对细胞增殖的抑制作用,从而增强肿瘤细胞的增殖能力[9]。KTN1属于驱动蛋白超家族成员(kinesin superfamily of proteins,KIFs),在信号传导、轴突运输及细胞分裂中起着重要作用,同时KTN1 可能与肿瘤细胞的快速增殖有关[10]。Wang等[11]发现KTN1参与了肝癌患者的体液免疫。而Lieveld等[12]在GCTB肺转移的病变组织中发现基膜聚醣(lumican,LUM)和核心蛋白聚糖(decorin,DCN)与正常组织相比表达水平更低。在转移GCTB组与未转移GCTB组之间比较LUM 与DCN的表达水平,显示GCTB 转移组中LUM与DCN的表达水平更低。DCN 与LUM 均是富含亮氨酸的小蛋白聚糖家族成员(small leucine-rich proteoglycans,SLRPs),DCN 与胶原纤维及原纤维形成的调节之间有着密切的关系[13]。DCN 有着多种多样的蛋白结合力并以调节生长因子的生物利用度著称,同时DCN 参与炎症反应及肿瘤发生过程中的血管生成。而LUM 能显著地降低细胞移行、侵袭及体外非依赖性生长[14]。这也是首次发现SLRPs的表达在GCTB中出现异常,该异常可能与GCTB 不同的生物学行为关系密切。与此同时,研究人员发现成骨特异性转录因子-3(runt-related transcription factor-3,Runx3)已经被验证为肿瘤抑制基因,但是Runx3的表达与GCTB 之间的关系一直缺少研究[15]。于是Han等[16]通过检测GCTB样本及细胞系中Runx3 mRNA 及蛋白质的量,并向GCTB细胞中转染pcDNA3.1-Runx3以评估Runx3的甲基化水平等方法,发现Runx3在GCTB 患者组织中的表达率明显比对照组低。这些结果均显示Runx3在GCTB中起到了肿瘤抑制的作用,而且Runx3的甲基化可能是其低表达的分子基础。另一方面为在研究基因差异表达的基础上进一步寻找GCTB的早期特异性诊断指标。Yanagisawa等[17]就肿瘤蛋白P63是否能作为GCTB的诊断指标展开了研究,共收集了36例患者的病变组织样本,包括16例GCTB、9例成软骨细胞瘤(chondroblastoma,CHB)和7例动脉瘤样骨囊肿(aneurysmal bone cyst,ABC),其中GCTB 病例又分为复发与非复发两组,分别检测各组的P63表达水平。并计算各组P63表达上调的阳性率,结果为GCT(36.3%)、CHB(15.2%)、ABC(5.8%)。因此发现P63的表达水平是GCTB非常重要的指标,但特异度不高。

表1 部分GCTB相关基因名称及功能
二、基因突变
基因突变(gene mutation)与众多肿瘤的发病相关,在GCTB发病过程中,基因突变也起到了很重要的作用。但目前基因突变在GCTB 中的研究比较少,但肿瘤蛋白P53 及异柠檬酸脱氢酶(isocitrate dehydrogenase,ICDH)的突变是GCTB发生发展的关键因素[18,19]。P53 蛋白作为抑制肿瘤恶性转化及体细胞突变的关键因子已在多种肿瘤中被证实[20]。已有文献报道P53表达量可作为评价骨肉瘤预后的有效指标。Saito等[21]报道1例GCTB病例4次复发,第4次复发时发生了肺转移,他们对手术后的病变组织进行了免疫组化及直接测序分析。结果显示P53突变在原位复发灶及肺转移组织中同时被检测到,但仅在原位复发组织中发现P53的表达量升高。因此,P53 突变的检测可能会有助于GCTB的诊断[21]。该研究证实,由于P53突变影响谷胱甘肽过氧化物酶-1(glutathione peroxidase-1,GPX-1)表达从而有助于GCTB复发及恶性转化[19]。与此同时,Behjati等[22]研究发现组蛋白3A 家族成员H3(H3 histone of family 3A,H3F3)突变与GCTB 有关,其中在GCTB的发生发展过程中涉及H3F3A的p.Gly34Trp非同义突变,该种类型的突变可用作为区分GCTB与成软骨细胞瘤的决定性指标。
三、信号通路
信号通路(signal pathway)是细胞内外信号传递的路径,该过程由种类繁多的生化反应参与。某些信号通路与肿瘤的发生发展关系密切,通路在一定程度上反映了体细胞突变的共同作用。基因芯片技术是目前研究信号通路的有效手段,同时也为研究疾病相关的信号通路及各信号通路之间的关系提供了技术基础[23]。在此条件下Chen等[7]通过对24例复发型GCTB组织进行多重QuantiGene 2.0高通量核酸定量研究分析,发现了6条相关的信号通路和11条相关的子通路。6条通路分别是:①造血细胞谱系通路(hematopoietic cell lineage signal pathway),②吞噬体通路(phagosome signal pathway),③蛋白质的消化和吸收通路(protein digestion and absorption signal pathway),④原发性免疫缺陷(primary immunodeficiency signal pathway),⑤细胞黏附分子(cell adhesion molecules signal pathway),⑥黏着斑(focal adhesion signal pathway)。11条子通路分别为:①癌症相关通路(pathway in cancer signal pathway),②趋化因子信号通路(chemokine signaling pathway),③P53信号通路(P53 signaling pathway),④破骨细胞分化(osteoclast differentiation signaling pathway),⑤MAPK信号通路(MAPK signal-ing pathway),⑥黏着斑通路(focal adhesion signaling pathway),⑦前列腺癌信号通路(prostate cancer signaling pathway),⑧慢性粒细胞白血病信号通路(chronic myeloid leukemia signaling pathway),⑨Wnt信号通路(Wnt signaling pathway),⑩神经营养因子信号通路(neurotrophin signaling pathway),○1糖酵解/糖异生信号通路(glycolysis/gluconeogenesis signaling pathway)。在这些通路中,P53信号通路及癌症相关通路是2条最关键的通路,P53作为肿瘤抑制因子,具有生长抑制、凋亡、细胞衰老及阻断血管生成等功能而在抑制肿瘤恶性增殖过程中起到了关键作用,但是P53信号通路的阻断或抑制会对GCTB 恶性增殖及转移起到促进的作用[7,24]。另外,P53还有一些与死亡反应相关的潜在功能,具体表现在P53能根据细胞类型、基因表达谱、蛋白质活动及压力刺激类型等不同情况而决定细胞生存还是死亡[25]。此前有科研团队用熊去氧胆酸(ursodeoxycholic acid,UDCA)作为凋亡的微调因子,调控P53信号通路的中间环节,减少P53介导的细胞丢失来治疗大肠腺瘤。该团队还发现UDCA 对结肠癌也有预防的作用。但针对GCTB目前还未有此方面的研究。另一条重要的通路为癌症相关通路,该条通路中一个关键的因子是类胰岛素生长因子-1(insulin-like growth factor-1,IGF1)。现已证实IGF1的多态性型或结构异常与多种肿瘤的发病有关。值得一提的是细胞核因子κB受体活化因子(receptor activator of nuclear factor kappa-B,RANK)/细胞核因子κB 受体活化因子配体(receptor activator of nuclear factor kappa-B ligand,RANKL)/骨保护素(osteoprotegerin,OPG)通路也与GCTB的发生发展关系紧密。Amaral等[26]就RANK/RANKL/OPG 通路治疗GCTB的现状进行了研究。其中针对GCTB患者的治疗药物地诺单(denosumab)就是作用于该条通路,相关数据显示该药能抑制GCTB的骨质破坏进程和转移性进展。进一步研究该通路发现,破骨细胞分化和激活需要RANKL和集落刺激因子-1(colony-stimulating factor-1,CSF-1)的 参与,上述2种因子均是破骨细胞生成所必须的重要因子,均能结合到RANKL受体上并参与破骨细胞前体的增殖与存活,这也是通路相关研究应用于临床的重要尝试[27,28]。
四、基因转染
基因转染是将体内或体外的外源性基因导入到真核细胞中,从而使外源性基因整合到真核细胞的基因序列,以达到实验或治疗的目的[29]。基因治疗是目前研究的主要方向,其能为目前无法治愈的一些疾病(如:癌症、遗传病等)提供一个新的治疗策略。Pagnotto 等[30]运用腺相关病毒(adeno-associated viral,AAV)作为载体将转化生长因子(transforming growth factor-β,TGF-β)转染至人骨髓间充质干细胞以用来提高软骨的修复功能,提高经转染TGF-β的骨髓间充质干细胞其软骨修复潜能。除了TGF-β作为目的基因之外,骨形态发生蛋白(bone morphogenetic protein,BMP)、血管内皮生长因子(vascular endothelial growth factor,VEGF)等均被作为目的基因转染至骨髓间充质干细胞以提高该细胞成骨和生成血管的功能[31]。在以上基因转染成功的基础上,Ding等[32]将缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)转染间充质干细胞用以治疗兔的股骨头坏死,该方法能提高早期股骨头坏死区间充质干细胞的修复能力。同时,Du等[33]将HIF-1α转染至骨髓血管生成细胞以观察其对烧伤的老年小鼠的治疗作用,结果发现接受转染HIF-1α的小鼠伤口愈合得更快。Li等[31]在体外将DNA 转染至骨髓基质细胞,经转染的骨髓基质细胞获得了多向分化和增殖能力。在基因转染技术以骨髓基质细胞对象的研究成熟之后,有许多将该技术应用于难治或转移性的肿瘤的报道,如通过基因转染技术抑制肺癌、结肠癌等肿瘤细胞的增殖[34]。在此研究背景下,Singh 等[35]首次成功地将TWIST 基因家族中的碱性螺旋环螺旋转录因子基因转录到GCT 干细胞样细胞中。目前有关GCTB 基因转染的研究报道比较少,其中一个很重要的原因就是很难将外源性DNA 转录到哺乳动物的干细胞中,而Singh等人使用的电穿孔技术解决了这个难题。这个突破使得运用基因转染技术治疗GCTB的研究迈出了第一步,如果没有稳定的病毒载体,GCT 会抵抗大多数瞬时基因转染。综合目前的情况看,GCTB的基因转染还有待进一步的研究。
五、总结和展望
GCTB虽然是一种交界性骨肿瘤,但因其治疗手段单一且复发率高而备受关注。GCTB的发病机制目前尚不明确,还待进一步研究,新的基因组学研究方法的运用与进步为该肿瘤在基因层面的发病机制研究带来了曙光。基因表达谱相关基因表达量的改变预示着该基因可作为潜在的肿瘤分子标记物,从而可为GCTB转移、复发及局部侵袭等行为的提供预警。基因转染技术在GCTB 中的成功应用为其治疗方法的研究提供了一个新的方向,而信号通路及基因突变领域的新发现,使GCTB的发病机制更加明晰。但是,GCTB的基因组学研究才刚刚起步,各方面的研究还不够深入,还有许多未知需要探索。
[1]Cavanna L,Biasini C,Monfredo M,et al.Giant cell tumor of bone[J].Oncologist,2014,19(11):1207.
[2]Amanatullah DF,Clark TR,Lopez MJ,et al.Giant cell tumor of bone[J].Orthopedics,2014,37(2):112-120.
[3]栗向东,王臻,郭征.骨巨细胞瘤及其外科治疗选择[J].骨科,2010,1(2):57-61.
[4]Cowan RW,Singh G.Giant cell tumor of bone:a basic science perspective[J].Bone,2013,52(1):238-246.
[5]蔡卓,杨卿,郭风劲.脊柱原发性肿瘤的特点及治疗进展[J].骨科,2014,5(4):252-256.
[6]Babeto E,Conceiç~ao AL,Valsechi MC,et al.Differentially expressed genes in giant cell tumor of bone[J].Virchows Arch,2011,458(4):467-476.
[7]Chen S,Li C,Wu B,et al.Identification of differentially expressed genes and their subpathways in recurrent versus primary bone giant cell tumors[J].Int J Oncol,2014,45(3):1133-1142.
[8]Noma K,Rikitake Y,Oyama N,et al.ROCK1 mediates leukocyte recruitment andneointima formation following vascular injury[J].J Clin Invest,2008,118(5):1632-1644.
[9]Liu J,McCleland M,Stawiski EW,et al.Integrated exome and transcriptome sequencing reveals ZAK isoform usage in gastric cancer[J].Nat Commun,2014,5:3830.
[10]Bai JZ,Mon Y,Krissansen GW.Kinectin participates in microtubule-dependent hormone secretion in pancreatic islet beta-cells[J].Cell Biol Int,2006,30(11):885-894.
[11]Wang HC,Su YR,Han KJ,et al.Multiple variants and a differential splicing pattern of kinectin in human hepatocellular carcinoma[J].Biochem Cell Biol,2004,82(2):321-327.
[12]Lieveld M,Bodson E,De Boeck G,et al.Gene expression profiling of giant cell tumor of bone reveals downregulation of extracellular matrix components decorin and lumican associated with lung metastasis[J].Virchows Arch,2014,465(6):703-713.
[13]Neill T,Schaefer L and Iozzo RV.Decorin:a guardian from the matrix[J].Am J Pathol,2012,181(2):380-387.
[14]Brézillon S,Venteo L,Ramont L,et al.Expression of lumican,a small leucine-rich proteoglycan with antitumour activity,in human malignant melanoma[J].Clin Exp Dermatol,2007,32(4):405-416.
[15]Li Y,Ji X,Su Z,et al.Downregulation of Runx3 is closely related to the decreased Th1-associated factors in patients with gastric carcinoma[J].Tumour Biol,2014,35(12):12235-12244.
[16]Han YX,Liang DY.The role of the tumor suppressor RUNX3 in giant cell tumor of the bone[J].Int J Oncol,2012,40(3):673-678.
[17]Yanagisawa M,Kakizaki H,Okada K,et al.p63 as aprognostic marker for giant cell tumor of bone[J].Ups J Med Sci,2013,118(1):23-28.
[18]Kato Kaneko M,Liu X,Oki H,et al.Isocitrate dehydrogenase mutation is frequently observed in giant cell tumor of bone[J].Cancer Sci,2014,105(6):744-748.
[19]Okubo T,Saito T,Mitomi H,et al.p53 mutations may be involved in malignant transformation of giant cell tumor of bone through interaction with GPX1[J].Virchows Arch,2013,463(1):67-77.
[20]Yang-Hartwich Y,Bingham J,Garofalo F,et al.Detection of p53 protein aggregation in cancer cell lines and tumor samples[J].MethodsMol Biol,2015,1219:75-86.
[21]Saito T,Mitomi H,Izumi H,et al.A case of secondary malignant giant-cell tumor of bone with p53 mutation after long-term follow-up[J].Hum Pathol,2011,42(5):727-733.
[22]Behjati S,Tarpey PS,Presneau N,et al.Distinct H3F3A and H3F3B driver mutations define chondroblastoma and giant cell tumor of bone[J].Nat Genet,2013,45(12):1479-1482.
[23]牛银波,梅其炳,张蓉.Wnt-β-catenin信号通路与骨质疏松关系的研究进展[J].中华骨科杂志,2009,29(8):775-778.
[24]Papanastassiou I,Ioannou M,Papagelopoulos PJ,et al.P53 expression as a prognostic marker in giant cell tumor of bone:apilot study[J].Orthopedics,2010,33(5).
[25]Kim E,Giese A,Deppert W.Wild-type p53in cancer cells:when a guardian turns into a blackguard[J].Biochem Pharmacol,2009,77(1):11-20.
[26]Amaral JD,Xavier JM,Steer CJ,et al.Targeting the p53 pathway of apoptosis[J].Curr Pharm Des,2010,16(22):2493-2503.
[27]Dufresne A,Derbel O,Cassier P,et al.Giant-cell tumor of bone,anti-RANKL therapy[J].Bonekey Rep,2012,1:149.
[28]Lau CP,Huang L,Tsui SK,et al.Pamidronate,farnesyl transferase,and geranylgeranyl transferase-I inhibitors affects cell proliferation,apoptosis,and OPG/RANKL mRNA expression in stromal cells of giant cell tumor of bone[J].J Orthop Res,2011,29(3):403-413.
[29]Sun Y,Zhang S,Peng X,et al.Preparation,characterization and transfection efficacy of chitosan nanoparticles containing the intestinal trefoil factor gene[J].Mol Biol Rep,2012,39(2):945-952.
[30]Pagnotto MR,Wang Z,Karpie JC,et al.Adeno-associated viral gene transfer of transforming growth factor-beta1 to human mesenchymal stem cells improves cartilage repair[J].Gene Ther,2007,14(10):804-813.
[31]Li P,Gao Y,Liu Z,et al.DNA transfection of bone marrow stromal cells using microbubble-mediated ultrasound and polyethylenimine:aninvitrostudy[J].Cell Biochem Biophys,2013,66(3):775-786.
[32]Ding H,Gao YS,Hu C,et al.HIF-1αtransgenic bone marrow cells can promote tissue repair in cases of corticosteroid-induced osteonecrosis of the femoral head in rabbits[J].PloS one,2013,8(5):e63628.
[33]Du J,Liu L,Lay F,et al.Combination of HIF-1α gene transfection and HIF-1-activated bone marrowderived angiogenic cell infusion improves burn wound healing in aged mice[J].Gene Ther,2013,20(11):1070-1076.
[34]Rama AR,Prados J,Melguizo C,et al.E phage gene transfection associated to chemotherapeutic agents increases apoptosis in lung and colon cancer cells[J].Bioeng Bugs,2011,2(3):163-167.
[35]Singh S,Mak I,Power P,et al.Gene transfection in primary stem-like cells of giant cell tumor of bone[J].Stem Cells Cloning,2010,3:129-134.