枯草芽胞杆菌T122F内生定殖及对香蕉枯萎病的防治效果
石妞妞, 杜宜新, 阮宏椿, 杨留水, 甘 林, 杨秀娟*, 陈福如
(1. 福建省农业科学院植物保护研究所, 福州 350013;2. 福建浦城绿安生物农药有限公司, 南平 353400)
枯草芽胞杆菌T122F内生定殖及对香蕉枯萎病的防治效果
石妞妞1, 杜宜新1, 阮宏椿1, 杨留水2, 甘 林1, 杨秀娟1*, 陈福如1
(1. 福建省农业科学院植物保护研究所, 福州 350013;2. 福建浦城绿安生物农药有限公司, 南平 353400)
为了明确枯草芽胞杆菌T122F菌株对香蕉枯萎病的生防作用,对菌株在香蕉体内的定殖特性及对盆栽香蕉苗的防治效果进行了研究。结果表明,T122F能在香蕉体内定殖和传导,在香蕉根部、球茎、假茎和第2叶、第4叶中,T122F菌量的高峰分别出现在接种后第10、7、3、7、7天,菌量峰值分别为1.33×104、3.09×103、1.62×104、1.99×104和2.35×103cfu/g鲜重,T122F菌株在香蕉体内的消长动态表现为先增长后下降的趋势。在接种枯萎病菌前4 d和后2 d分别采用200亿活芽胞/g枯草芽胞杆菌T122F可湿性粉剂300倍液灌根1次,对香蕉枯萎病的防治效果达66.00%。
香蕉枯萎病; 枯草芽胞杆菌; 定殖; 防治效果
由尖孢镰刀菌古巴专化型(Fusariumoxysporumf.sp.cubense)侵染引起的香蕉枯萎病又称香蕉巴拿马病、黄叶病,是制约香蕉生产的一种毁灭性土传病害,在我国海南、广东、广西、云南、福建和台湾等地严重发生并造成巨大的经济损失[1-2]。目前生产上尚无防治香蕉枯萎病的特效药剂,利用品种的抗病性是控制该病害最为经济有效的措施之一,然而,我国香蕉抗枯萎病品种资源十分匮乏,一些较为耐病的香蕉品种也因农艺性状不足而不被农民接受。
已有研究表明生物防治对土传病害具有较好的防治效果[3-5]。Mohandas等研究发现,荧光假单胞菌(Pseudomonasfluorescens)对香蕉枯萎病防治效果明显,能诱导香蕉产生对枯萎病的系统抗性[6]。Thangavelu从香蕉根围土壤中分离出的哈茨木霉对香蕉枯萎病菌的菌丝生长具有显著的抑制作用,防病效果达48%~51%[7]。王振中从香蕉体内分离到一株对香蕉枯萎病菌1号和4号小种均有很强拮抗活性的地衣芽胞杆菌(Bacilluslicheniformis),其温室防治效果为80%[8]。Lian等研究表明,香蕉组培苗接种内生细菌后,有效抑制了香蕉枯萎病菌对组培苗的侵染,且对植株有一定促长作用[9]。余超从香蕉植株体内分离到的铜绿假单胞菌(Pseudomonasaeruginosa)对香蕉枯萎病的盆栽防效和田间防效分别达83.67%和82.00%[10]。开展香蕉枯萎病生物防治的研究越来越受到国内外研究者的关注[11],但利用枯草芽胞杆菌及其菌剂进行香蕉枯萎病生物防治的研究较少,殷晓敏等采用浸根处理发现,枯草芽胞杆菌B215对香蕉枯萎病的盆栽防效为62.95%[12]。
本实验室以香蕉枯萎病菌为指示菌筛选出一批具有抑菌活性的拮抗菌株,其中拮抗菌T122F经鉴定为枯草芽胞杆菌,为进一步了解该菌对香蕉枯萎病的生防潜力,本试验研究了该菌在香蕉体内的定殖特性及其菌剂对香蕉枯萎病的防治效果,以期为香蕉枯萎病的生物防治提供理论依据。
1 材料与方法
1.1 材料
菌株:枯草芽胞杆菌(Bacillussubtilis)T122F和香蕉枯萎病菌4号生理小种(Fusariumoxysporumf.sp.cubenserace 4)由福建省农业科学院植物保护研究所植病室提供。枯草芽胞杆菌用20%甘油保存,香蕉枯萎病菌用PSA斜面培养基保存。
植株:供试香蕉苗为‘台蕉2号’(MusaAAA),苗龄为6~7叶期,由福建省漳州市农科所生物中心提供。
培养基:马铃薯蔗糖培养基(PSA)和牛肉浸膏蛋白胨固体培养基(NA)。抗生素:利福平(rifampicin,RIF),成都锦华药业有限责任公司生产,用无水乙醇配成50 mg/mL的母液。
菌剂:200亿活芽胞/g枯草芽胞杆菌T122F可湿性粉剂由浦城绿安生物农药有限公司提供;药剂:45%咪鲜胺乳油由北京中农研创高科技有限公司生产;试验土壤:采自福建省福州市新店镇菜园土。
1.2 方法
1.2.1 抗RIF标记T122F突变株的诱导及筛选
参照吴蔼民[13]的方法并略加改进,将活化好的T122F菌株转入含1 μg/mL RIF的NA平板中培养,挑取生长好的突变体菌落,接入相同RIF浓度的NA平板中培养3 d,然后转入相同RIF浓度的NB液体培养基中培养3 d,再转入含2倍RIF浓度的NA平板中培养3 d,后采用逐步提高药物浓度的方法诱导培养,必要时可在相同药物浓度的NB液体培养基中适应2~3代,直至筛选出在含400 μg/mL RIF的NA培养基上能稳定生长,且菌落形态及对病原菌的拮抗作用等保持不变的菌株,即为抗RIF标记的T122F突变株。
1.2.2 抗RIF标记T122F突变株在香蕉体内的定殖能力测定
将突变株接入含RIF 400 μg/mL的150 mL NB培养液中,在30 ℃,140 r/min条件下振荡培养48 h,培养液经5 000 r/min离心20 min后弃上清液,取沉淀(菌体),用灭菌水配制成(5±1)×106cfu/mL的菌悬液,浇灌于盆栽香蕉苗根部,每盆浇灌菌液100 mL,接菌后第1、3、5、7、10、15、22天取样分离,以不接菌为空白对照,每次取5株(重复)蕉苗进行香蕉根、球茎、假茎和叶(近基部第2叶、第4叶)内部标记菌株的分离。
将香蕉植株用清水清洗3次,用吸水纸吸除根、球茎、假茎、叶表面的水分后剪下称重,75%乙醇表面消毒30 s,用0.1%升汞浸泡1.5~2.0 min,再用无菌水冲洗3次,无菌吸水纸吸除水分后,将表面消毒好的组织材料放入无菌研钵中研磨成糊状,并加入鲜重10倍量的无菌水静置15 min,浸出液用无菌水按10倍稀释2个梯度,取稀释液200 μL均匀涂抹于含400 μg/mL RIF的NA培养基平板上,每稀释梯度3次重复,28 ℃黑暗条件下培养48 h后,记录每皿单菌落数,并计算各部位平均每克鲜重组织的含菌量,用cfu/g鲜重表示。
1.2.3 T122F菌剂对香蕉枯萎病的防治效果测定
采用伤根灌菌法接种,香蕉枯萎病菌接种用分生孢子浓度为5×106cfu/mL,每株蕉苗灌菌液50 mL。T122F菌剂施用浓度为1∶100、1∶200、1∶300和1∶400倍液,设置7种菌剂处理方式,处理①~④:接枯萎病菌后2 d分别施菌剂1∶100、1∶200、1∶300和1∶400倍液1次;处理⑤:接枯萎病菌前4 d和后2 d施菌剂1∶300倍液各1次;处理⑥:接枯萎病菌前12 d和前4 d施菌剂1∶300倍液各1次;处理⑦:接枯萎病菌后当天施菌剂1∶300倍液1次。以接枯萎病菌后2 d施用45%咪鲜胺乳油1∶1 000倍液1次为药剂对照,以浇灌清水为空白对照。以上各处理菌剂灌根使用量为100 mL/株,每处理7株香蕉苗,试验4次重复。香蕉苗正常肥水管理,接病菌30 d后参照杨秀娟[14]的香蕉枯萎病病情分级标准,记录每株蕉苗发病的外部症状和内部症状,计算每处理的病情指数和病害防治效果。
1.2.4 数据统计与分析
数据统计绘图用Excel,数据统计分析用DPS 6.85软件进行。
2 结果与分析
2.1 抗RIF标记的T122F突变株的获得及分离回收结果
经RIF由低到高浓度的逐步诱导筛选,最终获得菌落形态与原始菌株相似的抗RIF 400 μg/mL的T122F突变株,即抗RIF标记的T122F菌株。该菌株分离回收结果表明,菌液接种后可从香蕉植株的根、球茎、假茎、第2叶和第4叶共5个不同部位分离到标记菌株,对照中未发现该菌株(图1),说明采用RIF标记可以进行该菌株在香蕉体内的定殖检测,菌株可通过香蕉根部进入植株体内,并向上传导到植株不同部位进行定殖。
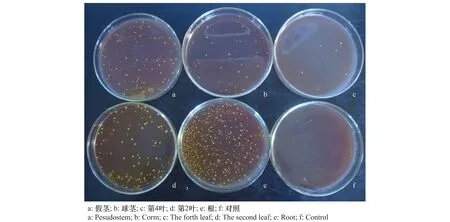
图1 香蕉植株不同部位标记菌株的分离结果(接种后10 d)Fig.1 Isolation of the marked strains from different parts of banana plantlets(10 days after inoculation)
2.2 抗RIF标记的T122F菌株在香蕉体内的定殖与消长动态
RIF标记的T122F菌株在香蕉苗体内消长动态测定结果(图2)表明,灌根接种后1~22 d,菌株在根、球茎、假茎和叶片内定殖的菌量均呈不同的变化趋势,总体以根部、第2叶定殖菌量明显高于假茎、球茎和第4叶。菌株在根部定殖的菌量在接种后的1~10 d内呈波浪式上升趋势,第10天出现1次明显高峰,峰值为1.33×104cfu/g鲜重,后逐渐下降。在球茎定殖的菌量一直处于较低水平,仅在接种后第3天和第7天出现一个高峰(峰值分别为2.72×103cfu/g鲜重和3.09×103cfu/g鲜重),随后菌量下降至低水平。在假茎定殖的菌量在接种后第3天出现一个高峰(峰值为1.62×104cfu/g鲜重),随后菌量快速下降至低水平。在第4叶定殖的菌量也一直处于较低水平,自接种后的1~7 d内呈现上升趋势,在接种后第7天出现1次高峰(峰值为2.35×103cfu/g鲜重)后逐渐下降。菌株在第2叶定殖的菌量明显高于第4叶,在接种第7天出现1次明显高峰(峰值为1.99×104cfu/g鲜重)后逐渐下降。
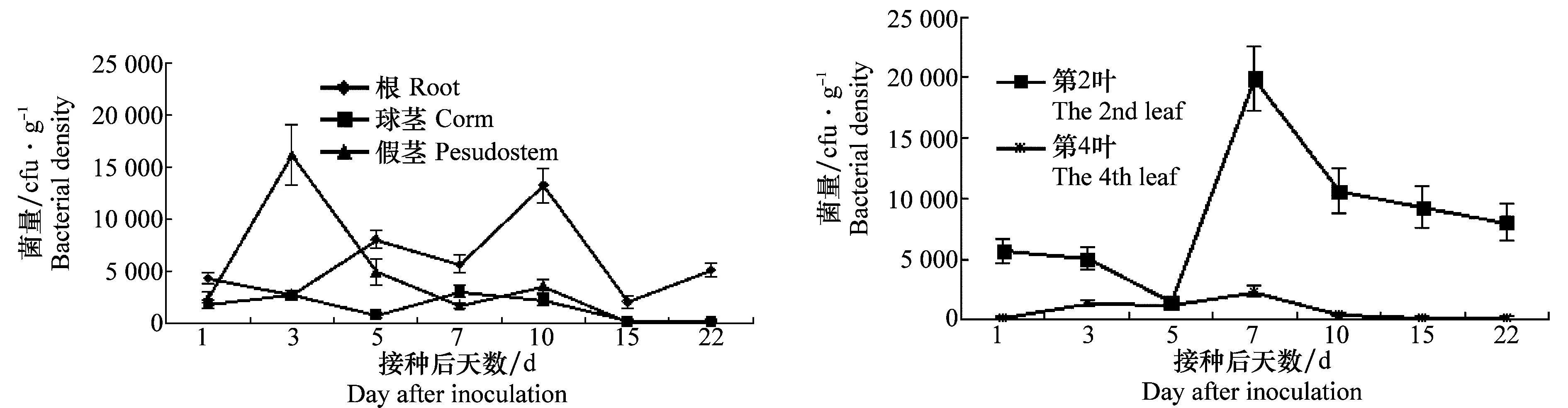
图2 T122F菌株在香蕉体内的消长动态Fig.2 Population fluctuation of T122F strain in banana plantlets
2.3 不同浓度的枯草芽胞杆菌T122F菌剂对香蕉枯萎病的防治效果
试验结果表明,不同浓度的T122F菌剂及45%咪鲜胺乳油在接菌后2 d施用能明显抑制香蕉苗枯萎病的发展,在枯草芽胞杆菌菌剂的4个浓度处理中,以菌剂100倍液处理对香蕉枯萎病的防治效果最好,为63.44%,其防效与45%咪鲜胺EC 1 000倍液处理的效果(64.62%)相当,两者无显著性差异;菌剂200倍液、300倍液和400倍液处理的防效分别为47.49%、47.32%和41.28%,三者之间无显著性差异(表1)。
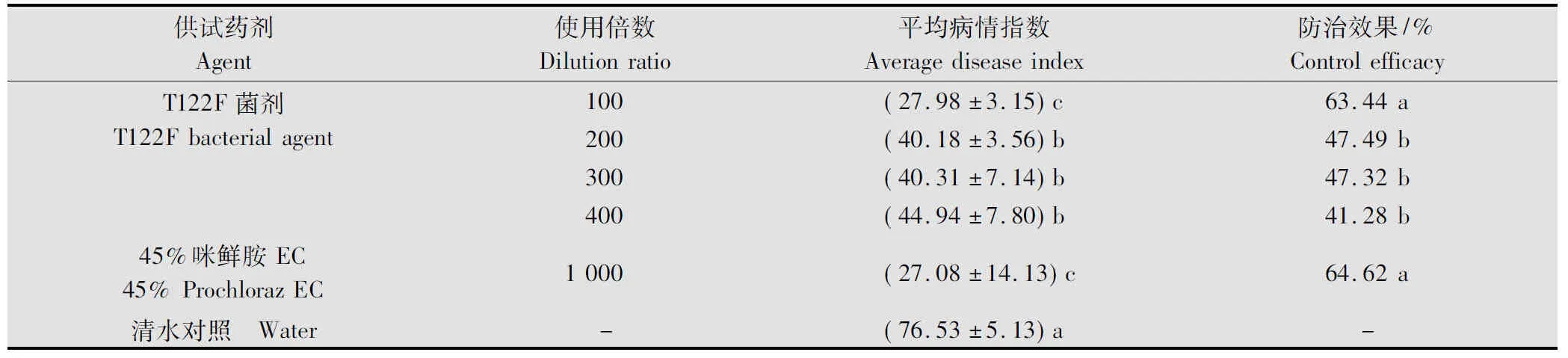
表1 不同浓度的T122F菌剂对香蕉枯萎病的防治效果1)
1) 同列数据后不同的小写字母表示在 0.05水平差异显著。下同。
Different lowercase letters in the same column indicate significant difference at 0.05 level. The same below.
2.4 不同时期施用枯草芽胞杆菌T122F菌剂对香蕉枯萎病的防治效果
在施用T112F菌剂的4个处理中,以接种病菌前4 d和后2 d各施用菌剂1次的防治效果最好,为66.00%,以接种病菌后2 d使用菌剂1次的处理防治效果最差,为47.32%,两者之间有显著差异。在接种病菌前或接种病菌后当天施用菌剂的防治效果均达60%以上(表2)。表明该菌剂宜在病菌侵入香蕉之前使用,对香蕉枯萎病的发生具有较好的预防作用。

表2 不同时期施用T122F菌剂对香蕉枯萎病的防治效果
3 小结与讨论
香蕉枯萎病是一种难以根治的土传病害,严重威胁香蕉产业的发展。目前,香蕉枯萎病的生物防治因其具有无公害和环境友好的特点而备受关注。在植物土传病害的生物防治中,生防菌株能否在靶标植物体内定殖已成为筛选和评价土传病害生防菌的重要指标之一。为此,一些研究者相继开展了生防菌在香蕉根际及其体内的定殖研究,付业勤发现香蕉内生拮抗细菌在香蕉根、假茎、叶柄、叶片等组织中的定殖数量呈递减趋势[15];游春平研究发现拮抗细菌bio-d5在香蕉根际、根表和根内有较强的亲和定殖能力[16];周林采用灌根法接种,发现枯草芽胞杆菌TR21标记菌株在香蕉根表和根际土壤中有较好的定殖能力,并能在香蕉体内定殖和传导,定殖动态表现为“由升到降”的趋势[17]。T122F菌株是本实验室从健康香蕉根部分离出来的一株内生枯草芽胞杆菌,采用伤根接种,对其定殖能力测定表明,T122F菌株能在香蕉根、球茎、假茎及叶片内定殖,并以根内定殖的菌量最高,该菌株能通过香蕉根部向上传导,但随时间的推移,该菌在香蕉体内各部位的定殖数量明显下降。研究结果预示适时补充香蕉根部的生防菌是保持香蕉体内一定的菌群数量、充分发挥生防菌防病功效的重要措施。
枯草芽胞杆菌由于能产生内生芽胞,具有很强的抗逆能力和抗菌防病的作用,国内外在农业领域中多以该菌制成菌剂,以生物农药形式用于农业生产[18-20]。目前我国获得农药部登记注册芽胞杆菌杀菌剂——百抗,其有效成分是枯草芽胞杆菌B908,通过营养竞争、位点占领等机制,对烟草、三七、小麦、白菜等作物土传病害具有很好的防治效果,特别对水稻纹枯病的防治效果可达70%以上[21]。在前期试验研究中,以芽胞量和发酵液抑菌活性为筛选指标,通过枯草芽胞杆菌T122F培养配方和培养条件优化,研制出200亿活芽胞/g枯草芽胞杆菌T122F可湿性粉剂不仅含有抗逆性强的芽胞,还含有菌体发酵过程中产生的抑菌代谢产物。本研究采用人工伤根法接种,结果表明,该菌剂在病菌侵入香蕉前后各施用菌剂1次,对香蕉枯萎病的防治效果可达66%。张志红等将腐熟的有机肥与3种生防细菌(枯草芽胞杆菌、胶质芽胞杆菌和巨大芽胞杆菌)混合,组合成生物复混肥和生物有机肥对香蕉枯萎病的防治效果分别可达61.5%和53.8%[22]。表明枯草芽胞杆菌T122F菌剂对香蕉枯萎病具有较好的防治效果。
研究还发现,T122F菌剂的施用浓度越高,对香蕉枯萎病的防治效果越好,但考虑到成本和田间菌源实际数量,建议以300倍液作为适宜的施用浓度。菌剂的施用时期对香蕉枯萎病的防效有明显影响,在病菌侵入香蕉之前施用防效更好。生物防治具有无公害、无污染和防治作用专化性的特点,T122F菌剂的合理应用有望成为防治香蕉枯萎病的一种有效方法。
[1] 高乔婉.香蕉枯萎病[C]∥中国农业百科全书编辑部.中国农业百科全书.植物病理学卷.北京:中国农业出版社,1996:482-483.
[2] 陈厚彬. 从第九届国际香蕉改良网络亚太区咨询委员会会议看亚太区和中国的香蕉研究与生产[J]. 柑桔与亚热带果树信息, 2000, 16(3):6-8.
[3] 李长松. 拮抗性细菌生物防治植物土传病害的研究进展[J]. 生物防治通报, 1992, 8(4):168-182.
[4] 董炜博, 宋协松. 植物土传病害的生物防治[J]. 世界农业, 1992(11):40-41.
[5] 徐关娜, 王光华, 靳学慧. 土传病害生物防治研究进展[J]. 吉林农业科学, 2005, 30(2):39-42.
[6] Mohandas S, Manamohan M, Rawal R D, et al. Interaction ofFusariumoxysporumf.sp.cubensewithPseudomonasfluorescensprecolonized to banana roots [J].World Journal of Microbiology & Biotechnology, 2004, 20(6):651-655.
[7] Thangavelu R, Palaniswami A, Velazhahan R. Mass production ofTrichodermaharzianumfor managing fusarium wilt of banana [J]. Agriculture,Ecosystems and Environment, 2004, 103(1):259-263.
[8] 王振中.香蕉枯萎病及其防治研究进展[J]. 植物检疫, 2006, 20(3):198-200.
[9] Lian Jie, Wang Zifeng, Cao Lixiang, et al. Artificial inoculation of banana tissue culture plantlets with indigenous endophytes originally derived from native banana plants [J]. Biological Control, 2009, 51(3):427-434.
[10]余超, 肖荣凤, 刘波, 等. 生防菌FJAT-346-PA的内生定殖特性及对香蕉枯萎病的防治效果[J]. 植物保护学报, 2010, 37(6):493-498.
[11]杨秀娟, 杜宜新, 甘林, 等. 香蕉枯萎病的生物防治和抗病育种研究进展[J]. 中国果树, 2008(6):42-45.
[12]殷晓敏, 郑服丛, 贺春萍, 等. 枯草芽孢杆菌B215生物学特性及对香蕉枯萎病的生防效果评价[J]. 热带作物学报, 2010, 31(8):1416-1419.
[13]吴蔼民, 顾本康, 傅正擎, 等. 内生菌73a在不同抗性品种棉花体内的定殖和消长动态研究[J]. 植物病理学报, 2001, 31(4):289-294.[14]杨秀娟, 陈福如, 黄月英, 等. 接种枯萎病菌后香蕉苗病症观察及其组织病理特征[J]. 福建农林大学学报(自然科学版), 2006, 35(6):578-581.
[15]付业勤, 蔡吉苗, 刘先宝, 等. 香蕉内生细菌分离、活性评价及数量分布[J]. 热带作物学报, 2007, 28(4):78-83.
[16]游春平, 刘任, 肖爱萍, 等. 拮抗细菌bio-d5在香蕉根部定殖力的测定[J]. 华中农业大学学报, 2008, 27(3):363-366.
[17]周林, 程萍, 喻闻辉, 等. 枯草芽孢杆菌TR21在香蕉体内及根际的定殖动态[J].中国农学通报, 2010, 26(19):392-396.
[18]Stein T.Bacillussubtilisantibiotics:structures, syntheses and specific functions [J]. Molecular Microbiology, 2005, 56(4):845-857.
[19]姜莉莉, 陈彦闯, 辛明秀. 枯草芽孢杆菌在防治植物病害上的应用及研究进展[J]. 安徽农学通报,2009,15(7):37-39,110.
[20]王星云, 宋卡魏, 张荣意. 枯草芽孢杆菌菌剂的开发应用[J]. 广西热带农业, 2007(2):32-35.
[21]徐钦.植物土传病害的克星—百抗[J].当代农业,2002(11):34.
[22]张志红, 李华兴, 韦翔华, 等. 生物肥料对香蕉枯萎病及土壤微生物的影响[J]. 生态环境, 2008, 17(6):2421-2425.
(责任编辑:杨明丽)
Colonization and control efficacy ofBacillussubtilisT122F againstFusariumoxysporumf.sp.cubense
Shi Niuniu1, Du Yixin1, Ruan Hongchun1, Yang Liushui2, Gan Lin1, Yang Xiujuan1, Chen Furu1
(1. Institute of Plant Protection, Fujian Academy of Agricultural Sciences, Fuzhou 350013, China; 2. Fujian Pucheng Lvan Biological Pesticide Co., Ltd., Nanping 353400, China)
To confirm the control efficacy ofBacillussubtilisT122F against banana wilt, the colonization and the control efficacy of T122F on banana plantlets were investigated in pot experiments. The results showed that the strain T122F could colonize and transmit in banana plantlets. The peaks of T122F concentration in the root, corm, pesudostem, the second leaf and the forth leaf appeared at 10, 7, 3, 7 and 7 d after inoculation with a peak number of 1.33×104, 3.09×103, 1.62×104, 1.99×104and 2.35×103cfu/g FW, respectively. The strain population showed a trend of “first increase and then decrease”. When banana plantlets were treated with 300 fold diluted solution of 2×1010cfu/g T122F wettable powder 4 days before and 2 days after pathogen inoculation, respectively, the control efficacy reached 66.00%.
Fusariumoxysporumf.sp.cubense;Bacillussubtilis; colonization; control efficacy
2014-06-08
2014-08-21
福建省发改委高新技术项目(2011-352);福建省自然科学基金(2011J01114)
S 436.681,S 482.292
A
10.3969/j.issn.0529-1542.2015.04.017
* 通信作者 E-mail:yxjzb@126.com

