术前外周血中NLR、d-NLR、PLR和LMR四种比值在结直肠癌患者预后诊断中的价值①
陈小林 姚国强 刘剑荣
(江西省萍乡市人民医院,萍乡 337000)
结直肠癌(Colorectal cancer,CRC)是世界上是排名第三的恶性肿瘤,同时也是全世界因癌症相关死亡的第四大死因。在中国,2010年新确诊的结直肠癌患者和死亡病例分别占全世界的20%和25%[1]。由于容易发生局部复发或远处转移,结直肠癌患者的5年总生存期及预后情况不尽人意。因此,如果能找到导致癌症侵袭和转移的关键性因子,并确定有效的诊断标志物,这将对病人的治疗效果和后续治疗的评估起到关键性的作用。自从炎症被确认为是一个重要的致癌因素后[2],越来越多的证据都表明,在癌症的发生和发展进程中,炎症都有极其重要的促进作用[3]。持续性的炎症反应通过减弱机体的适应性免疫应答能力,从而有利于肿瘤的进一步发展扩散。因此,代表炎症反应和机体免疫状态的循环标记物被认为是肿瘤患者治疗效果和预后的潜在危险因素。系统性炎症反应的指标中,外周血的中性粒细胞和淋巴细胞的比值(NLR)、派生出的中性粒细胞和淋巴细胞比(D-NLR)(白细胞总数减去中性粒细胞计数的结果和淋巴细胞的比值)、血小板对淋巴细胞比值(PLR)和淋巴细胞对单核细胞的比值(LMR),都已经被广泛地用于癌症患者的预后预测指标研究中[4]。有研究报道,NLR、D-NLR、PLR和LMR在恶性间皮瘤,软组织肉瘤,卵巢癌和乳腺癌等[5-7]的诊断价值中有比较好的预后预测效果。本研究为了解结直肠癌患者手术前的NLR、D-NLR、PLR和LMR对患者术后复发生存率和预后的诊断价值。
1 材料与方法
1.1 病例资料 收集从2010年2月和2014年10月在南京第一医院和萍乡市人民医院胃肠外科收治的结直肠癌患者。入选标准:(1)现病史、家族史、个人史、体格检查的资料详尽,术后病理学资料完整且为根治性手术者;(2)术前需行胸部CT或胸片排除肺转移、CT或腹部 B超排除肝转移,及无其他远处转移证据者;(3)术后TNM临床病理分期为I、Ⅱ、Ⅲ者;(4)排除其他结直肠肿瘤,如恶性淋巴瘤,类癌等。术前病理诊断明确,肿瘤部位、大小、病理类型、浸润深度通过病理检查获得,对各组淋巴结进行分类标识送检,以确认各组淋巴结转移情况,病理报告由2位病理医师阅片签发后得到,术前全血细胞分析检查详尽。经过筛选共有205例符合标准。
1.2 实验方法 收集手术之前的8~10 h每个患者的血液样品,用Sysmex XT-1800i自动血液学系统做血常规检测,实验室数据包括(白细胞、嗜中性粒细胞、淋巴细胞、单核细胞和血小板计数)。随访数据定期:患者的随访检查进行时段:三年内每三个月定期回访一次,第四年后是每半年进行回访一次。随访资料判定标准:无瘤生存终点为肿瘤复发或转移,生存终点为肿瘤相关死亡,随访截至2014年10月30日。
1.3 统计学分析 患者的NLR、D-NLR、PLR和LMR的最佳截止值通过受试者工作特征曲线(ROC)进行计算。临床病理参数和 NLR、DNLR、PLR以及LMR之间的关系是用非参数 χ2检验进行统计。Kaplan-Meier法用于计算生存曲线,Long-rank做单因素分析,COX多因素回归用于分析影响预后的危险因素。P<0.05认为差异有统计学意义。所有数据统计采用SPSS17.0软件。
2 结果
2.1 分析计算NLR、D-NLR、PLR和LMR的最佳截止值 研究组共205例患者,以癌症特异性死亡作为终点,各个比值评估患者无复发生存情况的ROC曲线如图1所示。从图中可以计算出,NLR、DNLR、PLR和 LMR曲线下面积(AUC)分别为0.764、0.672、0.727和 0.234。因为 LMR 曲线的AUC面积小于0.50,所以不能用作对预后分析的潜在标志物。通过评估NLR、D-NLR和PLR对患者无复发生存率的情况,计算得出NLR、D-NLR、PLR曲线的最佳截止值分别为3.12、2.30和176,同时它们的曲线最佳的特异性和敏感性分别为NLR(75%和73.1%),d-NLR(63% 和 77%),PLR(52%和77%)。
2.2 术前患者的NLR、D-NLR与PLR和临床各病理因素的关系 所有患者都进行手术治疗,患者的基本特征资料在表1,从表中可以看出,NLR以3.12为界限,分为高NLR组和低NLR组,NLR比值和肿瘤的TNM分期、肿瘤的侵袭程度以及肿瘤的分级有相关性(P<0.05),而与年龄、性别和肿瘤位置(结肠/直肠)没有影响;而D-NLR以2.3为界限与PLR以176为界限分为高比值和低比值组,统计结果都显示,D-NLR比值仅仅和肿瘤的TNM分期有关(P<0.05);而患者PLR比值高低与肿瘤分期/肿瘤分级有统计学意义。
2.3 术前中性粒细胞和淋巴细胞比值(NLR)和预后的关系
2.3.1 影响5年无复发生存率的危险因素分析统计患者临床病理因素与生存率之间的关系(表2和图2),结果显示对生存可能产生影响的单因素为:肿瘤分级(G3以上)、淋巴结转移数>3个、术前NLR≥3.12、D-NLR≥2.3与 PLR≥176、TNM 分期(Ⅲ)还有术后化疗(未化疗)对结直肠癌患者复发生存率有影响(P<0.05),是影响术后复发生存的危险因素。其中不同肿瘤分级对预后有统计学意义,淋巴结转移数越多生存率越低,随着原发肿瘤的浸润深度的加深,无复发生存率明显下降,术前 NLR<3.12患者明显优于 NLR≥3.12的无复发生存率,随着 TNM分期的进展,患者的无复发生存率越来越低。本研究发现男女性别之间生存无明显统计学意义(P>0.05),各年龄组及肿瘤位置(结肠与直肠)的生存分析也都没有出现统计学意义的差异。
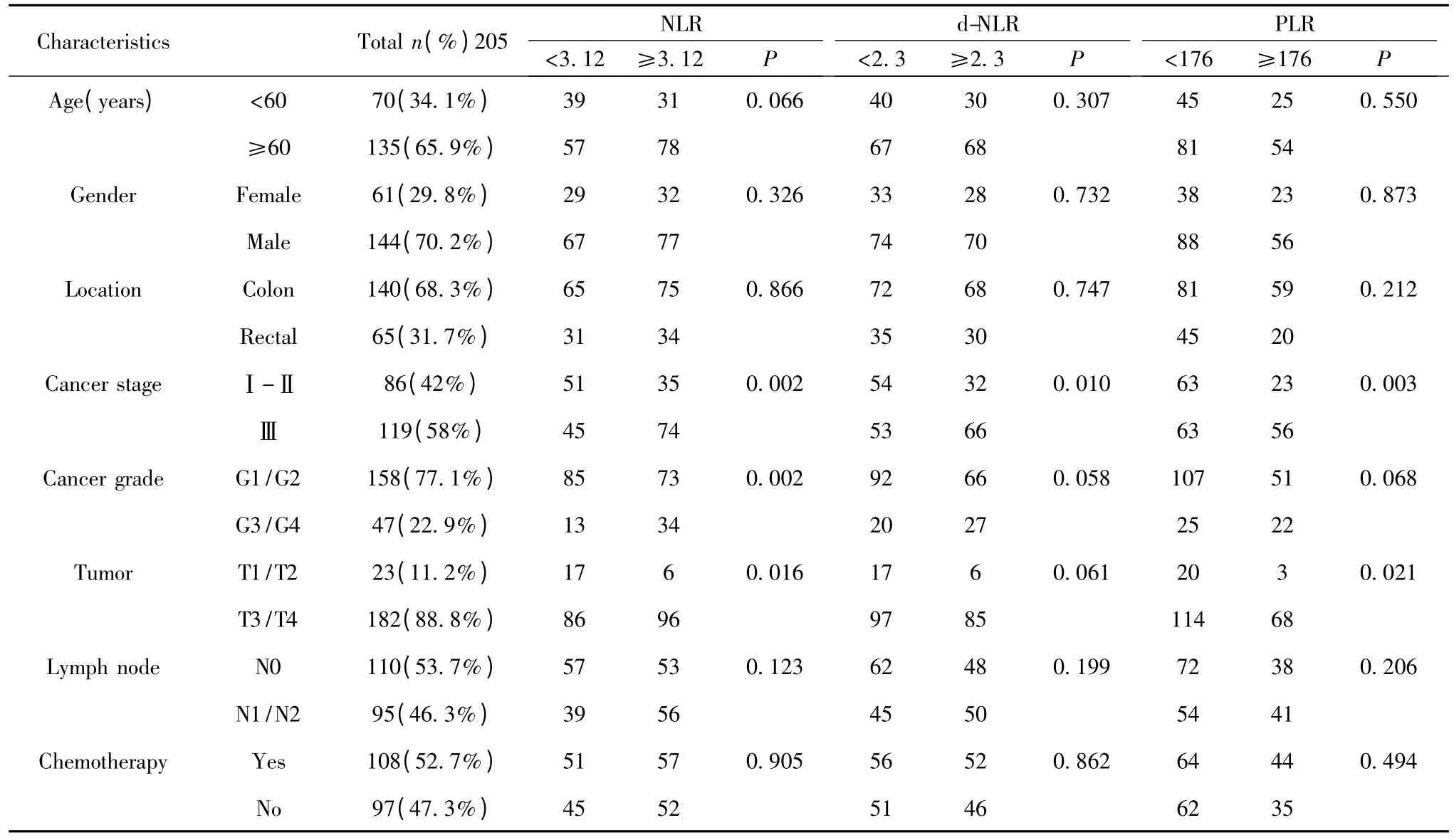
表1 NLR、d-NLR与PLR与患者的临床病理资料的特征比较Tab.1 Baseline characteristics of colorectal cancer patients by NLR,PLR and d-NLR

图2 用Kaplan-Meier法用于计算不同比值对术后患者的生存曲线Fig.2 Kaplan-Meier curves of ratios for RFS
2.3.2 结直肠癌预后相关因素Cox回归分析 为消除各因素之间相互作用的影响,本研究采用多因素COX风险比例函数模型分析(表3),把上述可能影响患者生存复发的因素导入COX函数模型分析。结果显示术前NLR(≥3.12)的水平HR(95CI%):2.52(1.65~3.83)、肿瘤分期(Ⅲ期)是影响结直肠癌患者生存预后的独立危险因素(P<0.001),而其他在单因素分析中有统计学意义的因素比如肿瘤浸润深度、肿瘤大小、D-NLR与PLR,由于和以上因素之间存在相互影响,因此并不是影响结直肠癌患者预后的独立因素。

图1 以癌症特异性死亡作为终点,四种比值评估患者生存率的ROC曲线Fig.1 Four kinds of ratios of receiver operating curve analysis for cancer-specific survival

表2 结直肠癌患者临床病理因素和NLR、D-NLR及PLR与5年无复发生存率的关系Tab.2 Association of clinical baseline characteristics with 5 years recurrence-free survival in all cases
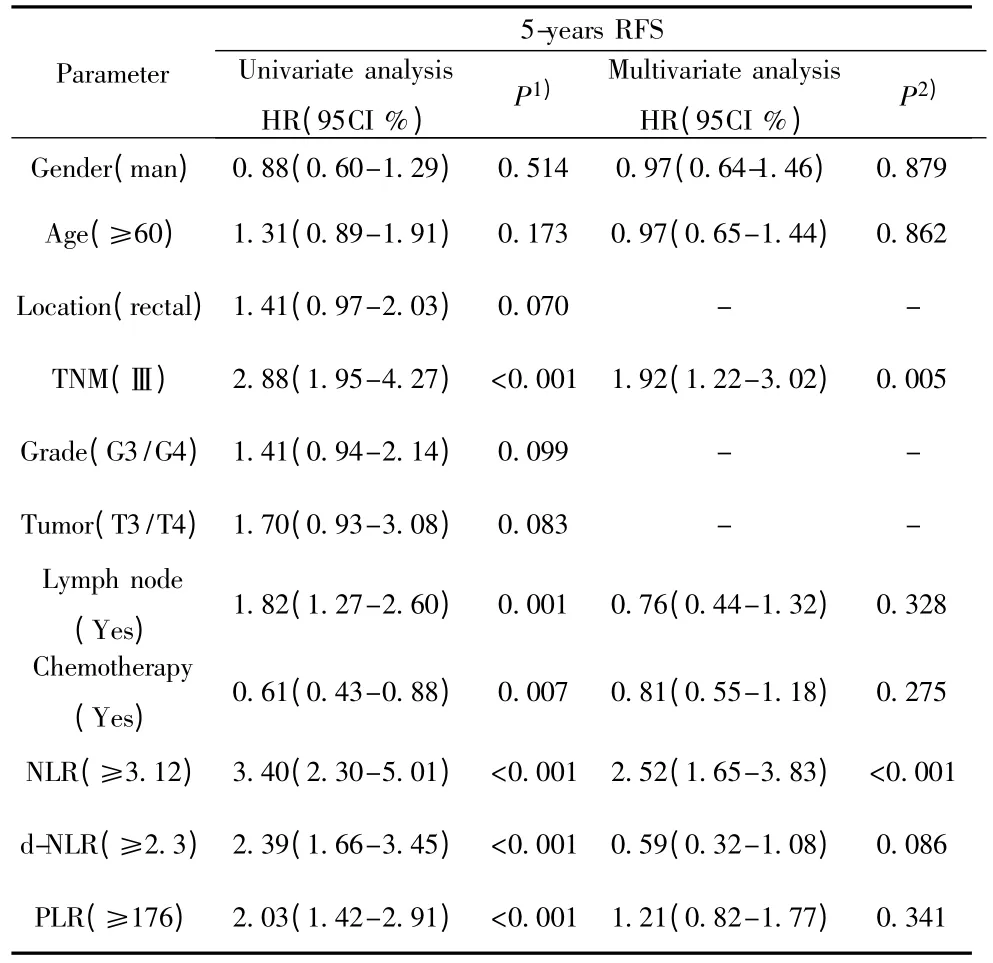
表3 影响结直肠癌患者危险因素的COX回归分析Tab.3 Recurrence-free of patients using COX proportional regression analysis
3 讨论
随着肿瘤治疗理念的改变,手术和其他治疗方案的结合是越来越多医生的选择。相关的研究表明,许多恶性肿瘤都是由慢性炎症慢慢发展起来的[8],肿瘤的炎症反应和宿主的保护性免疫是相互关联的一个动态过程,炎症反应能改变这种动态的平衡,能使肿瘤更好的生长发展。因此寻找合适的能准确反映肿瘤侵袭转移等的指标一直是肿瘤近几年的热点和难点。自发现炎性反应在癌变发生的过程中发挥的关键作用后,慢性炎症反应可以产生一些毒素应激而引发癌症的发生,同时炎症细胞也能诱导细胞增殖促进癌症发展,通过提高血管生成和组织浸润的方式促进肿瘤的扩散[9],相关的研究表明一系列炎性细胞和机体的先天免疫系统信号分子参与肿瘤的进展[10],如中性粒细胞、淋巴细胞、血小板和单核细胞的。上述研究结果提示,炎症细胞的种类和数量的比例与肿瘤病理分期相比,或许能更好的了解癌症患者治疗后的情况。因此,我们选择NLR、D-NLR、PLR和LMR代表系统性炎症反应的指标,来作为结直肠癌的潜在预后因素研究。在本次研究中,结果证实了我们先前的假设,术前高NLR对手术治疗结直肠癌患者的预后有较大的影响。以前的一些研究结果也显示在肺癌[10]、食管癌、胰腺癌[11]、肝癌[12]、胃癌[13]及大肠癌[14]中高NLR是影响这些癌症预后疗效的独立危险因素,和本研究的结果相一致。本研究中,结果提示术前NLR>3.12和肿瘤分期(Ⅲ期)是影响结直肠癌患者术后复发及生存的独立危险因素。另外,其他在单因素分析中有统计学意义的因素比如肿瘤浸润深度、肿瘤分级、D-NLR与PLR,由于与以上因素之间存在相互影响,因此并不是影响结直肠癌患者预后的独立因素。因此,高NLR的结直肠癌患者复发风险明显增加,5年生存率要低于低NLR的患者。NLR是机体免疫状态的一个重要指标,其高低与肿瘤特点有关。一方面,中性粒细胞比例升高,在发生炎症反应时中性粒细胞可被激活,并且从静脉系统迁移到肿瘤细胞周围,同时释放大量的能够诱导细胞DNA损伤和不稳定遗传的活性氧,从而产生适合肿瘤生存的微环境[15]。其次,中性粒细胞是循环血管内皮生长因子(VEGF)的主要来源之一[16],而高浓度的VEGF被公认为是促进肿瘤新血管生成及远处转移的必备条件之一。另一方面,系统炎症通过降低宿主的CD4+T淋巴细胞能力和抑制CD8+T淋巴细胞的增加[17],从而显著降低机体的细胞免疫能力[18]。因此,癌症引起的炎症反应能导致NLR的比值升高。同时,NLR的升高也促进癌症的发展,最终导致结直肠癌患者的预后不良。因此,NLR更重要的是可能扮演一个促进肿瘤炎症反应与抗肿瘤炎症反应的平衡状态。
由于本研究样本数有限,把NLR≥3.12作为最佳截止点,和以前的一些研究不同,这可能由于不同的地理区域以及对入选病例的筛选标准不同造成的。另外,本研究中把生存终点定为肿瘤相关死亡,可能与生存终点定为患者死亡的结果会有些不同。而且本研究中患者数量偏小(205例),不能代表大部分的结直肠癌患者的情况。
总之,高NLR能作为结直肠癌患者术后预后的独立危险因素,但是在运用NLR作为结直肠癌患者的预后预测指标时,要充分的结合患者的个人综合因素,如癌症的分期、营养状况等综合判断,才能做出最佳的术后治疗方案。虽然LNR作为预后的一个判断指标,其真实性和准确性还有待考证,但对于NLR的研究或许可以成为肿瘤患者的预后诊断、检测、干预治疗的新思路。
[1]Chen W,Zheng R,Zhang S,et al.Annual report on status of cancer in China,2010[J].Chin J Cancer Res,2014,26:48-58.
[2]Mantovani A,Allavena P,Sica A,et al.Cancer-related inflammation[J].Nature,2008,454:436-44.
[3]Elinav E,Nowarski R,Thaiss CA,et al.Inflammation-induced cancer:crosstalk between tumours,immune cells and microorganisms[J].Nat Rev Cancer,2013,13:759-771.
[4]Kao SC,Pavlakis N,Harvie R,et al.High blood neutrophil-to-lymphocyte ratio is an indicator of poor prognosis in malignant mesothelioma patients undergoing systemic therapy[J].Clin Cancer Res,2010,16:5805-5813.
[5]Raungkaewmanee S,Tangjitgamol S,Manusirivithaya S,et al.Platelet to lymphocyte ratio as a prognostic factor for epithelial ovarian cancer[J].J Gynecol Oncol,2013,23:265-273.
[6]Szkandera J,Gerger A,Liegl-Atzwanger B,et al.The lymphocyte/monocyte ratio predicts poor clinical outcome and improves the predictive accuracy in patients with soft tissue sarcomas[J].Int J Cancer,2014,135:362-370.
[7]Absenger G,Szkandera J,Pichler M,et al.A derived neutrophil to lymphocyte ratio predicts clinical outcome in stage II and III colon cancer patients[J].Br J Cancer,2013,109:395-400.
[8]Teramukai S,Kitano T,Kishida Y,et al.Pretreatment neutrophil count as an independent prognostic factor in advanced non-smallcell lung cancer:an analysis of Japan Multinational Trial Organisation LC00-03[J].Eur J Cancer,2009,45:1950-1958.
[9]Coussens LM,Werb Z.Inflammation and cancer[J].Nature,2002,420:860-867.
[10]Cedrés S,Torrejon D,Martínez A,et al.Neutrophil to lymphocyte ratio(NLR)as an indicator of poor prognosis in stage IV nonsmall cell lung cancer[J].Clin Transl Oncol,2012,14:864-869.
[11]Stotz M,Gerger A,Eisner F,et al.Increased neutrophil-lymphocyte ratio is a poor prognostic factor in patients with primary operable and inoperable pancreatic cancer[J].Br J Cancer,2013,109:416-421.
[12]Mano Y,Shirabe K,Yamashita Y,et al.Preoperative neutrophilto-lymphocyte ratio is a predictor of survival after hepatectomy for hepatocellular carcinoma:a retrospective analysis[J].Ann Surg,2013,258:301-305.
[13]石 朋,赵 毅,邓 鑫.术前中性粒细胞淋巴细胞比率(NLR)预测胃癌预后的临床意义[J].现代肿瘤医学,2012,20(5):988-991
[14]Shibutani M,Maeda K,Nagahara H,et al.Significance of preoperative neutrophil-to-lymphocyte ratio as a predictor of prognosis in patients with stage IV colorectal cancer[J].Gan To Kagaku Ryoho,2013,40:1603-1605.
[15]Weitzman SA,Gordon LI.Inflammation and cancer:role of phagocyte-generated oxidants in carcinogenesis[J].Blood,1990,76:655-663.
[16]Kusumanto YH,Dam WA,Hospers GA,et al.Platelets and granulocytes,in particular the neutrophils,form important compartments for circulating vascular endothelial growth factor[J].Angiogenesis,2003,6:283-287.
[17]Rabinowich H,Cohen R,Bruderman I,et al.Functional analysis of mononuclear cells infiltrating into tumors:lysis of autologous human tumor cells by cultured infiltrating lymphocytes[J].Cancer Res,1987,47:173-177.
[18]Menges T,Engel J,Welters I,et al.Changes in blood lymphocyte populations after multiple trauma:association with posttraumatic complications[J].Crit Care Med,1999,27:733-740.