二苯乙烯苷和三七总皂苷配伍对Aβ25-35致PC12细胞损伤影响的研究
张运辉,伍大华*,袁春云,张秀丽,彭文杰,姚 婷
(1.湖南中医药大学中医药研究院附属中西结合医院,湖南 长沙410006;2.湖南中医药大学中药粉体实验室,湖南 长沙 410208)
阿尔茨海默病(Alzheimer's disease AD)是一种以进行性痴呆为主的中枢神经系统的退行性疾病。临床上以何首乌和三七为主的补肾活血复方益智健脑颗粒用于AD 的治疗取得了很好的疗效[1-2]。AD患者胆碱能系统损伤后,乙酰胆碱酯酶(AchE)活性在多处脑区均显著升高,其变化程度与痴呆等级呈相关[3-4]。 丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性是评估AD 氧化应激损伤的重要标志[5]。已有研究表明,二苯乙烯苷(TSG)能降低AD 模型大鼠的AchE 活性[6],并通过抗氧化应激损伤作用明显减少人β 淀粉样蛋白25-35(Aβ25-35)引起的PC12 细胞损伤,提高细胞活力[7]。 三七总皂苷(PNS)能改善胆碱能系统、抗氧化应激损伤[8-9]。 我们前段研究预实验表明,二苯乙烯苷(TSG)100 mmol/L 和PNS 50 mg/L分别是抗阿尔茨海默病损伤的有效剂量,且两者配伍对神经元损伤有协同或相加的效应。 本文从胆碱能系统损伤和氧化应激损伤两方面探讨TSG 和PNS 配伍对AD 损伤的保护机制, 现将实验方法及结果报道如下。
1 实验材料
1.1 细胞
大鼠肾上腺髓质嗜络细胞瘤细胞株PC12 细胞,高分化,永久性,购自长沙赢润生物技术有限公司,编号2015032007。
1.2 试剂
TSG (北京北纳创联生物技术研究院, 批号130725,纯度97%),PNS(北京北纳创联生物技术研究院,批号MUST-14042810,纯度98%),Aβ25-35(美国Sigma 公司,批号053M4804V 纯度98%),盐酸多奈哌齐片(中国卫材药业有限公司),DMSO(Sigma 公司),FBS(吉泰远成生物科技有限公司),MDA 试剂盒、SOD 试剂盒、AchE 试剂盒、MTT、胰酶均由南京建成生物工程研究所提供,DMEM 细胞培养液 (赛默飞世尔生物化学制品北京有限公司),10%新生小牛血清(Hyclone Lab),PBS(北京索莱宝科技有限公司)。
1.3 仪器
Galaxy 170R 型二氧化碳培养箱(上海百赛生物技术有限公司),DL-CJ-2NDI 型超净工作台(中国北京东联哈尔仪器制造有限公司),5804R 型低温高速离心机(德国Eppendorf 5810R),Primo Vert型倒置显微镜(德国 Carl Zeiss Jena),UV1800ENG240V 型 紫 外 分 光光度计[岛津(中国)有限公司]等。
2 方法
2.1 PC12 细胞培养
用含10%胎牛血清和5%马血清的DMEM,在95%O2、5%CO2、37 ℃条件下培养细胞, 每2 天传代1次, 待细胞增长至80%融合时, 用0.25%胰酶消化细胞, 调整细胞数至1×105个/mL 后传代或接种于细胞培养板,取对数生长期细胞用于实验。
2.2 药物配制
将TSG、PNS、Aβ25-35、 多奈哌齐分别配成初始浓度为2 000 mmol/L、1 000 mg/L、400 μmol/L、200 μmol/L。药物干预时,再分别取5 μL 加至100 μL 的细胞培养基中稀释20 倍。
2.3 药物配伍剂量的确定
前段研究表明,TSG(100 mmol/L)和PNS(50 mg/L)分别是抗阿尔茨海默病损伤的的有效剂量, 且两者配伍对神经元损伤有协同或相加的效应。
2.4 分组及药物干预
文献[10]表明,Aβ25-35能剂量依赖性地损伤皮质神经元,1 μmol/L Aβ25-35剂量组处理24 h 后细胞存活率可降低50%左右, 可用于Aβ25-35体外诱导阿尔茨海默病细胞模型的建立[10]。 故本实验选用Aβ25-35诱导PC12 细胞建立AD 损伤模型。
待PC12 细胞进入对数生长期后, 以2×104/mL密度, 随机接种于96 孔细胞培养板中, 每孔100 μL,每组8 孔,共6 组。24 h 后,吸取培养液,细胞分成6 组进行药物干预:(1) 空白组(正常PC12细胞);(2)模型组(20 μmol/L Aβ25-35);(3)多奈哌齐组(20 μmol/L Aβ25-35+10 μmol/L 多奈哌齐)(4)TSG组 (20 μmol/L Aβ25-35+100 mmol/L TSG);(5)PNS组(20 μmol/L Aβ25-35+50 mg/L PNS;(6)TSG-PNS(20 μmol/L Aβ25-35+100 mmol/L TSG+50 mg/L PNS)组,继续孵育24 h。
2.5 PC12 细胞中AchE 及SOD 活力、MDA 含量检测
完成加药孵育24 h 后, 采用细胞刮彻底收集细胞, 超声破碎细胞,4 ℃下3 000 r/min 离心10 min, 收集上清液按照试剂盒方法测定细胞均浆中的AchE 及SOD 活力、MDA 含量。
2.6 统计学处理
3 结果
与空白组比较, 模型组AchE 活力、MDA 含量显著升高(P<0.01);与模型组比较,AchE 活力、MDA含量在各组显著降低(P<0.05),且配伍组及多奈哌齐组比TSG 组和PNS 单用组降低更明显 (P<0.01,P<0.05)。
与空白组比较,模型组SOD 活力显著降低(P<0.01);与模型组比较,SOD 活力在各组显著升高(均P<0.05),配伍组及多奈哌齐组均升高明显(P<0.01,P<0.05), 且配伍组比TSG 组和PNS 单用组升高更明显(均P<0.01)。 见表1。
表1 各组PC12 细胞上清液中AchE 及SOD 活力、MDA 含量的比较 (±s,n=8)
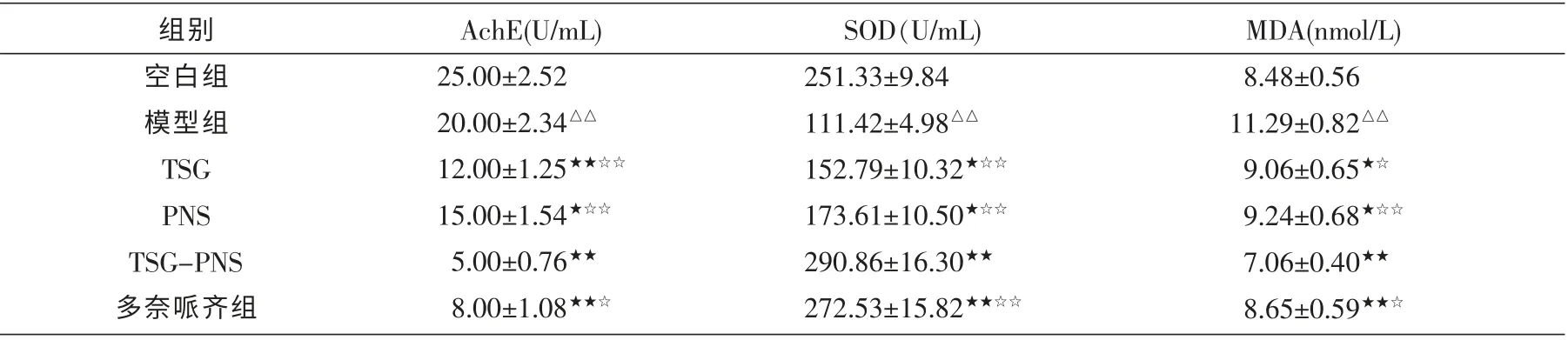
表1 各组PC12 细胞上清液中AchE 及SOD 活力、MDA 含量的比较 (±s,n=8)
注:与空白组比较△△P<0.01;与模型组比较★P<0.05,★★P<0.01;与TSG-PNS 配伍组比较☆P<0.05,☆☆P<0.01。
MDA(nmol/L)8.48±0.56 11.29±0.82△△9.06±0.65★☆9.24±0.68★☆☆7.06±0.40★★8.65±0.59★★☆组别空白组模型组TSG PNS TSG-PNS多奈哌齐组AchE(U/mL)25.00±2.52 20.00±2.34△△12.00±1.25★★☆☆15.00±1.54★☆☆5.00±0.76★★8.00±1.08★★☆SOD(U/mL)251.33±9.84 111.42±4.98△△152.79±10.32★☆☆173.61±10.50★☆☆290.86±16.30★★272.53±15.82★★☆☆
4 讨论
上世纪70年代,研究发现AD 患者基底前脑去胆碱能神经元丢失,从基底节到皮质,胆碱乙酰转移酶(ChAT)活性降低和乙酰胆碱酯酶(AChE)活性明显升高,造成乙酰胆碱(ACh)的合成,储存和释放减少,皮质ACh 受体数目减少,导致以学习记忆减退和认知障碍为主的多种临床表现, 产生AD 症状[11]。AD 病人体内自由基生成增加, 尤其是脑组织中神经细胞的氧化应激是导致其脑结构和功能改变的原因[12]。 超氧化物歧化酶(SOD)属于生物抗氧化酶类,被称为生物体抗氧化系统的第一道防线。 丙二醛 (MDA) 属于脂质过氧化物标志物。 实验证明,MDA 的水平在AD 脑内显著提高[13]。 一旦自由基产生和清除的平衡状态被打破,自由基堆积,对机体造成氧化损伤,促使AD 的发生。 因此,胆碱能系统损伤、氧化应激自由基损伤是AD 发病的重要机制。我们前期预实验发现,40 μmol/L 浓度范围内,Aβ25-35对PC12 细胞损伤存在浓度依耐性, 随着浓度的升高,细胞发生聚集、脱落,呈弥漫状,细胞存活率也成线性降低;当损伤浓度升高至40 μmol/L,镜下视野几乎无细胞存活,对细胞的损伤达到顶峰。 考虑到Aβ25-35的严重致损作用可能导致PC12 细胞不可逆转性的损伤,故我们选取20 μmol/L 的Aβ25-35作用PC12 细胞建立AD 体外细胞模型。
本研究结果表明,Aβ25-35诱导PC12 细胞建立AD 损伤模型后,模型组上清液AchE 活力、MDA 含量显著升高、SOD 活力明显降低, 说明AD 模型PC12 细胞的胆碱能系统和自由基清除系统发生严重障碍。 药物干预后TSG、PNS、TSG-PNS 可降低AchE 活力、MDA 含量、提高SOD 活力。且TSG-PNS配伍组的效应比TSG 或PNS 单用组更好。 TSG 和PNS 配伍治疗AD 的机制可能是通过改善胆碱能损伤和抑制氧化应激损伤来实现的。
[1]董克礼, 曾望远. 益智健脑颗粒治疗阿尔茨海默病20 例总结[J].湖南中医杂志,2006,22(2):3-4.
[2]董克礼,蒋美艳.益智健脑颗粒治疗老年痴呆病临床观察[J]. 湖南中医药大学学报,2007,27(1):58-59.
[3]Engelborghs S, de Deyn PP. The neurochemistry of Alzheimer’s disease[J].Acta Neurol Belg,1997,97(2):67-84.
[4]Nesulam I. .Some cholinergic themes related to Alzheimer’s disease:synaptology of the nucleus basalis,location of m2 receptors,interactions with amyloid metabism and perturbations of cortical plasticity[J].Physiol Paris,1998,92(3-4):293-298.
[5]马 晶.柚皮素通过影响氧化应激改善阿尔茨海默病模型大鼠的学习记忆能力[D].重庆:重庆医科大学,2013.
[6]张 兰,叶翠飞,褚燕琦,等.二苯乙烯苷对鹅膏蕈氨酸致痴呆大鼠模型脑内胆碱能系统的影响[J].中国药学杂志,2005,40(10):749-752.
[7]马海涵,邵 阳,陈力学,等.二苯乙烯苷对Aβ25-35诱导的细胞损伤的保护作用[J].中国老年学杂志,2011,31(1):55-57.
[8]钟振国,屈泽强,王乃平,等. 三七总皂苷对阿尔茨海默病大鼠脑胆碱能神经的保护作用[J].中国临床康复,2006,10(19):174-175.
[9]吕 良,钟振国,吴登攀,等.三七总皂苷对快速老化模型小鼠脑内syp,tau 基因表达的影响[J].中国中药杂志,2009,34(10):1 261-1 263.
[10]于 洋,李 萌,候艳宁,等.Aβ25-35对原代培养大鼠皮质神经元的损伤作用[J].华北国防医药,2010,22(4):301-304.
[11]Musia A, Bajda M, Malawska B. Recent developments in cholinesterases inhibitors for Alzheimer's disease treatment.Curr Med Chem, 2007,14(25):2 654-2 679.
[12]Zawia NH, Lahiri DK, Cardozo-Pelzez F. Epigenetics, oxidative stress, and Alzheimer disease [J]. Free Radic Bio Med, 2009,46(11):1 241.
[13]Markesbery WR,Lovell MA. 4-Hydroxynonenal,a product of lipid peroxidation,is increased in the brian in Alzheimer’s disease[J].Neurobiology of Aging,1998(1-2),19(1):33-36.

