琼玉膏酸奶对实验性衰老模型小鼠抗氧化作用的研究
刘 娟,蒋俊和*,肖作为,袁 悦,齐雪洁,莫倩云
(湖南中医药大学,湖南 长沙410208)
衰老是生命体生长发育成熟后必经的自然过程,是人类不可抗拒的,但抗衰延年的目标却是可以实现的。 当今社会,随着经济的发展和生活水平日益提高,人口老龄化的问题日显突出,努力探索和积极寻找延缓衰老的理想方法,已成为医学界亟待解决的重要课题。 运用药膳食疗方法是中医抗衰老的特色之一,近年来,抗衰老药膳产品的研发备受人们关注。 琼玉膏由人参、生地黄、白茯苓、白蜜组成,有滋阴润肺、健脾补肾、益寿延年等作用。 酸奶由乳或再制乳经微生物发酵而成,含有SOD 等抗氧化物质,可清除自由基,阻止老化的发生。 因此,酸奶制品作为抗衰老食品具有明显的优势和广阔的市场。 本课题组对研制的琼玉膏酸奶的抗氧化效应进行动物实验研究,旨在为琼玉膏酸奶的开发和应用提供实验依据。
1 材料
1.1 动物
昆明种健康小鼠(2~3月龄),50 只,雌雄各半,体质量为(20±2)g,由湖南斯莱克景达实验动物有限公司提供,动物生产许可证号:SCXK(湘)2013-0004, 湖南中医药大学动物实验中心使用许可证号:SYXK(湘)2013-0005。
1.2 药物和试剂
D-半乳糖(美国Sigma 公司,规格10 g);0.9%生理盐水(湖南中医药大学第一附属医院);琼玉膏(1 mL 含生药1.0 g)、 琼玉膏酸奶 (1 mL 含生药1.0 g)、普通酸奶(由湖南中医药大学食品科学与工程实验室自制, 于4 ℃保存, 酸奶储存期不超过14 d); 考马斯亮兰蛋白、SOD、CAT、GSH-Px、MDA测定试剂盒(均购于南京建成生物工程研究所)。
1.3 主要仪器
UV-2600 型紫外可见分光光度仪(上海仪器有限公司);低温高速离心机(上海安亭科学仪器厂);漩涡震荡器(宁波新芝科研仪器研究所);电子分析天平(上海奥豪斯仪器有限公司);内切式组织匀浆机(宁波新芝科研仪器研究所);光学显微镜(Olympus 公司)。
2 方法
2.1 动物分组、造模及干预
将50 只小鼠雌、雄分开,给予标准饲料适应性饲养3 d 后,随机分成空白对照组、衰老模型组、普通酸奶组、琼玉膏酸奶组、琼玉膏组,每组10 只。除空白对照组外的4 组采用D-半乳糖致衰老动物模型法[1]造模,每日上午给予小鼠颈背部皮下注射D-半乳糖(10 mg/mL,100 mg/kg),空白对照组注射同等体积的0.9%生理盐水,连续30 d。 在造模的同时,各组给予相应的干预:空白对照组、衰老模型组灌服蒸馏水(25 mL/kg),普通酸奶组灌服普通酸奶 (25 mL/kg), 琼玉膏酸奶组灌服琼玉膏酸奶(25 mL/kg),琼玉膏组灌服琼玉膏(2.5 g/kg)和蒸馏水(22.5 mL/kg) 。 酸奶的灌胃剂量参照文献[2]计算。
2.2 标本采集
给药结束后称小鼠体质量并记录,颈椎脱臼处死小鼠后迅速取出大脑、肝脏、心脏、脾脏,用冰冷的生理盐水冲洗后,滤纸吸干称质量。 分别取同侧肝、脑组织经10%福尔马林固定后,用于一般组织病理学观察。 心脏、另一部分肝脏-80 ℃保存,用于生化指标测定。
2.3 指标测定及方法
2.3.1 一般状态观察 观察各组小鼠一般状态包括毛色、精神状态、反应性、活动情况、饮食、二便等方面变化。 记录各组小鼠药物干预前、药物干预7、15、21、30 d 体质量情况。
2.3.2 心、肝、脑、脾指数的计算 根据称量所得的心、肝、脑、脾的质量及小鼠的体质量,按公式计算脏器指数:
脏器指数=脏器质量(mg)/体质量(g)
2.3.3 肝脏、心肌组织中生化指标的测定 生化指标的测定严格按试剂盒说明书操作:蛋白含量测定采用考马斯亮蓝法,SOD 活性测定采用黄嘌呤氧化酶法,CAT 活性测定采用可见光法,MDA 含量测定采用TBA 法,GSH-Px 活性测定参照试剂盒说明书。
2.3.4 肝、 脑组织病理形态学检测 取固定后的肝、脑组织常规石蜡包埋,切片,采用HE 染色法光镜下观察肝脑形态学变化,采用尼氏染色法光镜下观察海马神经功能变化。
2.4 统计学分析
数据采用SPSS 19.0 软件包进行统计学处理,计量资料以“±s”表示,对于满足正态分布、方差齐性的指标,组间比较采用单因素方差分析(One-Way ANOVA),组间两两比较采用LSD 法检验,一组与多组比较采用Dunnett 法; 对于方差不齐的数据用Tamhane's T2法,以P<0.05 为差异有统计学意义。
3 结果
3.1 小鼠一般情况变化
3.1.1 小鼠一般状态 实验开始前,小鼠毛色白而光泽,精神状态好,反应灵敏,活动自如,饮食、二便色形正常,体质量无差别。 实验前2 周,所有组小鼠体质量呈增加趋势。 实验2 周后造模小鼠毛发卷曲、枯黄、欠光泽、易脱落,精神萎靡,反应不灵敏,行动迟缓,饮食量减少。 实验终末,空白对照组小鼠状态如前; 衰老模型组小鼠明显出现毛色灰暗、竖毛、弓背、活动减少、食欲减退、体质量持续减轻的衰老体征,个别出现皮肤溃烂现象,证明衰老模型造模成功;各受试组小鼠的一般情况均有不同程度的改善,如毛发较前润泽、行动变得灵活,饮食增进等。
3.1.2 小鼠体质量的变化 给药前,各组小鼠体质量无显著性差异(P>0.05)。 给药15 d 后,衰老模型组小鼠体质量增长明显缓慢, 与空白对照组相比,具有显著性差异(P<0.01)。 给药结束后,普通酸奶组、琼玉膏酸奶组、琼玉膏组均能不同程度地减缓衰老小鼠的体质量下降,与衰老模型组相比,均有显著性差异(P<0.01 或P<0.05),其中琼玉膏酸奶组体质量增加最明显。 见表1。
3.2 琼玉膏酸奶对心、肝、脑、脾指数的影响
与空白对照组比较,衰老模型组小鼠的心、脾、肝、脑指数均显著降低(P<0.01),表明衰老小鼠的心、脾、肝、脑萎缩。 琼玉膏酸奶组与模型组相比,心、脾、肝、脑指数均显著增加(P<0.01)。与普通酸奶组、琼玉膏组相比,琼玉膏酸奶组除肝指数,其它脏器指数都有显著差异(P<0.01)。 见表2。
3.3 琼玉膏酸奶对D-半乳糖致衰老小鼠肝组织SOD、CAT、GSH-Px 活力和MDA 含量的影响
与空白对照组相比, 衰老模型组小鼠肝脏组织中SOD、CAT 和GSH-Px 活性显著降低 (P<0.01),MDA 含量显著增高(P<0.01)。与衰老模型组相比,普通酸奶组、琼玉膏酸奶组、琼玉膏组均可显著增高肝组织的SOD、CAT 和GSH-Px 活性, 并显 著降 低MDA 含量,差异有统计学意义(P<0.01);与普通酸奶组相比,琼玉膏酸奶组小鼠肝脏组织中SOD、CAT 和GSH-Px 活性、MDA 含量差异均极显著(P<0.01);与琼玉膏组相比,琼玉膏酸奶组小鼠肝脏组织中SOD、GSH-Px 活性、MDA 含量差异均极显著 (P<0.01),CAT 活性差异显著(P<0.05)。 见表3。
3.4 琼玉膏酸奶对D-半乳糖致衰老小鼠心肌组织SOD、CAT、GSH-Px 活力和MDA 含量的影响
与空白对照组相比,D-半乳糖致衰模型小鼠心肌组织中SOD、CAT 和GSH-Px 活性显著降低 (P<0.01),MDA 含量显著增高(P<0.01)。 与衰老模型组相比,琼玉膏酸奶组、琼玉膏组均可显著增高SOD、CAT 和GSH-Px 活性(P<0.01),并显著降低MDA 含量(P<0.01), 普通酸奶组可显著增高SOD、GSH-Px活性(P<0.01)和降低MDA 含量(P<0.01);与普通酸奶组相比,琼玉膏酸奶组小鼠心肌组织中SOD、CAT和GSH-Px 活性、MDA 含量差异均极显著 (P<0.01);与琼玉膏组相比,琼玉膏酸奶组小鼠心肌组织中CAT、GSH-Px 活性差异均显著(P<0.05),MDA含量、SOD 活性差异极显著(P<0.01)。 见表4。
表1 各组小鼠体质量的变化 (±s,n=10,g)
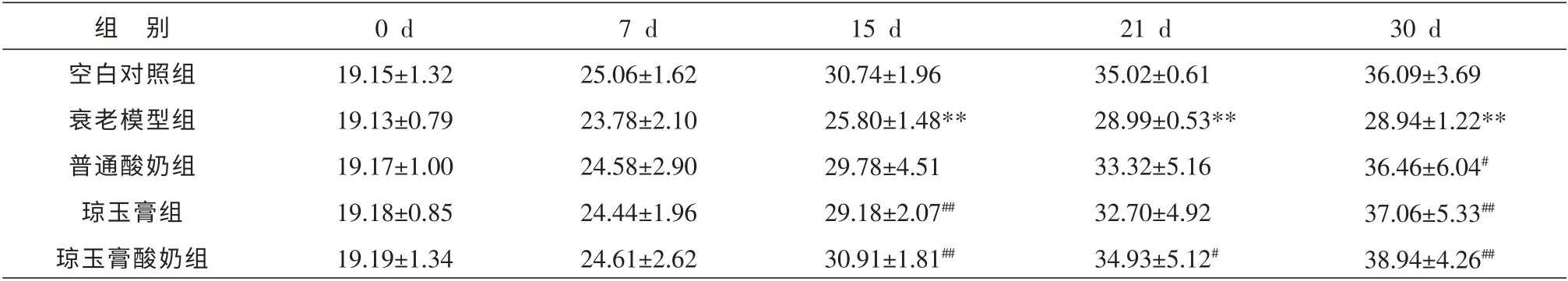
表1 各组小鼠体质量的变化 (±s,n=10,g)
注:与空白对照组比较*P<0.05,**P<0.01;与模型组比较#P<0.05,##P<0.01;与普通酸奶组比较▲P<0.05,▲▲P<0.01;与琼玉膏组比较★P<0.05,★★P<0.01。 下表同。
组 别空白对照组衰老模型组普通酸奶组琼玉膏组琼玉膏酸奶组0 d 19.15±1.32 19.13±0.79 19.17±1.00 19.18±0.85 19.19±1.34 7 d 25.06±1.62 23.78±2.10 24.58±2.90 24.44±1.96 24.61±2.62 15 d 30.74±1.96 25.80±1.48**29.78±4.51 29.18±2.07##30.91±1.81##21 d 35.02±0.61 28.99±0.53**33.32±5.16 32.70±4.92 34.93±5.12#30 d 36.09±3.69 28.94±1.22**36.46±6.04#37.06±5.33##38.94±4.26##
表2 各组小鼠脏器指数变化 (±s,n=10,mg/g)

表2 各组小鼠脏器指数变化 (±s,n=10,mg/g)
组 别空白对照组衰老模型组普通酸奶组琼玉膏组琼玉膏酸奶组心5.47±0.66 4.46±0.22**4.70±0.13 4.67±0.15 5.04±0.13##▲▲★★脾5.80±0.16 4.18±0.11**4.77±0.10##4.91±0.12##5.25±0.19##▲▲★★肝51.43±4.86 42.52±1.83**44.12±5.59 45.25±4.81 47.76±2.07##脑16.61±0.22 12.24±0.50**15.33±0.48##14.13±0.45##16.49±0.31##▲▲★★
表3 各组小鼠肝脏组织中SOD、CAT、GSH-Px 活力和MDA 的含量比较 (±s,n=10)

表3 各组小鼠肝脏组织中SOD、CAT、GSH-Px 活力和MDA 的含量比较 (±s,n=10)
组 别空白对照组衰老模型组普通酸奶组琼玉膏组琼玉膏酸奶组SOD(U/mgprot)123.4±7.86 74.4±2.89**98.3±3.18##84.5±2.65##107.2±4.92##▲▲★★CAT(U/mgprot)23.3±3.04 9.5±0.60**14.8±1.06##14.9±1.85##17.1±1.10##▲▲★GSH-Px(活力单位)475.8±30.36 346.8±17.51**386.9±9.72##400.9±8.36##430.4±16.09##▲▲★★MDA(nmol/mgprot)0.35±0.03 1.17±0.06**0.69±0.02##0.83±0.04##0.51±0.02##▲▲★★
表4 各组小鼠心肌组织中SOD、CAT、GSH-Px 活力和MDA 的含量 (±s,n=10)

表4 各组小鼠心肌组织中SOD、CAT、GSH-Px 活力和MDA 的含量 (±s,n=10)
组 别空白对照组衰老模型组普通酸奶组琼玉膏组琼玉膏酸奶组SOD(U/mgprot)116.2±4.67 68.0±4.70**75.7±1.95##84.5±2.65##97.0±7.10##▲▲★★CAT(U/mgprot)3.85±0.95 1.75±0.40**2.40±0.88 2.69±0.69##3.51±0.62##▲▲★GSH-Px(活力单位)46.13±2.32 15.71±0.92**26.56±1.25##23.98±2.84##30.21±2.95##▲▲★MDA(nmol/mgprot)2.10±0.09 10.3±0.40**7.09±0.62##5.11±0.90##3.76±0.28##▲▲★★
3.5 对小鼠肝、脑形态结构的影响
3.5.1 肝组织形态学变化 空白对照组小鼠肝细胞呈条索状整齐排列,形态规则,界限清晰,细胞间隙小,肝细胞未见水肿及脂肪变性,未见固缩及嗜酸性变,未见凋亡、坏死及炎细胞浸润,肝窦可见。 衰老模型组肝索排列紊乱,细胞形态不规则,界限模糊,肝细胞之间连接松散、间隙大,大量细胞过度收缩,染色质固缩,肝细胞嗜酸性变。 普通酸奶组、琼玉膏酸奶组、琼玉膏组肝索排列较整齐,界限较清,核固缩细胞明显减少,其中琼玉膏酸奶组肝组织细胞形态结构接近于空白对照组。 见封三彩图图1。
3.5.2 脑组织形态学变化
3.5.2.1 小鼠大脑皮质HE 染色结果 空白对照组小鼠大脑皮质神经细胞形态正常,排列整齐,胞核清晰,胞质丰富,着色正常,间质无水肿。 与空白对照组相比,衰老模型组小鼠大脑皮质神经细胞数量显著减少,排列疏松,部分神经元细胞变性,核固缩,呈现三角形或不规则形。 与衰老模型组相比,普通酸奶组、琼玉膏酸奶组、琼玉膏组小鼠大脑皮层神经细胞排列较整齐, 变性细胞数量显著减少,其中琼玉膏酸奶组小鼠大脑皮质神经细胞形态接近于空白对照组。 见封三彩图图2。
3.5.2.2 小鼠海马组织HE 染色结果 空白对照组小鼠海马区有4~5 层锥体细胞, 排列紧密整齐,层次清楚,形态结构清晰完整,染色均匀,细胞胞浆丰富,核仁深染,核圆形,无固缩或溶解。 衰老模型组小鼠海马锥体细胞数量减少,排列疏松紊乱,边界不清,细胞变性,部分神经细胞核固缩变形,细胞浆减少。 普通酸奶组小鼠海马锥体细胞数量较少,排列疏松,有少量细胞核固缩。 琼玉膏酸奶组小鼠海马锥体细胞数量有所增多,排列基本正常,边界清晰,细胞核固缩少见。 琼玉膏组小鼠海马神经元数量较少,排列较密集,边界欠清,可见少量核固缩细胞。 见封三彩图图3。
3.5.2.3 小鼠海马组织尼氏染色结果 空白对照组小鼠海马组织神经元细胞排列整齐均匀,尼氏小体丰富,轮廓清晰。 与空白对照组相比,衰老模型组小鼠海马组织部分神经元细胞轮廓模糊,胞间间隙变大,变性细胞较多,尼氏小体数量减少。 普通酸奶组、琼玉膏组小鼠神经元细胞排列均匀,轮廓较清晰,变性细胞较衰老模型组减少,尼氏小体较衰老模型组增多。 琼玉膏酸奶组神经元细胞在细胞排列、尼氏小体数目有明显改善,接近正常组。 见封三彩图图4。
4 讨论
祖国医学认为,人体健康长寿,其本质就在于脏腑功能的正常协调,即心、肝、脾、肺、肾五脏的共同协调运作。 衰老是五脏虚损共同作用的结果。
本研究将牛乳与琼玉膏这两种皆具抗衰作用的药食相配伍, 运用现代工艺, 制作出抗衰老药膳——琼玉膏酸奶。 方中牛乳作为一种药食同源的食品,可补虚损,益肺胃,养血,生津润燥。 琼玉膏首见于宋代·洪遵的《洪氏集验方》卷一引申铁翁方,由生地黄、茯苓、人参、蜂蜜组成,具有滋阴润肺、健脾益胃、益心补肾、调补气血等作用[3],是集治疗与保健为一体的中医古方[4]。 有文献表明琼玉膏能通过多种途径起到抗衰老作用[5]。
西医认为衰老是体内外各种综合因素(包括基因、营养、饮食、生活方式、心理状态、环境因素等)共同作用的结果[6]。 目前比较公认的学说之一——氧化自由基学说认为在生命活动过程中,体内过量的自由基的产生,会导致组织细胞、生物大分子等氧化损伤和器官功能衰退, 诱导及加速机体衰老,并最终导致死亡[7]。
正常情况下, 机体的内源性酶抗氧化系统和外源性非酶抗氧化系统(抗氧化剂)可减缓氧化应激带来的危害, 以维持体内自由基产生和清除的平衡[8]。内源性酶抗氧化系统中的SOD、CAT、GSH-Px 三者相互协调达到及时清除自由基的目的。MDA 是自由基代谢的最终产物,其含量可反映机体氧化损伤的程度,是老化的重要指标。
伴随着衰老,肝细胞功能发生改变,主要是形态学改变。 刘国安等[9]实验研究表明小鼠模型组肝组织与对照组比较,肝索排列紊乱,细胞间隙大,细胞形态不规则,界限模糊,大量细胞过度收缩,染色质固缩。 神经元数目的减少是脑老化过程的重要标志,其病理改变主要见于大脑皮质和海马。 其中海马又是最易受衰老影响的脑区之一[10],故许多学者将海马作为脑衰老研究的重要指标[11]。
本研究表明,琼玉膏酸奶可通过提高机体抗氧化酶的活性,减少自由基的生成;改善衰老模型小鼠肝、脑组织细胞形态,保护衰老模型小鼠神经元细胞,达到延缓衰老的作用。 本文为琼玉膏酸奶抗衰老机制的进一步研究及开发利用提供了实验依据。
[1]岳丽红,程广东,朱德全,等.西藏灵菇酸奶对人工致衰老小鼠肝肾指数的影响[J].中国老年学杂志,2009,29(21):2 767-2 768.
[2]孙 珊.Urea 酸奶的研制及其抗幽门螺杆菌感染的动物实验研究[D].重庆:重庆医科大学,2009.
[3]刘焕兰,曲卫玲.琼玉膏的古代文献研究[J].陕西中医,2010,31(9):1 231-1 232.
[4]闻 哲.琼玉口服液抗衰老的实验研究[D].广州:广州中医药大学,2011.
[5]刘焕兰, 曲卫玲. 琼玉膏的现代研究进展[J]. 内蒙古中医药,2010,29(16):109-110.
[6]杨 婧.浅谈中医学对衰老的认识[J].中医药导报,2010,16(8):129-132.
[7]Harman D. Aging: atheory based on free radical and radiation chemistry [J]. Gerontol,1956,11(3):298-300.
[8]赵保路.自由基、营养、天然抗氧化剂与衰老[J].生物物理学报,2010,26(1):26-36.
[9]刘国安,郑 炜,杨 红,等.D-半乳糖处理小鼠抗氧化能力及肝和海马区形态学变化的研究[J].西北师范大学学报(自然科学版),2012,48(3):111-115.
[10]Rodriguez RJ, Miranda CL, Stevens JF, et al. Influence of prenylated and non-prenylated flavonoids on liver microsomal lipid peroxidation and oxidative injury in rat hepatocytes[J].Food and Chemical Toxicology,2001,39(5):437-445.
[11]Alia M,Horcajo C,Bravo L,et al. Effect of grape antioxidant dietary fiber on the total antioxidant capacity and the activity of liver antioxidant enzymes in rats [J]. Nutr Res,2003,23(9):125.

