西藏小型猪MSTN基因分子克隆及序列分析
吴清洪,岳 敏,田雨光,2,王玉珏,徐名衬,顾为望,2
(1.南方医科大学实验动物中心比较医学研究所,广州 510515;2.东莞松山湖明珠实验动物科技有限公司,广东东莞 523808)
肌肉生长抑制素(myostatin,MSTN)又称GDF- β(growth differentiation factor β),是生长转化因子β(transforming growth factor beta,TGF-β)超家族的新成员[1-4]。MSTN 在骨骼肌中特异性表达,对肌肉生长有负调控作用,研究表明,该基因的突变在肉牛中会造成骨骼肌异常肥大[5]。通过抑制MSTN活性而增加肌肉量,在猪的分子育种具有潜在的应用价值。因此,该基因被发现后短短几年之内很多物种的MSTN基因得到克隆、测序和定位[6-8]。
乔宪凤等[9]在2010年就以湖北白猪背最长肌肌细胞总RNA为模版,利用RT-PCR技术,扩增出湖北白猪的MSTN基因的cDNA片段,其测序结果与报道的一致。西藏小型猪是2004年南方医科大学实验动物中心从西藏工布江达县引入纯种的45头西藏小型猪,作为实验动物进行封闭群管理[10]。目前已完成风土驯化及实验动物化研究,并开展了相关动物模型、药物实验及转基因克隆等研究。从免疫学、遗传学研究发现,该品系具有独特的免疫相关指标和遗传特征,加上其独特的外形,是一种优良的实验用小型猪品种[11-13]。研究西藏小型猪的MSTN基因,可为进一步开展西藏小型猪分子育种技术研究等提供理论依据。
1 材料和方法
1.1 材料
1.1.1 实验动物:西藏小型猪6月龄1头,来源于南方医科大学实验动物中心【SCXK(粤)2011-0074】,取其肝脏,液氮速冻,-80℃冰箱保存。
1.1.2 主要试剂
RNA提取试剂盒(No.DP419)、质粒小提试剂盒(No.DP103)、DH5α 感受态细胞(No.CB101)购自天根生化科技(北京)有限公司;PrimeScript RT reagent Kit(No.DRR037A)、EX Taq(No.DR001A)、pMD19-T Vector(No.D102A)、HindIII内切酶、EcoRI内切酶均购自宝生物工程(大连)有限公司;DNA凝胶回收试剂盒购自广东省东盛生物科技有限公司;DM2000购自北京康为世纪生物科技有限公司,其他试剂均为国产分析纯。
1.2 方法
1.2.1 RNA的提取
使用天根公司的RNA提取试剂盒提取肝脏组织的总RNA。组织从-80℃冰箱中取出来,用液氮冷却研磨成粉末,倒入去RNA酶的1.5 mL EP管中,加入1 mL Trizol,反复吹打室温静置5 min,按照试剂盒说明按步骤提取。利用核酸蛋白浓度测定仪Nano Drop 2000测RNA浓度及纯度(OD260/OD280),余下样品-20℃保存。
1.2.2 cDNA合成
使用宝生物公司的PrimeScript RT reagent Kit进行逆转录反应。cDNA合成按下列组份配制RT反应液(反应液配制在冰上进行)。5×PrimeScript Buffer 4 μL,PrimeScript RT Enzyme Mix 1 1 μL,Oligo Dt Primer(50 μmol/L)1 μL,Random 6 mers(100 μmol/L)1 μL,Total RNA 1 μg,RNase Free dH2O加至20 μL。反转录反应条件为:37℃ 15 min(反转录反应),85℃ 5 s(反转录酶的失活反应)。-20℃保存备用。
1.2.3 PCR引物的设计和合成
根据GenBank中猪MSTN基因的序列(Gene Accession No.:NM_214435),运用引物设计软件Primer5.0设计特异性引物,由Invitrogen公司合成。引物为:Up(P1):5’-ATGCAAAAACTGCAAATCTA TGTTTATATTTAC-3’,Down(P2):5’-TCATGAGCA CCCACAGCGATCTAC-3’
1.2.4 PCR扩增
在PCR反应管中配置25 μL的反应体系,模板量为0.5 μL猪cDNA扩增MSTN。25 μL的反应体系为 2.5 mmol/L dNTP mixture 2 μL,10 × Ex Taq buffer 2.5 μL,模板 cDNA 0.5 μL,引物 P1 2.5 μL,引物 P2 2.5 μL,ExTaq 0.3 μL,ddH2O 14.6 μL。扩增条件为:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 1 min 20 s,32个循环;72℃ 5 min;16℃保存。
1.2.5 PCR产物的回收纯化
PCR产物经1%琼脂糖电泳后,在紫外条件下,手术刀切取含目的片段的凝胶条带至干净1.5 mLEP管中,利用广东东盛生物科技有限公司的DNA凝胶回收试剂盒纯化目的片段,纯化产物中一部分直接测序,一部分进行克隆测序。
1.2.6 目的片段与载体连接
将纯化的目的片段与pMD19-T载体进行连接,反应体系 10 μL:1 μL pMD19-T Vetor,2 μL 回收的PCR 产物,5 μL SolutionI,2 μL ddH2O。恒温循环水浴16℃连接2 h。
1.2.7 连接产物的转化、复苏和培养
冰浴中将6 μL连接产物加入至30 μLDH5α感受态细胞中,混匀,冰浴30 min,42℃水浴热休克90 s,再冰浴 2 min。分别加入 200 μL LB 培养基(Amp-),混匀,37℃、200 r/min 振荡培养 1 h,将菌液涂布与含氨苄青霉素(Amp+100 μg/mL)的LB平板表面,室温下放置,至液体吸收。倒置平板,转移至37℃生化培养箱中,正置培养1 h后,倒置过夜培养。
1.2.8 质粒的酶切鉴定阳性克隆
从平板上面各接种若干菌落于3 mL LB液体培养基(Amp+)的15 mL离心管中200 r/min,37℃摇床过夜培养。使用天根的质粒小提试剂盒提取质粒,进行酶切鉴定,反应体系为10 μL:4 μL的提取质粒,10 × M Buffer 1 μL,HindIII 0.4 μL、EcoRI0.4 μL。37℃酶切2 h。酶切产物以含溴化乙锭(EB)的1%琼脂糖凝胶电泳分离,凝胶成像系统成像。阳性菌液送金唯智基因公司测序。
2 结果
2.1 RT-PCR结果
从西藏小型猪肝脏组织中提取总RNA,逆转录后,以cDNA为模板,以特异性引物扩增到了1152 bp长的片段,与预期相符(图1)。

图1 RT-PCR扩增结果Fig.1 The electrophoresis of RT-PCR amplification
2.2 重组质粒酶切电泳结果
将西藏小型猪的RT-PCR产物经纯化回收后,插入到pMD19-T载体的外源基因插入位点,构建重组质粒,重组质粒经HindIII内切酶、EcoRI内切酶双酶切(图2)。

图2 重组质粒和酶切鉴定图Fig.2 Identification of recombinant plasmid by digested(HindIII+EcoRI)and plasmid
2.3 西藏小型猪MSTN基因序列分析和比对
利用DNAman、Lasergene等多个生物信息学软件由西藏小型猪MSTN cDNA序列可以获得编码的375氨基酸(图 3)。与 NCBI网站(http://www.ncbi.nlm.nih.gov)BLAST 后 下 载 的 人(NM005259.2)、小 鼠 (NM010834)、大 鼠(NM019151)、山 羊 (HM462261)、黑 猩 猩(NM001079919)、 牛 (GQ184147)、 绵 羊(NM001009428.1)、犬(NM001002959)、版纳微型猪 (JN630464)、 马 (NM001081817)、 鸡(NM001001461)11个物种的氨基酸序列进行比对,相似性分别为95%、92%、91%、95%、95%、94%、94% 、93% 、99% 、97% 、85% 。

图3 西藏小型猪MSTN基因推导蛋白氨基酸序列Fig.3 The putative amino acid sequence of MSTN gene of Tibet mini-pigs
2.4 西藏小型猪MSTN进化树
利用Mega6.0软件将西藏小型猪的MSTN氨基酸序列与人、小鼠、大鼠、山羊、黑猩猩、牛、绵羊、犬、版纳微型猪、马、鸡、斑马鱼12个物种的MSTN氨基酸序列构建进化树(图4)。结果显示,西藏小型猪MSTN基因除了与鸡和斑马鱼亲缘关系较远外,与其他10个物种较为接近,其中与版纳微型猪的亲缘关系最为接近。
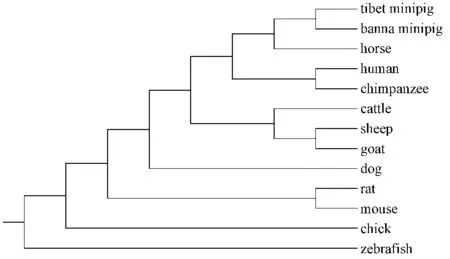
图4 MSTN分子系统进化树Fig.4 The phylogenetic tree of MSTN protein
3 讨论
1997年,McPherron等通过筛选小鼠的骨骼肌cDNA文库而得到全长的cDNA序列。分析表明,小鼠Myostatin cDNA序列中只有一个开放阅读框架(opening reading frame,ORF),编码 376个氨基酸,具有TGF-β超家族的典型结构,但与其它TGF-β家族成员的同源性很低,因而被为新一类:GDF-8(growth-differentiation factor 8)。研究表明,GDF-8前肽C-末端区域对其功能的稳定性具有重要的作用,抑制性区域位于氨基酸42~115之间[14-16]。国外Lee及其同事Daneau等[17]都报道了猪肌生成抑制素基因的cDNA序列,综合两者的结果,已得到1756 bp的猪肌生成抑制素cDNA序列,其中1~1125 bp编码氨基酸序列,表明猪肌生成抑制素前体由375个氨基酸组成。本研究通过对西藏小型猪的MSTN基因的cDNA序列进行了克隆测序,发现MSTN基因编码区全长 1128 bp,利用 DNAman、Lasergene等多个生物信息学软件由西藏小型猪MSTN cDNA序列可以获得编码的375氨基酸。与版纳微型猪进行比对分析发现在307位的氨基酸由N→S。
在与人、小鼠、大鼠、山羊、黑猩猩、牛、绵羊、犬、版纳微型猪、马、鸡11个物种的氨基酸序列进行比对,相似性分别为 95%、92%、91%、95%、95%、94%、94%、93%、99%、97%、85%,发现西藏小型猪与版纳微型猪的相似性最高,达99%。与人、山羊、黑猩猩、马相应序列同源性都超过了94%。表明西藏小型猪与11个物种间在该基因编码区核苷酸序列间具有较高的保守性。
分子系统进化树表明MSTN基因西藏小型猪除了与鸡和斑马鱼亲缘关系较远外,与人、犬、版纳微型猪、绵羊、山羊、牛、马、黑猩猩、大鼠、小鼠的关系都较为接近,其中与版纳微型猪的亲缘关系最为接近,这也更进一步说明了西藏小型猪与版纳微型猪是亲缘关系较近的两个猪种,只是在该基因核苷酸和氨基酸水平上有很小差异,说明了西藏小型猪与版纳小型猪起源及进化程度有所不同,它们在DNA水平上有极小的差异,这也为进一步开展西藏小型猪分子育种技术研究等提供了理论依据。
[1] Mcpherron A C,Lee S J.Double muscling in cattle due to mutations in the Myostatin gene[J].Proc Natl Acad Sci USA,1997,94(23):12457 -12461.
[2] 岳敏,顾冬生,李洪涛,等.西藏小型猪MSTN基因5’调控区的酶切多态性分析[J].实验动物与比较医学,2008,28(3):155-159.
[3] 王伟,连林生,李继中,等.猪 MSTN基因生物信息学分析[J].安徽农业科学,2012,40(10):5943 -5945.
[4] 刘晓琴,马喜山,唐中林,等.猪MSTN基因的多态性和生长性状关联分析[J].畜牧兽医学报,2013,44(7):1063-1069.
[5] Holmes J H G,Ashmore C P.A histochemical study of mutable site fiber type and size in normal and double muscled cattle[J].Growth,1972,36:351 - 352.
[6] Kollias H D,McDermott C.Transforming growth factor-β and myostatin signaling in skeletal muscle[J].J Appl Physiol,2008,104:579- 587.
[7] Hill J J,Davies M V,Pearson A A,et al.The myostatin propeptide and the follistatin-related gene are inhibitory binding proteins of myostatin in normal serum[J].J Biol Chem,2002,277(43):40735 - 40741.
[8] Ji S,Losinski R L,Cornelius S G,et al.Myostatin expression in porcine tissues:tissue specificity and developmentaland postnatal regulation[J].American Journal of Physiology,1998,275:1265- 1273.
[9] 乔宪凤,刘西梅,华文君,等.猪肌肉生成抑制素(MSTN)基因cDNA克隆及序列分析[J].江西农业学报,2010,22(10):130-132.
[10] 李洪涛,顾为望,袁进,等.实验用西藏小型猪原代和第一代间部分血液指标比较[J].郑州大学学报(医学版),2008,43(1)63-65.
[11] 王玉珏,郭凯,陈驰,等.不同辐射剂量对西藏小型猪小肠线粒体的影响[J].南方医科大学学报,2012,32(10):1445-1450.
[12] 黄威,毛莹莹,刘薇,等.3种腺相关病毒介导的绿色荧光蛋白对西藏小型猪胚胎成纤维细胞的转染效率[J].南方医科大学学报,2012,32(6):857 -861.
[13] 李洪涛,吴清洪,袁进,等.实验用西藏小型猪线粒体DNA控制区变异类型及其血液指标比较研究[J].南方医科大学学报,2009,29(8):1626 -1628.
[14] M cPherron A C.et al.Regulation of skeletal muscle mass in m ice by a new TGF-B superfam ilymember[J].N ature,1997,(387):83- 90.
[15] M cPherron A C,L ee S J.The transforming growth factor betasuper family[A].In:B.D.L eRo ith and C.Bondy,edito rs.Grow th facto rs and cytok ines in health and disease.(Volume 1)[M].JA I P ress Inc.Greenw ich,Connecticut,U SA,1996.357-393.
[16] Bogdanovich S, Krag TO, Barton ER, et al. Functional improvement of dystrophic muscle by myostatin blockade[J].Nature,2002 Nov 28:420(6914):418 -421.
[17] 张利媛,岳文斌.MSTN基因的研究进展[J].草食家畜,2006(132):1-4.

