携带肝细胞生长因子基因的减毒沙门菌促血管形成的实验研究
哈小琴,郭馨云,葛秀洁,杨迎桂,朱晓红,张萍,杨淑娟,薛荣利,张媛媛,肖娜娜
·论著·
携带肝细胞生长因子基因的减毒沙门菌促血管形成的实验研究
哈小琴,郭馨云,葛秀洁,杨迎桂,朱晓红,张萍,杨淑娟,薛荣利,张媛媛,肖娜娜
目的 探讨携带肝细胞生长因子(HGF)基因的减毒沙门菌体外促血管形成的效应。
方法 构建携带 HGF 基因真核表达载体的减毒沙门菌菌株(TPH),体外转染人脐静脉内皮细胞(HUVEC)后观察目的基因表达及其增殖活性;评价 TPH 的细胞表达上清对鸡胚绒膜尿囊膜血管生成效应的刺激效应。
结果 构建的 TPH 菌株在体外可有效转染 HUVEC 并表达有活性的 HGF 蛋白,6 × 105个 HUVEC 细胞可表达160~190 ng 的 HGF 蛋白,和对照组相比,TPH 转染组细胞表达上清可明显促进 HUVEC 增殖,而且具有剂量-效应关系;TPH 转染组细胞表达上清也刺激鸡胚绒膜尿囊膜小血管生成,其血管数量(133.0 ± 11.5)/cm2明显大于转染 TP 的 HUVEC 细胞上清组(83.3 ± 5.5)/cm2和对照组(62.7 ± 7.1)/cm2(P < 0.05)。
结论 携带 HGF 基因的减毒沙门菌可有效转染 HUVEC并促进细胞增殖,刺激小血管新生,可能在组织创面愈合中起重要作用,在胃溃疡治疗中有潜在的应用价值。
肝细胞生长因子;基因转移技术;血管生成诱导剂;转化,细菌;减毒沙门菌
血管发生或新生在胚胎器官的发育、出生后创面伤口愈合及多种病理情况下都起着非常关键的作用[1-3]。近年来研究表明,生长因子在细胞的增殖、迁移、损伤修复、溃疡愈合及免疫调节等方面起重要作用,已有研究表明,肝细胞生长因子(hepatocyte growth factor,HGF)是一种多功能生物因子,具有促进血管内皮细胞增殖和新血管形成作用,还可促进组织细胞的再生、抑制细胞凋亡,可以调节炎症、促进创伤愈合[4-5]。胃溃疡是一种常见消化道疾病,其病程常反复且迁延不愈,而上皮化和血管形成是胃溃疡愈合必不可少的过程,因此,本研究依据胃溃疡愈合过程原理,构建了携带 HGF 基因真核表达载体的减毒的沙门菌菌株(TPH),该菌株具有以下优势和特点:①采用的是基因治疗方法,使局部转染质粒的真核细胞作为一“微型药物工厂”持续一定时间分泌表达 HGF 活性蛋白;②利用 HGF的多功能修复作用,促血管形成;③减毒沙门菌是一良好的口服基因传递载体[6],对胃肠黏膜组织有亲嗜作用[7],有望发展成一种口服基因治疗药物;④HGF 已证明可抑制瘢痕[8],可减少愈合后的溃疡瘢痕,可能阻止并发症的发生。从而认为该菌株可能具有促进胃溃疡愈合的作用。
本文旨在探讨构建的 TPH 的促血管形成效应,为其促进胃溃疡创面愈合机制提供实验依据。
1 材料与方法
1.1 材料
人胎盘 cDNA 文库、pSK 购自美国 Clontech公司;pEGFP-N1 及 pcDNA3 为本室保存;琼脂糖、Taq 酶、dNTP、限制性内切酶、T4 DNA 连接酶、核酸凝胶回收试剂盒均购自生工生物工程(上海)股份有限公司;酵母提取物及蛋白胨购自美国Merck 公司;Ty21a 菌株为军事医学科学院惠赠;人脐静脉内皮细胞(HUVEC)购自美国模式菌种收集中心(ATCC);DMEM 和胎牛血清购自美国Gibco 公司;抗人 HGF 单克隆抗体、重组人 HGF蛋白纯品购自美国 R&D 公司;辣根过氧化物酶标记的羊抗鼠 IgG 购自美国 Santa Cruz Biotechnology公司;孵育第 13 天的鸡胚购自中国农业科学院畜牧研究所;M450 甲基纤维素购自美国 Sigma 公司;Multiporator 4308 型电转仪购自德国 Eppendorf公司。
1.2 方法
1.2.1 携带 HGF 基因减毒沙门菌菌株的构建
1.2.1.1 携带人 HGF 基因的真核表达载体pcK-HGF 的构建 按人 HGF cDNA 序列设计引物,正向引物序列为 5' ccatcgatgttaacatgtgggtgaccaa actc 3',反向引物序列为 5' tgggatccgcggccgcctatgact gtggtacctt 3'。从人胎盘 cDNA 文库克隆人 HGF cDNA(约 2.2 kb)。并将 HGF 基因的 PCR 产物克隆至 pSK 载体的 BamH I 和 Sal I 酶切位点中,命名为 pSK-HGF。将 pcDNA3 载体用 Ssp I及 Avr II 双酶切,回收大片段(约 4.9 kb),pEGFP-N1 用 Avr II 酶切,回收小片段(卡那霉素基因,1.1 kb),用 T4 DNA 连接酶将回收的大小片段连接,获得卡那霉素抗性的 pcDNA3 载体,以避免患者青霉素过敏,命名为 pcK。分别用BamH I 和 Apa I 双酶切 pcK 及 pSK-HGF,回收大片段及小片段,用 T4 DNA 连接酶连接,获得携带人 HGF 基因的含卡那霉素抗性基因的真核表达载体,命名为 pcK-HGF。
1.2.1.2 真核表达质粒 pcK-HGF 电穿孔转化减毒沙门菌 将减毒沙门菌 Ty21a 接种于 LB 培养液,振荡培养至对数生长中期,低温 4000 r/min离心收集菌体,用预冷的无菌去离子水洗涤细胞2 次后重悬。用电转仪将 pcK-HGF 和 pcK 质粒各 0.2 μg 转入 200 μl 预处理的 Ty21a。37 ℃ 轻柔振荡培养 45 min 后涂布于含卡那霉素(100 mg/L)固体 LB 培养基平皿继续培养,次日挑取菌落进行鉴定。
1.2.1.3 阳性工程菌的筛选 从培养板挑取单菌落分别接种于含卡那霉素 LB 培养液中,37 ℃ 振摇培养。转入 pcK-HGF 的减毒沙门菌阳性菌株的筛选通过卡那霉素抗性、PCR(利用菌液为模板,扩增真核表达启动子 CMV 及目的基因 HGF)及提取质粒后 BamH I/Apa I 双酶切鉴定;转入 pcK的减毒沙门菌菌株的筛选通过卡那霉素抗性及PCR 筛选(利用菌液为模板,扩增真核表达启动子CMV)。CMV 扩增引物:5' cccagtacatgaccttatggg 3',5' ggagacttggaaatccccgt 3'。HGF 扩增引物:5' ccatcga tgttaacatgtgggtgaccaaactc 3',5' tgggatccgcggccgcctatg actgtggtacctt 3'。
1.2.2 重组减毒沙门菌活性观察
1.2.2.1 重组减毒沙门菌转染 HUVEC 将HUVEC 接种于 6 孔细胞培养板中,每孔 6 × 105个细胞,次日用无抗生素 DMEM 培养液洗涤细胞 2 次,分别将 1 × 108cfu 携带 pcK 和携带pcK-HGF 质粒的减毒沙门菌加入 HUVEC 细胞中,37 ℃ 共孵育 30 min,用含庆大霉素(50 mg/L)的无血清培养基洗涤细胞后加入含 10% 胎牛血清的 DMEM 培养基,37 ℃ 孵育 4 h 后加入四环素至终浓度为 10 mg/L,继续培养 48 h 收集细胞上清,用双抗夹心ELISA 法检测上清中 HGF 的表达水平。一抗为抗人 HGF 单克隆抗体(1 μg/ml),二抗为辣根过氧化物酶标记的羊抗鼠 IgG,用新鲜配制的 OPD 底物显色液显色,同时用重组人HGF 标准蛋白作标准曲线,以计算上清中 HGF的表达量。
1.2.2.2 HGF 表达上清对 HUVEC 的作用分析 采用 MTT 法测定细胞增殖活性。将 HUVEC接种于 96 孔细胞培养板中,每孔细胞数 5 × 103个。12 h 后吸弃原培养液,每孔加入 100 μl 无血清 DMEM,HGF 表达上清所加的量分别含HGF 100、200、400、800、1600 pg。72 h 后每孔加入 20 μl MTT,37 ℃ 孵育 4 h 后,弃上清,用DMSO 溶解沉淀,测其在 560 nm 波长处吸光度(A)。
1.2.2.3 HGF 表达上清对鸡胚绒膜尿囊膜血管刺激作用观察 采用我们前期报道的实验方法制备甲基纤维素碟[9]。实验分三组:转染携带pcK-HGF 质粒的减毒沙门菌的 HUVEC 细胞上清组(HGF 表达产物 800 pg)、转染携带 pcK 质粒的减毒沙门菌的 HUVEC 细胞上清组(同体积上清)及对照组(同体积转染 PBS 的 HUVEC 细胞上清),分别将三组上清加入甲基纤维素碟内,每组 6 胚,按操作程序进行下一步实验操作[8]。之后按文献[9]方法计数每组以甲基纤维素碟为中心周围 1 cm2辐射出新生小血管的数量。
1.3 统计学处理
2 结果
2.1 携带 HGF 基因减毒沙门菌菌株 TPH 的构建
2.1.1 HGF 表达质粒的鉴定 对 PCR 所得HGF cDNA 测序结果表明,其序列与 GenBank 已公布的人 HGF cDNA 序列(M60718.1)完全一致。克隆至真核表达载体 pcK 后采用限制性内切酶及抗生素抗性鉴定。用 BamH I 和 Apa I 双酶切后可在琼脂糖凝胶电泳图上见一约 2.2 kb 的 DNA 片段(图1),质粒转化后可在含卡那霉素的琼脂培养板上生长转化子克隆。表明我们成功构建了HGF 的表达质粒 pcK-HGF。
2.1.2 阳性工程菌的筛选 工程菌可在含卡那霉素的 LB 琼脂平板上生长,从单克隆中 PCR 可扩增出真核表达启动子 CMV 和目的基因 HGF(图2),提取质粒用 BamH I/Apa I 双酶切后,在电泳图上可见一约 2.2 kb 的 DNA 片段(图3),表明 pcKH 已成功转入减毒沙门菌菌株,命名为TPH。
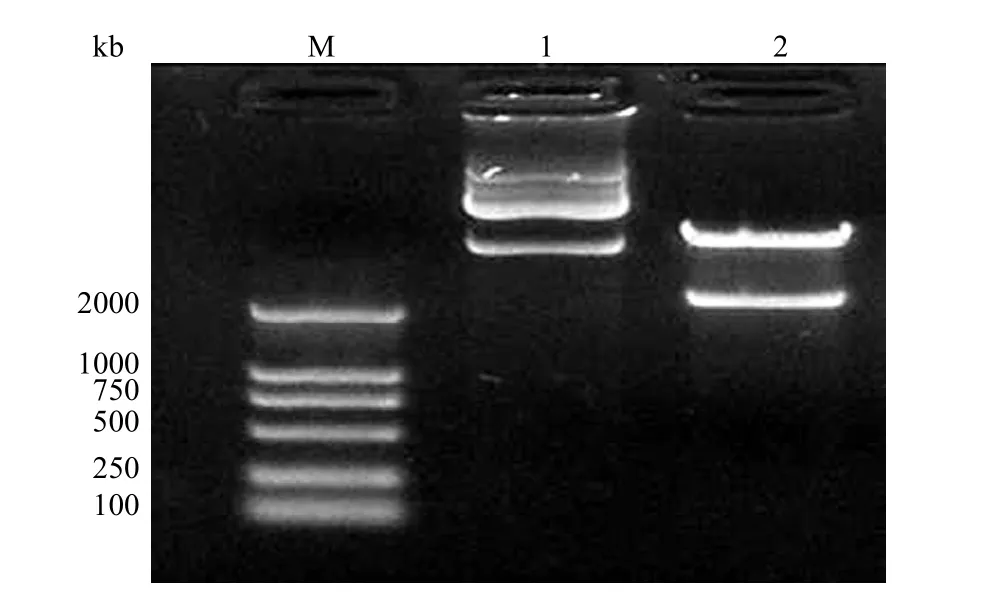
图1 BamH I 和 Apa I 酶切质粒 pcK-HGF 结果Figure 1 Electrophoresis diagram of restriction analysis products of pcK-HGF
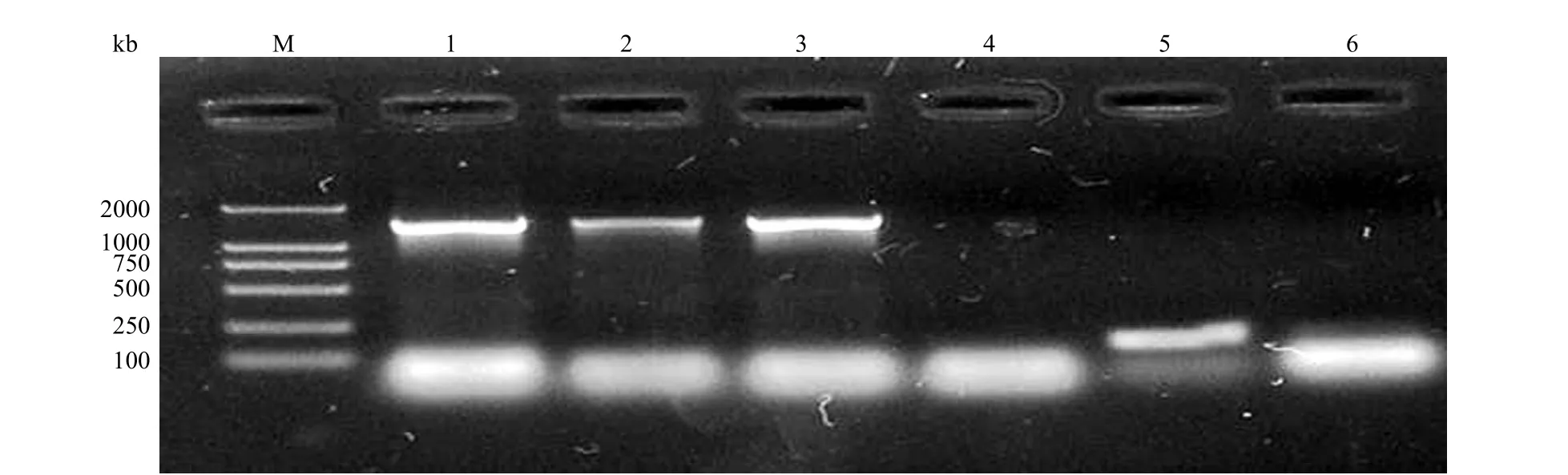
图2 以菌液为模板 PCR 扩增真核表达启动子 CMV 和目的基因 HGFFigure 2 Electrophoresis diagram of PCR products of CMV and HGF genes

图3 重组菌液质粒 pcK-HGF 的 BamH I 和 Apa I 酶切鉴定Figure 3 Electrophoresis diagram of restriction analysis products
2.2 TPH 转染 HUVEC 后 HGF 的表达及对HUVEC 细胞的增殖刺激活性 1 × 108cfu TPH 转染 HUVEC 细胞 48 h 后,用双抗夹心 ELISA 方法检测上清中 HGF 的表达。结果表明,6 × 105个 HUVEC 细胞可表达 160~190 ng 的 HGF 蛋白。采用 MTT 法分析了含不同剂量 HGF 表达上清对 HUVEC 细胞的作用,结果表明,含 HGF 表达上清有明显刺激 HUVEC 增殖的活性(P <0.05),而且具有剂量-效应关系。加入 800 pg 表达上清时刺激活性达高峰,剂量加大活性不再明显增加(图4)。
2.3 细胞表达上清对鸡胚绒膜尿囊膜血管刺激作用 置入含细胞表达上清的甲基纤维素碟后,鸡胚绒膜尿囊膜(chicken chorioallantoic membrane,CAM)继续孵育 3 d,之后将鸡胚绒膜尿囊膜固定后取出,以小碟为中心计数小血管数。结果对照组在小碟周围观察到较弱的生血管效应,转染 TP 的HUVEC 细胞上清组观察到较明显的小血管增多现象,转染 TPH 的 HUVEC 细胞上清组(HGF 表达产物 800 pg)以小碟为中心观察到明显的毛刷样小血管形成(图5),转染 TPH 的 HUVEC 细胞上清组血管数量为(133.0 ± 11.5)/cm2,明显大于转染 TP 的 HUVEC 细胞上清组(83.3 ± 5.5)/cm2和对照组(62.7 ± 7.1)/cm2(P < 0.05)。
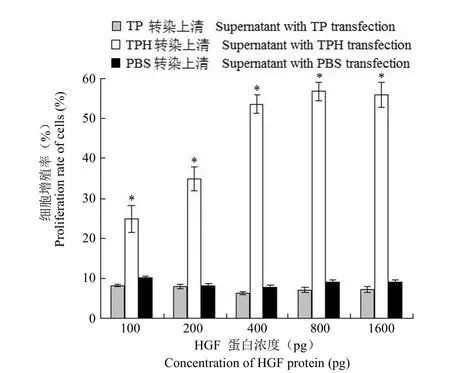
图4 表达上清对 HUVEC 的增殖刺激活性(*P < 0.05)Figure 4 HGF expression supernatant induced HUVEC cells proliferation (*P < 0.05)
3 讨论
HGF 最初是从血浆和血小板中纯化获得并认为是一种刺激肝细胞增生的有丝分裂原,对肝切除或化学损伤后的肝再生起重要作用。目前,已知HGF 主要来源于内皮细胞、成纤维细胞、脂肪细胞等间质细胞,由前体蛋白(Pro-HGF)经剪切、糖基化等翻译加工合成,由 69 kD 的 α 亚基和34 kD 的 β 亚基组成的异二聚体。HGF 受体为C-met 癌基因编码的蛋白质,结构上属于 11 型酪氨酸激酶受体,具有细胞外结合、跨膜和细胞内激酶区域。
HGF 的作用是通过与其受体结合而实现的[10]。HGF 作用于多种类型的细胞,具有多样的生物学作用。它可刺激细胞增殖,修复组织器官的损伤,发挥有丝分裂原的作用,可促进胚胎的发育及各类组织器官的形态发生,发挥形态发生原的作用,它还可促进细胞的迁移和侵袭,对某些组织的形成和发育及肿瘤的转移、侵袭具有重要意义。已有许多研究表明 HGF 能促进内皮细胞增殖迁移,促进损伤局部血管形成[11-12]。血管发生的研究起初是用于肿瘤血管发生机制的探讨[13],之后研究领域渐渐扩大,如血管的发育来源、血管发生的分子特性及基因调控、肿瘤的诊断治疗、缺血性疾病的治疗和创面愈合等[14-19],也用于筛选治疗缺血性疾病、促进伤口愈合和抗肿瘤的药物。显微水平血管研究实验模型多用鼠或兔角膜和 CAM,本研究我们选择了CAM 作为体内 TPH 促血管形成治疗溃疡愈合潜能的模型,CAM 是鸡胚发育第 4 天由体中胚层和脏壁中胚层融合而成的富含血管的膜,由内向外由内皮细胞层、大血管层、毛细血管筛层 3 层组成,负责血气交换[20]。因 CAM 容易获得且此模型操作简单、快速、经济、有效,多用于血管形成效应研究[21]。本实验结果表明对照组在小碟周围观察到较弱的生血管效应,转染 TP 的 HUVEC 细胞上清组观察到较明显的小血管增多现象,转染 TPH 的HUVEC 细胞上清组以小碟为中心观察到明显的毛刷样小血管形成,通过定量计数转染 TPH 的HUVEC 细胞上清组血管数量明显大于转染 TP的 HUVEC 细胞上清组和对照组(P < 0.05)。
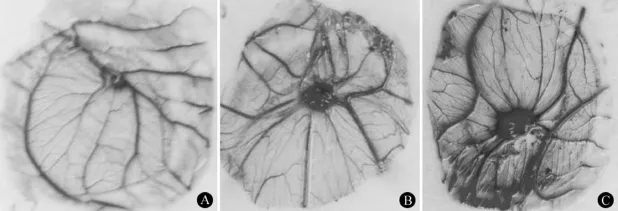
图5 HGF 表达上清对鸡胚绒膜尿囊膜血管刺激活性(A:转染 PBS 的正常对照组;B:转染 TPH 的 HUVEC 细胞组;C:转染 TP 的 HUVEC 细胞组;*转染 TPH 组与 TP 及 PBS 对照组相比,P < 0.05)Figure 5 Angiogenic activity of HGF expression product on the chick chorioallantoic membrane (A: Normal control group; B:HGF expression supernatant group; C: TP-transfected on CAM group;*TPH group vs TP group and control group, P < 0.05)
在组织损伤再修复中,上皮和间质间存在极为重要的信息交换,HGF 是机体间质和上皮信息交换分子。在胃溃疡愈合过程中,HGF 和 c-met 受体表达增加,醋酸型溃疡主要是由于醋酸直接损伤胃壁组织,引起局部血循环障碍而造成的[22],Brozowski 等[23]研究认为用 HGF 治疗胃溃疡能通过影响 COX-2 的表达和胃黏膜血流而加速溃疡愈合。大鼠胃黏膜 HGF mRNA 分布于再生腺体与黏膜下组织动脉血管之间的基质细胞中,其受体c-met mRNA 则位于再生腺体上皮细胞,HGF 能使正常大鼠胃黏膜上皮细胞环氧化酶-2 mRNA 和蛋白表达分别增加至 236% 和 175%。环氧化酶-2系前列腺素合酶,能促进前列腺素的合成,而前列腺素对胃黏膜细胞具有保护作用,能增加黏膜的血液循环,HGF 也可能通过增加前列腺素合成促进胃溃疡的愈合。由此可见,我们构建的携带 HGF基因的减毒沙门菌 TPH 有潜在治疗胃溃疡的作用,其体内防治胃溃疡的效果有待进一步研究。
本研究所选用的减毒沙门菌株 Ty21a 是由Germanier[24]于 1975年将其野型株 Ty2 经化学突变剂亚硝基胍处理而获得的突变株,是目前用于人群预防的减毒疫苗株。研究中我们利用减毒沙门菌作为基因传递载体的优势,用 Ty21a 作为载体将HGF 基因携带至损伤创面局部,使局部转染质粒的细胞作为一“微型药物工厂”持续一定时间分泌表达 HGF 活性蛋白而发挥其多功能生物作用。由于 HGF 蛋白半衰期极短,容易降解,给药不方便,而且成本高;培养携带 HGF 基因的减毒鼠伤寒沙门菌成本低,繁殖快;而编码外源基因的真核质粒递呈入抗原提呈细胞,外源基因在其中表达并持续释放,从而达到基因治疗疾病的目的。
综上所述,本实验通过构建携带肝细胞生长因子基因真核表达载体的减毒沙门菌菌株 TPH,体外观察 TPH 在 HUVEC 中的表达情况,然后探讨目的基因表达上清对 HUVEC 的增殖活性,并评价表达上清对鸡胚绒膜尿囊膜血管生成效应的刺激效应,目的是评价携带 HGF 基因的减毒沙门菌株TPH 是否在组织创面愈合中通过促进血管形成而起促愈合作用。本实验结果提示,TPH 可能在溃疡治疗中有潜在的应用价值。
[1] Patan S. Vasculogenesis and angiogenesis. Cancer Treat Res, 2004,117:3-32.
[2] Ud-Din S, Sebastian A, Giddings P, et al. Angiogenesis is induced and wound size is reduced by electrical stimulation in an acute wound healing model in human skin. PLoS One, 2015, 10(4):e0124502.
[3] Zhao Q, Li Z. Angiogenesis. Biomed Res Int, 2015:135861.
[4] Ko SH, Bandyk DF. Therapeutic angiogenesis for critical limb ischemia. SeminVasc Surg, 2014, 27(1):23-31.
[5] Li J, Zheng CQ, Li Y, et al. Hepatocyte growth factor gene-modified mesenchymal stem cells augment sinonasal wound healing. Stem Cells Dev, 2015, 24(15):1817-1830.
[6] Darji A, Guzmán CA, Gerstel B, et al. Oral somatic transgene vaccination using attenuated S. typhimurium. Cell, 1997, 91(6):765-775.
[7] Li Z, Yin PH, Yang SS, et al. Recombinant attenuated Salmonella typhimurium carrying a plasmid co-expressing ENDO-VEGI151 and survivin siRNA inhibits the growth of breast cancer in vivo. Mol Med Rep, 2013, 7(4):1215-1222.
[8] Xiao Z, Xi C. Hepatocyte growth factor reduces hypertrophy of skin scar: in vivo study. Adv Skin Wound Care, 2013, 26(6):266-270.
[9] Ha XQ, Fu SF, Li YM, et al. Stimulatory effect of hepatocyte growth factor on angiogenesis of chicken chorioallantoic membrane. Bull Acad Milit Med Sci, 2002, 26(4):254-256, 261. (in Chinese)
哈小琴, 付生法, 李元敏, 等. 质粒pUDKH刺激鸡胚绒膜尿囊膜血管生成效应的研究. 军事医学科学院院刊, 2002, 26(4):254-256,261.
[10] Nakamura T, Nawa K, Ichihara A. Partial purification and characterization of hepatocyte growth factor from serum of hepatectomized rats. Biochem Biophys Res Commun, 1984, 122(3):1450-1459.
[11] Ha XQ, Ren JP, Bi JJ, et al. Therapeutic angiogenesis induced by human hepatocyte growth factor gene in dog hindlimb ischemia models. Chin Sci Bull, 2003, 48(7):676-680.
[12] Wu DL, Zhang YR, Lao MF, et al. Therapeutic angiogenesis induced by human hepatocyte growth factor gene in rat myocardial ischemia models. Chin Sci Bull, 2003, 48(3):273-276.
[13] Ingber D, Fujita T, Kishimoto S, et al. Synthetic analogues of fumagillin that inhibit angiogenesis and suppress tumour growth. Nature, 1990, 348(6301):555-557.
[14] Nowak-Sliwinska P, Weiss A, van Beijnum JR, et al. Angiostatic kinase inhibitors to sustain photodynamic angio-occlusion. J Cell Mol Med, 2102, 16(7):1553-1562.
[15] Kleibeuker EA, Ten Hooven MA, Castricum KC, et al. Optimal treatment scheduling of ionizing radiation and sunitinib improves the antitumor activity and allows dose reduction. Cancer Med, 2015,4(7):1003-1015.
[16] Pal S, Wu J, Murray JK, et al. An antiangiogenic neurokinin-B/thromboxane A2 regulatory axis. J Cell Biol, 2006, 174(7):1047-1058.
[17] Manjunathan R, Ragunathan M. In ovo administration of human recombinant leptin shows dose dependent angiogenic effect on chicken chorioallantoic membrane. Biol Res, 2015, 48:29.
[18] Chen J, Chen AY, Huang H, et al. The flavonoid nobiletin inhibits tumor growth and angiogenesis of ovarian cancers via the Akt pathway. Int J Oncol, 2015, 46(6):2629-2638.
[19] Stasi MA, Scioli MG, Arcuri G, et al. Propionyl-L-carnitine improvespostischemic blood flow recovery and arteriogenetic revascularization and reduces endothelial NADPH-oxidase 4-mediated superoxide production. Arterioscler Thromb Vasc Biol, 2010, 30(3):426-435.
[20] Metcalfe J, Bissonnette JM, Bowles RE, et al. Hen's eggs with retarded gas exchange. I. Chorioallantoic capillary growth. Respir Physiol, 1979, 36(2):97-101.
[21] Schlatter P, Konig MF, Karisson LM, et al. Quantitative study of intussusceptive capillary growth in the chorioallantoic membrane(CAM) of the chicken embryo. Microvasc Res, 1997, 54(1):65-73.
[22] Takagi K, Okabe S, Saziki R. A new method for the production of chronic gastric ulcer in rats and the effect of several drugs on its healing. Jpn J Pharmacol, 1969, 19(3):418-426.
[23] Brozowski T, Konturek PC, Konturek SJ, et al. Involvement of cyclooxygenase (COX)-2 products in acceleration of ulcer healing by gastrin and hepatocyte growth factor. J Physiol Pharmacol, 2000,51(4 Pt 1):751-773.
[24] Germanier R. Effectiveness of vaccination against cholera and typhoid fever. Monogr Allergy, 1975, 9:217-230.
Methods A stable strain (TPH), recombinant attenuated Salmonella carrying HGF gene eukaryotic expression vector, was constructed. The TPH was transfected into human umbilical vein endothelial cells (HUVEC). And the express level of HGF interest protein was assessed by ELISA. Effects of the expression product after TPH transfection on HUVEC proliferation and angiogenesis were assayed by MTT and chicken embryos chorionic allantois membrane (CAM) stimulating activity, respectively.
Results The TPH could be effectively transfected into HUVEC in vitro and highly express HGF interest protein. The expression concentration of HGF protein is (160-190)ng/ml by 6 × 105cells. The expression supernatant after TPH transfection could significantly stimulate the proliferation of HUVEC, with a dose-effect relation, compared with the supernatant (same volume as HGF expression supernatant) from TP-transfected and control groups. The expression of HGF supernatant after TPH transfection also could significantly promote the angiogenesis of chorioallantoic membrane (CAM). The numbers of blood vessel in expression supernatant from TP-transfected group (83.3 ± 5.5)/cm2and PBS group (62.7 ± 7.1)/cm2were significant fewer than that in HGF expression product from TPH-transfected group (133.0 ± 11.5)/cm2(P < 0.05).
Conclusion TPH can effectively transfect HUVEC and promote the cell proliferation, stimulate angiogenesis, may play an important role in wound healing in organization, has potential application value in gastric ulcer treatment.
Stimulatory effect of hepatocyte growth factor gene on angiogenesis mediated by attenuated Salmonella
HA Xiao-qin, GUO Xin-yun, GE Xiu-jie, YANG Ying-gui, ZHU Xiao-hong, ZHANG Ping, YANG Shu-juan, XUE Rong-li,ZHANG Yuan-yuan, XIAO Na-na
Objective To investigate the stimulatory effect of TPH, a recombinant attenuated Salmonella strain carrying hepatocyte growth factor (HGF) gene eukaryotic expression vector, on angiogenesis in vitro.
Hepatocyte growth factor;Gene transfer techniques;Angiogenesis inducing agents;Transformation, bacterial;Salmonella typhimurium
HA Xiao-qin, Email: haxiaoqin2013@163.com
10.3969/j.issn.1673-713X.2015.06.011
国家自然科学基金(81273568);甘肃省杰出青年基金(2011GS03841);解放军总后勤部后勤科研项目(CLZ11J09)
730050 兰州军区兰州总医院检验中心/甘肃省干细胞与基因药物重点实验室
哈小琴,Email:haxiaoqin2013@163.com
2015-08-06
www.cmbp.net.cn 中国医药生物技术, 2015, 10(6):522-527
Author Affiliation: Department of Clinical Laboratory Medicine, Key Laboratory of Stem Cell and Gene Drug in Gansu Province,Lanzhou General Hospital of Lanzhou Military Region, Lanzhou 730050, China
www.cmbp.net.cn Chin Med Biotechnol, 2015, 10(6):522-527

