体外右美托咪定对MGC-803胃癌细胞增殖的影响*
曾涟 阳丽云
体外右美托咪定对MGC-803胃癌细胞增殖的影响*
曾涟①阳丽云①
目的:探讨体外右美托咪定对MGC-803胃癌细胞增殖的影响。方法:将MGC-803胃癌细胞随机分为六组,右美托咪定组(A1、A2、A3、A4、A5组)和对照组(C组),右美托咪定组各组的右美托咪定终浓度分别为1000、100、10、1、0.1 ng/mL,通过MTT实验检测各组OD值,并计算增殖率。结果:右美托咪定组各组OD值及增殖率与C组比较差异均无统计学意义(P>0.05)。结论:体外右美托咪定对MGC-803胃癌细胞的增殖无明显影响。
右美托咪定; MGC-803胃癌细胞株; 增殖
胃癌是我国常见恶性肿瘤之一,胃癌基本居恶性肿瘤发病率及死亡率的前3位[1]。胃癌患者的预后除了与胃癌分型、胃癌分期等疾病本身的因素相关外,与手术、化疗、放疗等处理因素及患者自身的心理因素也密切相关。手术是胃癌患者的主要治疗方式,手术中各个环节都可能对患者的预后产生重要影响。麻醉作为手术中的重要环节,麻醉目前的任务已不仅仅是配合外科医生完成手术过程,保证患者术中生命体征平稳,麻醉对患者预后的影响已逐步成为目前麻醉学关注的方向及研究的热点。目前已有阿片类药物通过影响细胞免疫及体液免疫对肿瘤患者的预后产生影响的相关文献报道,也有关于吸入麻醉药物对细胞免疫应答影响的相关研究。右美托咪定是一种高选择性α2受体激动剂,对α2肾上腺素受体的选择性是α1受体的1620倍,1985年研制成功,1999年美国食品及药物管理局(US Food and Drug Administration,FDA)批准将其应用于重症监护病房短于24 h的镇静,2009年才批准在全身麻醉的手术患者应用于气管插管和机械通气时的镇静等方面,作为一种新型药物,其临床应用时间很短,到目前为止右美托咪定应用于全麻患者也只有6年,目前对右美托咪定的研究多侧重于其临床作用效果,而对于其对肿瘤生长影响及肿瘤患者愈后的国内外研究都非常少。因此本课题拟从细胞水平初步研究右美托咪定对MGC-803胃癌细胞增殖的影响,探讨胃癌患者应用右美托咪定的安全性,为进一步的临床研究及应用奠定基础,现具体报道如下。
1 材料与方法
1.1 材料 实验细胞:MGC-803胃癌细胞株购自中国科学院细胞库。主要试剂和仪器:含酚红高糖DMEM培养基(Hyclone,美国),胎牛血清(四季青,中国),右美托咪定(江苏恒瑞医药股份有限公司,中国),MTT粉末(Sigma,美国),二甲基亚砜(Sigma,美国),倒置相差显微镜(Olympus,日本),酶标仪(Thermo,美国)。
1.2 方法
1.2.1 细胞培养 将MGC-803胃癌细胞用完全培养基(加入10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的含酚红高糖DMEM培养基)培养,置于温度为37 ℃、5% CO2细胞培养箱中,隔天换液1次,注意观察细胞生长情况,并注意观察细胞有无感染(感染的细胞不适合进一步实验),当细胞达80%~90%融合时传代,用0.25%胰蛋白酶消化,并置于倒置相差显微镜下观察,当细胞形态变圆、细胞之间连接松解时,立即加入完全培养基终止消化,然后用吸管轻轻吹打培养瓶瓶底,使细胞从培养瓶瓶底脱落,收集细胞至离心管中,以1500 r/min的速度离心3 min使细胞沉淀于离心管底部,弃掉上清液,将细胞用新鲜的完全培养基重悬,以1∶2的比例传代。
1.2.2 细胞增殖的检测 采用噻唑蓝(MTT)法。MTT全称为3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,其商品名为噻唑蓝。检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为不溶于水的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚砜(DMSO)能溶解细胞中的甲瓒,用酶标仪在490 nm波长处测定其光吸收值,在一定细胞数范围内,吸光度值与细胞数成正比。将对数生长期的MGC-803胃癌细胞消化离心后弃掉旧的培养基,加入新鲜完全培养基,用吸管吹打将其吹散制成细胞悬液,用细胞计数板在倒置相差显微镜下计数细胞个数,调整为3×104/mL的密度接种于96孔板,每孔200 μL(边缘孔用无菌磷酸缓冲盐溶液填充,每孔200 μL,以避免96孔板周围孔的挥发效应)。设置C组(对照组)、右美托咪定组(A1、A2、A3、A4、A5组)和调零组(为只加培养基不加细胞组,在分析实验结果时用实验组的OD值减去调零组的OD值,以去除培养基等对OD值的影响)。置于37 ℃、5%CO2细胞培养箱中继续培养24 h后,用无菌1 mL注射器小心吸除旧的培养基。C组在完全培养基中加入生理盐水,A1、A2、A3、A4、A5组在完全培养基中加入等体积的用生理盐水稀释好的右美托咪定溶液,使右美托咪定终浓度分别为1000、100、10、1、0.1 ng/mL,调零组为无细胞组只加完全培养基,每组设6个复孔,放入细胞培养箱中继续培养。对于72 h时间点组,在48 h时按上述步骤更换培养基,以满足细胞对各营养成分的需求。分别于右美托咪定作用MGC-803胃癌细胞24、48、72 h 3个时间点,各孔加入MTT(5 mg/mL)溶液20 μL(尽量避光操作),继续将细胞置于37 ℃、5% CO2细胞培养箱中继续培养4 h(以使活细胞有充足的时间将MTT还原为甲瓒)。4 h后,用1 mL注射器小心吸除旧的培养液,注意轻柔操作,避免吸到培养孔底部的结晶物,然后加入200 μL二甲基亚砜,随后将细胞培养板放置于摇床上振荡10 min,使结晶物充分溶解,采用酶标仪在492 nm波长下测定各组吸光度值(optical density,OD值)。实验按上述步骤重复3次。细胞增殖率(%)=右美托咪定组OD/对照组OD×100%。
1.3 统计学处理 所得数据采用SPSS 16.0统计学软件进行处理,计量资料采用(±s)表示,比较采用单因素方差分析,组间两两比较采用SNK法,以P<0.05为差异有统计学意义。
2 结果
右美托咪定作用于MGC-803胃癌细胞24、48、72 h,右美托咪定各组OD值及增殖率与对照组比较差异均无统计学意义(P>0.05),见表1。
表1 右美托咪定对MGC-803胃癌细胞增殖的影响(±s)
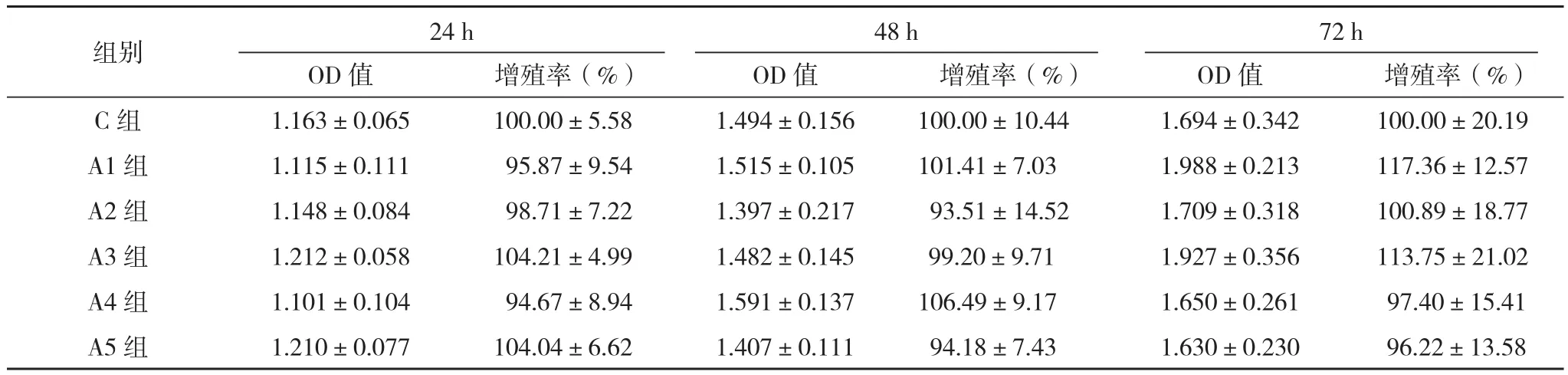
表1 右美托咪定对MGC-803胃癌细胞增殖的影响(±s)
48 h组别24 h 72 h OD值增殖率(%)OD值增殖率(%)OD值增殖率(%)C组1.163±0.065100.00±5.581.494±0.156 100.00±10.441.694±0.342100.00±20.19 A1组1.115±0.111 95.87±9.541.515±0.105101.41±7.031.988±0.213117.36±12.57 A2组1.148±0.084 98.71±7.221.397±0.217 93.51±14.521.709±0.318100.89±18.77 A3组1.212±0.058104.21±4.991.482±0.145 99.20±9.711.927±0.356113.75±21.02 A4组1.101±0.104 94.67±8.941.591±0.137106.49±9.171.650±0.261 97.40±15.41 A5组1.210±0.077104.04±6.621.407±0.111 94.18±7.431.630±0.230 96.22±13.58
3 讨论
右美托咪定是一种高选择性α2受体激动剂,临床应用时间较短,直到2009年才批准用于行全身麻醉的手术患者气管插管和机械通气时的镇静等方面[2]。由于其具有产生类似自然睡眠、易唤醒、呼吸抑制作用弱、提高血流动力学稳定性、减少手术应激反应、减少阿片类和麻醉药物用量等优势,目前常用于减少术后躁动,术前患者、重症患者及其他患者有创操作时的镇静,局部麻醉辅助用药,清醒插管及术后镇痛等方面[3-13]。并且近期有研究表明其有神经保护、心脏保护、减少寒战及降低谵妄发生率的作用[14]。右美托咪定的药理特点显示其分布半衰期约为6 min,清除半衰期约2 h,主要在肝脏进行生物转化由肾脏排出体外。临床观察及研究表明右美托咪定的药代动力学特征在不同的年龄及性别组并未表现出明显的差异。但是随着右美托咪定输注时间的延长,右美托咪定的持续输注半衰期显著延长。由此可见随着用药时间延长,右美托咪定有可能对机体产生较长时间的影响。由于右美托咪定临床应用的诸多优势,临床上应用右美托咪定越来越广泛。而随着人口老龄化,人们对自身健康关注度、重视度的提高及医疗水平的提高,早期发现及早期手术的患者也逐步增多,因此右美托咪定应用于癌症患者的机会也必然日益增多。
由于右美托咪定临床应用时间较短,其应用于癌症患者的安全性的研究目前较少。Bruzzone等[15]通过在小鼠皮下移植鼠MC4-L5乳腺癌细胞,以建立小鼠乳腺癌模型,并分别予以输注右美托咪0.05 mg/(kg·d),可乐定0.1 mg/(kg·d)和等量的生理盐水,与输注生理盐水组对比,发现右美托咪定和可乐定具有促进鼠乳腺癌细胞株MC4-L5增殖的作用。有研究发现右美托咪定通过改变胶原结构促进乳腺癌进展[16]。徐兴国等[17]研究发现全麻期间持续静脉输注右美托咪定可有效抑制胃癌根治术患者围术期的应激反应,减少细胞免疫功能的抑制,有利于胃癌根治术患者的术后康复。该研究认为右美托咪定通过影响机体免疫功能间接影响胃癌患者的术后康复,本研究通过右美托咪定直接作用于胃癌细胞从细胞水平研究右美托咪定对胃癌细胞增殖的影响,以探讨右美托咪定是否会对胃癌细胞生长产生直接的影响。本研究设置1000、100、10、1、0.1 ng/mL 5个不同浓度右美托咪定组作用于MGC-803胃癌细胞,研究右美托咪定与MGC-803胃癌细胞的量效关系,研究结果显示右美托咪定不同浓度组OD值及增殖率与对照组比较差异均无统计学意义(P>0.05)。由此本研究认为不同浓度右美托咪定对MGC-803胃癌细胞的增殖无明显影响。本研究同时还设置了24、48、72 h 3个不同时间点,观察右美托咪定作用不同时间对MGC-803胃癌细胞的增殖是否产生影响,用以研究右美托咪定与MGC-803胃癌细胞的时效关系,研究结果显示右美托咪定组各时间OD值及增殖率与对照组比较,差异均无统计学意义(P>0.05)。因此,本实验研究结果显示,右美托咪定在体外对MGC-803胃癌细胞的增殖未表现出明显影响。Bruzzone等[15-16]的研究结果显示右美托咪定可促进乳腺癌细胞增长,本实验研究结果与其实验结果比较提示,右美托咪定对于不同类型的肿瘤细胞可能会产生不一样的影响,对不同细胞不同组织类型的肿瘤患者的预后可能会产生不一样的影响,其对肿瘤细胞产生影响的机制目前还不是很明确,有可能通过作用不同的受体引发不同的分子机制产生不同的影响。而对于体内作用,右美托咪定的作用可能更加复杂,有可能通过对免疫系统及细胞基质等影响间接对胃癌患者的预后产生影响。因此右美托咪定在不同类型肿瘤细胞及其在体内对肿瘤细胞产生的影响,是下一步研究的方向。
综上所述,本研究结果显示在体外右美托咪定对MGC-803胃癌细胞的增殖无明显影响,表明右美托咪定可能不通过直接作用于MGC-803胃癌细胞对其生长产生影响,但是其作用于人体体内是否通过其他途径影响肿瘤的生长目前还不清楚,因此右美托咪定应用于胃癌患者的安全性还有待于进一步的临床观察和深入研究。
[1]邹文斌.中国胃癌死亡率及发病率研究进展[J].中国实用内科杂志,2014,34(4):408-415.
[2] Khan Z P,Ferguson C N,Jones R M.Alpha-2 and imidazoline receptor agonists:their pharmacology and therapeutic role[J]. Anesthesia,1999,54(2):146-165.
[3] Onodera Y,Yamagishi A,Kunisawa T,et al.Postoperative analgesia of continuous intravenous fentanyl or dexmedetomidine for patients receiving anticoagulant therapy[J].Masui,2011,60(8):936-940.
[4]袁婉秋,施小彤,沈浩林,等.右美托咪定用于经鼻盲探气管插管的效果[J].广东医学,2013,34(4):626-627.
[5] Manne G R,Upadhyay M R,Swadia V.Effects of low dose dexmedetomidine infusion on haemodynamic stress response,sedation and post-operative analgesia requirement in patients undergoing laparoscopic cholecystectomy[J].Indian J Anaesth,2014,58(6):726-731.
[6]吴新民,许幸,王俊科,等.静脉注射右美托咪啶辅助全身麻醉的有效性和安全性[J].中华麻醉学杂志,2007,27(9):773-776.
[7]杨伟,石春来.右美托咪定对神经外科全麻术后躁动发生影响分析[J].中国医学创新,2014,11(12):116-118.
[8]王彬,孙立新,刘红,等.右美托咪定鼻腔给药用于先天性心脏病患儿术前镇静的可行性[J].中华麻醉学杂志,2014,34(7):818-820.
[9] Riker R R,Shehabi Y,Bokesch P M,et al.Dexmedetomidine vs midazolam for sedation of critically ill patients:a randomized trial[J]. JAMA,2009,301(5):489-499.
[10] Cooper L,Candiotti K,Gallagher C,et al.A randomized,controlled trial on dexmedetomidine for providing adequate sedation and hemodynamic control for awake,diagnostic transesophageal echocardiography[J].J Cardiothorac Vasc Anesth,2011,25(2):233-237.
[11]张佳雷,武杰,韩元福.右美托咪啶用于局部麻醉下鼻窦开放术的临床观察[J].中国医学创新,2014,11(1):19-21.
[12] Bergese S D,Khabiri B,Roberts W D,et al.Dexmedetomidine for conscious sedation in difficult awake fiberoptic intubation cases[J]. J Clin Anesth,2007,19(2):141-144.
[13] Babu M M S,Verma A K,Agarwal A,et al.A comparative study in the post-operative spine surgeries:epidural ropivacaine with dexmedetomidine and ropivacaine with clonidine for post-operative analgesia[J].Indian J Anaesth,2013,57(4):371-376.
[14]赵丽佳,岳子勇,公维东,等.右美托咪定的临床麻醉应用进展[J].现代生物医学进展,2015,15(6):1178-1181.
[15] Bruzzone A,Piñero C P,Castillo L F,et al.Alpha2-adrenoceptor action on cell proliferation and mammary tumour growth in mice[J]. Br J Pharmacol,2008,155(4):494-504.
[16] Szpunar M J,Burke K A,Dawes R P,et al.The antidepressant desipramine and α2-adrenergic receptor activation promote breast tumor progression in association with altered collagen structure[J]. Cancer Prev Res(Phila),2013,6(12):1-19.
[17]徐兴国,陈红生,崔松勤,等.右美托咪定对胃癌根治术患者围术期白细胞介素-6、皮质醇及T淋巴细胞亚群的影响[J].临床麻醉学杂志,2012,28(5):480-482.
Effects of Dexmedetomidine on the Proliferation of MGC-803 Gastric Cancer Cell Lines in Vitro
ZENG Lian,YANG Li-yun.//Medical Innovation of China,2015,12(36):001-004
Objective:To investigate the effects of Dexmedetomidine on the proliferation of MGC-803 gastric cancer cell lines in vitro.Method:The gastric cancer cells were randomly divided into six groups,the Dexmedetomidine groups(group A1,A2,A3,A4,A5) and the control group(group C).The final concentration of Dexmedetomidine in the five Dexmedetomidine groups were 1000,100,10,1,0.1 ng/mL respectively.MTT method was used to test the optical density value and the proliferation rate was calculated.Result:There was no statistically significant difference between the Dexmedetomidine groups and the control group in the optical density value and the proliferation rate(P>0.05). Conclusion:Dexmedetomidine has no significant effect on the proliferation of MGC-803 gastric cancer cell lines in vitro.
Dexmedetomidine; MGC-803 gastric cancer cell lines; Proliferation
10.3969/j.issn.1674-4985.2015.36.001
2015-09-21) (本文编辑:王利)
广西壮族自治区卫生厅自筹经费科研课题(Z2013008)
①广西医科大学第一附属医院 广西 南宁 530021
曾涟
First-author’s address:The First Affiliated Hospital of Guangxi Medical University,Nanning 530021,China

