重庆地区辣椒疫霉菌的分离培养及生理小种鉴定
张世才, 熊 艳, 黄任中, 李怡斐, 吕中华, 黄启中
(重庆市农业科学院蔬菜花卉研究所, 重庆 401329)
重庆地区辣椒疫霉菌的分离培养及生理小种鉴定
张世才, 熊 艳, 黄任中, 李怡斐, 吕中华, 黄启中*
(重庆市农业科学院蔬菜花卉研究所, 重庆 401329)
本试验分离鉴定了来源于重庆不同辣椒产区的14个病原菌分离物, 经形态特征鉴定及回接发病特征观察,确定这些菌株均为辣椒疫霉(Phytophthoracapsici)。14个菌株在OMA培养基上诱导产生的孢子囊形态类似,形状多为卵圆形或长椭圆形,乳突明显。对PDA、OMA、CA及V8汁4种培养基上的培养性状观察表明,辣椒疫霉菌株在OMA培养基上生长速度最快,但在V8汁培养基上产孢最多。采用灌根法对14个菌株进行生理小种鉴别,其中10个为race 3,2个为race 2,2个为race 1,初步推定race 3为重庆地区辣椒疫病病原菌的优势小种。
重庆; 辣椒疫霉; 培养性状; 生理小种
由辣椒疫霉菌(Phytophthoracapsici)侵染引起的辣椒疫病是辣椒生产上的重要病害[1]。迄今,在我国广东、陕西和四川等多个地区辣椒种植区均有辣椒疫病大面积发生的报道,重庆作为我国辣椒主产区之一,近年来随着种植规模的不断扩大以及常年连作种植,该病害逐年加重,严重制约着辣椒生产。研究表明,不同辣椒疫霉菌菌株不但致病力存在显著差异,还存在生理小种分化的情况,且不同地区优势生理小种也可能存在差异[2-4]。为了明确重庆地区辣椒疫霉菌生理小种构成及其分布,本研究对采自11个辣椒产区的14个分离物在不同培养基上的培养性状进行观察,并通过接种鉴别寄主明确了这14个分离物的生理小种类型,以期对辣椒疫病的防治及抗病品种的分布与选育提供可靠的理论依据。
1 材料与方法
1.1 材料
辣椒病样于2011-2013年采自重庆潼南、铜梁、永川、江津、合川、北碚、巴南、石柱等辣椒主产区。经分离、纯化获得14株辣椒疫霉菌菌株,菌株来源及编号见表1。

表1 病原菌的采集地点、辣椒品种及采样组织
1.2 病原菌分离与保存
疫霉菌分离参照郑小波[5]的方法,从重庆辣椒主产区发病田块采集具有辣椒疫病典型症状的病茎或病果,用自来水将组织表面冲洗干净,然后切取病健交界处组织2~3小块,置于选择性燕麦培养基(OMA)平板上(含青霉素50 mg /L、五氯硝基苯50 mg/L、利福平100 mg/L),25~28 ℃培养2 d后,挑取菌落边缘菌丝少许,转接到不含药剂的OMA培养基上,在25~28 ℃培养3 d,之后从菌落边缘挑取菌丝少许,在OMA培养基上培养,进行菌株纯化。从纯化的菌株菌落边缘切取病原物菌块,回接到辣椒植株茎部,28 ℃下棉花保湿培养,选取表现与田间症状相同的分离物进行菌株鉴定。纯化后的菌株转接入V8汁培养基试管斜面,于28 ℃下培养5~7 d,待菌丝长满斜面,于16 ℃环境中保存。
1.3 病原菌鉴定
将纯化的菌株接种到OMA培养基上,于28 ℃培养3 d后,切取菌落边缘菌丝块移至OMA平板中央,在28 ℃黑暗恒温下培养7 d后,观察病原菌的菌落形态、菌丝以及孢子囊的形态特征。
1.4 不同培养基上培养性状观察
选择疫霉菌分离培养常用的马铃薯葡萄糖琼脂培养基(PDA)、胡萝卜培养基(CA)、V8汁培养基及燕麦培养基(OMA)4种,测定不同培养基对菌株菌落生长速度及产孢的影响。选取TNB为供试菌株,TNB在上述4种培养基上生长3 d后,用打孔器(内径4 mm)沿菌落边缘打取菌丝块,移至4种培养基平板中央,每皿1块,分别转接3皿,重复3次。培养皿直径为9 cm,每皿倒14 mL培养基。接种后将培养皿置于28 ℃黑暗培养。5 d后观察供试菌株在不同培养基上的菌落形态、菌丝密度,并测量菌落直径。供试菌株继续黑暗培养14 d后,显微镜观察孢子囊数量。
1.5 生理小种的测定
1.5.1 鉴别寄主
鉴别寄主由世界蔬菜研究中心提供,分别为‘Early calwonder’、‘PBC137’、‘PBC602’和‘PI201234’。其中‘Early calwonder’不带抗病基因,其他3个分别含有不同的抗病基因(表2),其组合可用于鉴别辣椒疫霉生理小种race 1、race 2及race 3。
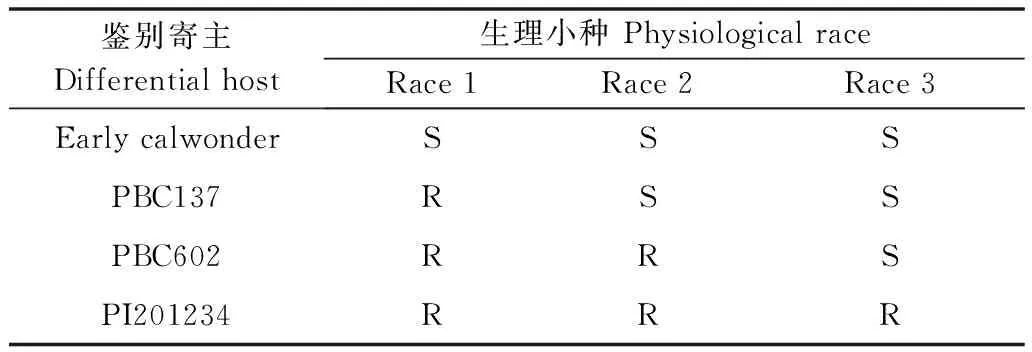
表2 辣椒疫霉生理小种的判定1)
1) S为感病;R为抗病。
S means susceptible; R means resistant.
1.5.2 病原菌的培养
病原菌的培养方法参照文献[6],略有改动。将分离保存的14个待测菌株分别在V8汁培养基上于28 ℃下培养7 d,再将其置于荧光灯下照射48 h以诱发其产生孢子囊。待产生大量孢子囊后加入适量无菌水,用刀片刮动平板培养基表面收集菌丝和孢子囊。收集的病原菌培养物用两层纱布过滤后将孢子悬浮液置于4 ℃下30 min,然后置于室温下3 h以促进游动孢子的形成和释放。
1.5.3 鉴别寄主的培育
鉴别寄主的种子首先用10%的次氯酸钠溶液浸泡5~10 min,然后用清水冲洗干净,置于28 ℃恒温培养箱中催芽。待种子发芽后播于装有育苗基质的60孔育苗穴盘内。育苗基质成分为草炭和蛭石(2∶1)。基质经高温蒸汽灭菌(121 ℃,30 min)。待出苗后,幼苗置于25 ℃日光温室内培养,常规肥水管理。
1.5.4 接种
当鉴别寄主幼苗长至6~7叶时进行孢子悬浮液灌根接种,每个待测菌株分别接种1套鉴别寄主,3次重复,每个鉴别寄主接种30株,接种游动孢子浓度1×103个/mL。接种前浇透水,用移液器吸取3 mL孢子悬浮液注入鉴别寄主根部附近基质,接种后将植株置于25 ℃温室内,每天光照10~12 h,接种后适时浇水,使基质湿度保持近饱和状态。
1.5.5 病害调查及小种鉴定
接种7 d后调查幼苗茎基部发病情况,确定待测菌株的生理小种类型。鉴别寄主的感抗类型:发病率>20%为感病型,发病率≤20%为抗病型[4]。
2 结果与分析
2.1 田间病害调查
对重庆地区辣椒疫病的田间调查结果表明,辣椒疫病在各区县均有发生,且在不同地区,不同品种上病情存在差异。病害发生期主要为5-7月,适宜温度25~30 ℃,植株受侵染后,病部呈水渍状,后迅速变褐,病部明显缢缩,造成地上部折倒。果实染病始于蒂部,初生暗绿色水渍状斑,随后变褐软腐,湿度较大时表面长出白色霉层,即为病原菌孢囊梗及孢子囊(图1)。

图1 辣椒疫霉侵染植株的典型症状Fig.1 The typical symptoms of pepper infected by P.capsici
2.2 辣椒疫霉形态特征
以田间采集的辣椒样品为材料,共分离纯化得到14个菌株,这14个菌株在OMA上生长速度较快,气生菌丝中等、菌丝无隔膜,孢囊梗分枝不规则,
成熟的孢子囊具长柄,易脱落。孢子囊形状以椭圆形和长椭圆形为主,乳突明显,孢子囊在水中能释放出游动孢子,游动孢子肾形,带有鞭毛(图2),初步确定其均为辣椒疫霉。

图2 辣椒疫霉孢子囊的产生及游动孢子的释放Fig.2 Sporangia and zoospores of P.capsici
2.3 辣椒疫霉在不同培养基上的培养性状
本试验所分离的菌株TNB在4种培养基上的培养特性(表3、图3)明显不同。在OMA平板上的菌落呈绒毛状,气生菌丝很多,菌丝较疏松、色白、生长很快;在CA和PDA上的菌落为棉絮状,气生菌丝较多,菌丝浓密、较厚、生长较慢;而在V8汁平板上呈放射状生长,菌落扁平、菌丝较薄,色较浅,菌丝生长速度较快。产孢方面则表现为在V8汁培养基上孢子囊数量最多,OMA次之。可见,菌株的菌落形态、生长速度及菌丝疏密程度与孢子囊数量之间没有明显的相关性。

表3 辣椒疫霉在不同培养基上的培养性状1)
1) “+”表示孢子囊数量较少;“++”表示孢子囊数量中等;“+++”表示孢子囊数量较多;“++++”表示孢子囊数量很多。数据后不同小写字母表示生长速率间在0.05水平差异显著。
“+”means a small number of sporangium; “++” means a moderate number of sporangium; “+++” means a larger number of sporangium; “++++” means the largest number of sporangium. Data with different small letters are significantly different at 0.05 level.

图3 辣椒疫霉在不同培养基上的培养性状Fig.3 The culture characters of P.capsici isolates on different media
2.4 辣椒疫霉生理小种鉴定
按照世界蔬菜研究中心提供的鉴别寄主,采用李智军[4]的方法对重庆地区14个辣椒疫霉菌菌株进行了生理小种鉴定,结果表明,BB和SZ菌株属于race 1,TNZ、TNB菌株属于race 2,而DX、YD、YC、JJ、RC、HC、TL、TNY、TNG及HT菌株属于race 3(表4)。race 3所占比例最大,为71%。

表4 不同地区的辣椒疫霉菌生理小种确定1)
1) 括号内数据为接种后第7天的发病率(%)。S:感病;R:抗病。
Data in the parenthesis are disease incidence (%) at 7th day after inoculation. S means susceptible;R means resistant.
3 讨论
本研究对来源于重庆11个辣椒产区的14个辣椒疫霉分离物进行了鉴定,经菌丝及孢子囊形态特征观察,参照郑小波等[5]对辣椒疫霉菌的描述,确定这14个菌株均为辣椒疫霉(Phytophthoracapsici)。
关于辣椒疫霉菌在不同培养基上的菌落形态、孢子囊的产生等生物学性状前人已有报道,徐作珽等[7]发现辣椒疫霉在玉米面和燕麦片培养基上生长最佳;戚仁德等[8]认为辣椒疫霉菌株在不同培养基上的培养性状存在差异,HX-1菌株在OMA培养基上生长最快,产生孢子囊数量最多,比较适合生长。本研究结果表明辣椒疫霉菌同一菌株在不同培养基上的培养性状存在明显差异,具体表现为TNB菌株在OMA培养基上生长最快,但在V8汁培养基上产孢最多,菌株的菌落形态、生长速度与孢子囊数量无关。另外还发现采自不同地区的辣椒疫霉菌株在同一培养基上的培养性状也有所不同,这与前人的研究结果相吻合。
本研究利用一套鉴别寄主,采用灌根法对重庆地区14株辣椒疫霉菌进行了生理小种鉴定,发现有10株属于race 3,2株属于race 1,2株属于race 2,由此推测race 3为重庆地区的优势小种。李智军等[4]的研究结果表明,race 3为广东地区优势生理小种,罗德旭等[9]研究表明,安徽淮安地区分离得到的3份辣椒疫霉菌均属于race 1,而马辉刚等[10]研究发现危害江西辣椒的疫霉病原菌生理小种以race 2占优势,由此可见辣椒疫霉生理小种在我国的分布存在差异,对辣椒疫霉优势生理小种在全国的具体分布情况,还需扩大采样范围进一步确认。此外,不同的地区其主栽品种存在差异,因此在选育适合重庆地区的辣椒抗疫病品种时,应采用race 3进行抗病性鉴定和抗源筛选,才能获得有效的抗病性材料或品种。
[1] 杨学辉,肖崇刚,袁洁.贵州辣椒疫病病原鉴定及生物学特性研究[J].西南农业大学学报(自然科学版),2004,26(4):413-416.
[2] 李萍,江涛,高智谋,等.辣椒疫霉(Phytophthoracapsici)对辣椒的致病力分化研究[J].植物病理学报,2012,42(4):431-435.
[3] 罗德旭.辣椒疫霉菌生理小种及其抗性研究[D].杨凌:西北农林科技大学,2008.
[4] 李智军,龙卫平,郑锦荣,等.广东辣椒疫霉菌分离鉴定及其致病力和生理小种分化研究[J].华南农业大学学报,2007,28(1):50-54.
[5] 郑小波.疫霉菌及其研究技术[M].北京:中国农业出版社,1997:10-132.
[6] NY/T 2060.1-2011.中华人民共和国农业行业标准.辣椒抗病性鉴定技术规程 第1部分:辣椒抗疫病鉴定技术规程[S].北京:中国农业出版社,2011.
[7] 徐作珽,李林,魏道君,等.大棚辣椒疫病菌的分离培养及药剂防治[J].植物保护,1999,25(2):29-31.
[8] 戚仁德,丁建成,顾江涛,等.不同培养基对辣椒疫霉致病力的影响[J].安徽农业科学,2001,29(1):96-97.
[9] 罗德旭,孙玉东,杨红,等.淮安地区辣椒疫霉菌生理小种鉴定[J].江西农业学报,2013,25(1):85-86.
[10]马辉刚,何烈干,张海良,等.江西省辣椒疫霉生理小种构成及其对烯酰吗啉的敏感性分析[J].植物保护学报,2013,40(4):374-378.
(责任编辑:杨明丽)
Isolation and cultivation ofPhytophthoracapsiciand identification of physiological race in Chongqing
Zhang Shicai, Xiong Yan, Huang Renzhong, Li Yifei, Lü Zhonghua, Huang Qizhong
(Vegetable and Flower Research Institute of Chongqing Academy of Agricultural Sciences,Chongqing 401329, China)
Fourteen isolates collected from different pepper-cultivating regions in Chongqing were determined. Based on their morphological characteristics and symptoms after re-inoculated to pepper, these Isolates were identified asPhytophthoracapsiciLeonian. The sporangia of the fourteen isolates induced on OMA medium were morphologically similar, and most of them were ovate or elliptic, with obvious papillate. There were evident differences in mycelial growth rate, productivity of sporangia on different medium. On the OMA medium, the mycelia grew fastest, while the largest number sporangium are produced on the V8 medium. Physiological race identification test showed that ten isolate belonged to race 3, two isolates belonged to race 1, and two isolate belonged to race 2. Race 3 is probably the dominant race in Chongqing.
Chongqing;Phytophthoracapsici; culture characters; physiological race
2014-03-19
2014-08-06
重庆市科技攻关重点项目(cstc2012ggC80005);重庆市科技攻关计划项目(cstc2011ggBo104);重庆市农业科技成果转化资金项目(cstc2014jcsf-nycgzhA80026)
S 436.418.1
A
10.3969/j.issn.0529-1542.2015.03.036
* 通信作者 E-mail: 598261580@qq.com

