斜纹夜蛾酚氧化酶酶学特性研究
徐广增, 李 伟, 王新红, 刘守柱, 王桂清
(聊城大学农学院, 聊城 252059)
斜纹夜蛾酚氧化酶酶学特性研究
徐广增, 李 伟, 王新红, 刘守柱*, 王桂清
(聊城大学农学院, 聊城 252059)
以邻苯二酚为底物,研究了斜纹夜蛾幼虫酚氧化酶的酶学特性。结果表明:斜纹夜蛾幼虫酚氧化酶的最适pH在6.7~7.0之间,pH 6.8时,稳定性最好;最适温度为30 ℃,20~35 ℃之间,稳定性较好;在3 mL的测活体系中,当酶量为0.1 mL时,酶促反应速度随底物浓度升高而增大,当底物浓度为10 mmol/L时,酶促反应最快,超过10 mmol/L时,酶促反应趋于平衡;以邻苯二酚为底物时,斜纹夜蛾酚氧化酶的Km值为7.980 mmol/L,Vm为204.082ΔA/mg·10 s。
斜纹夜蛾; 酚氧化酶; 酶学特性; 稳定性; 酶活性
酚氧化酶(phenoloxidase,PO)广泛存在于动物、植物、微生物等有机体内,又称为酪氨酸羟化酶(tyrosine hydroxylase)或酪氨酸酶(tyrosinase),是生物体内黑色素合成的关键酶[1]。酚氧化酶在昆虫体内一般以无活性的酚氧化酶原(prophenoloxidase,proPO,PPO)的形式存在,PPO及其激活因子便构成了一个复杂的酶级联反应系统,即酚氧化酶原激活系统(prophenoloxidase-activated system,proPO-AS)。该系统由PO、酶蛋白、模式识别蛋白和蛋白酶的抑制剂构成[2]。对于昆虫的生化研究表明,PO主要存在于昆虫的血细胞、血浆中,在中肠、表皮等组织中也有分布。通过对东亚飞蝗[Locustamigratoriamanilensis(Meyen)][3]、棉铃虫[Helicoverpaarmigera(Hübner)][4]、亚洲玉米螟[Ostriniafurnacalis(Guenée)][5]等昆虫研究发现PO既存在于血细胞中,也存在于血浆中;在美洲大蠊[Periplanetaamericana(Linnaeus)]中,PO主要存在于血细胞中[6],但在家蚕(BombyxmoriLinnaeus)[7]和麻蝇(Sarcophagabullata)[8]中,PO多存在于血浆中,另外,Asano和Ashida还证实在家蚕(B.mori)表皮中存在两种PO形式(F型和S型),由血细胞中释放出来,经修饰转运至整个表皮,但转运的机理尚未清楚[9]。Binnington和Barrett以多巴胺为底物,利用超微结构细胞技术在铜绿蝇[Luciliacuprina(Wiedemann)]角质的原表皮和上表皮中也发现了PO,且只有在人为角质损伤的激活过程中才能检测到原表皮中PO的活性[10]。虽然PO在不同昆虫体内分布的主要组织有所差异,但均对昆虫的生长有重要的作用,主要参与昆虫生长过程中黑色素的合成、体壁的鞣化和硬化、伤口的愈合、体液免疫等。正是由于PO在昆虫的免疫、防御系统中起着重要的作用,因而可以作为害虫控制的一个重要的作用靶标[1]。鉴于PO重要的生理功能和潜在的应用价值,已有很多学者研究了多种昆虫PO的生物学特性和理化性质,如:刘春英等以邻苯二酚为底物,研究了枣尺蠖酚氧化酶的酶学特性,测得其在pH 7.0、 37 ℃时活性最高,且酶的热稳定性较差[11];薛超彬等比较了菜青虫不同虫态及虫龄的酚氧化酶性质,其中5龄幼虫的酶活力最高,蛹的酶活力最低,且不同虫态及虫龄的PO催化底物氧化的最适pH基本相同,但最适温度相差较大[12];高兴祥等测得甜菜夜蛾酚氧化酶反应的最佳条件是:pH 6.5,最适温度40 ℃,米氏常数Km=10.73 mmol/L[13]。
斜纹夜蛾[Spodopteralitura(Fabricius)]属鳞翅目夜蛾科,是世界性分布的大害虫,除南极洲外,其余六大洲都有其分布;国内广泛分布于各个农区。斜纹夜蛾为杂食性害虫,对粮食作物、经济作物、果树、蔬菜、花卉、牧草、草坪草及林木等都能危害,大发生时给农、林、牧业生产和环境绿化造成巨大的经济损失。其寄主范围十分广泛:秦厚国等报道,该虫的寄主涉及双子叶植物、单子叶植物、蕨类植物和裸子植物共计109科389种(变种)[14]。鉴于斜纹夜蛾危害的严重性且对普通化学农药产生了较强的抗性[15],研发作用机制新颖、对环境友好的新型化合物十分必要,而酚氧化酶即是非常有希望的作用靶标之一。本文以斜纹夜蛾为材料,研究其体内PO的酶活特性,包括最适温度、pH和米氏常数等,旨在为寻找和开发以PO为靶标的新型害虫控制剂提供理论基础。
1 材料和方法
1.1 斜纹夜蛾饲养
斜纹夜蛾虫源由华南农业大学提供,在人工气候养虫室内参照涂业苟等[16]方法使用人工饲料继代饲养:室内温度(25±1)℃,相对湿度60%±5%,光周期L∥D=14 h∥10 h。收集2~3日龄的5龄幼虫供试验用。
1.2 试剂及仪器
本试验所用的试剂均为国产分析纯试剂,紫外分光光度计为UV-1700;冷冻离心机为D-37520,美国赛默飞世尔科技公司产品。
1.3 酶液的制备
取斜纹夜蛾5龄幼虫,按1 g∶5 mL的比例加入预冷处理的0.2 mol/L磷酸缓冲液,冰浴匀浆,在4 ℃冰箱中静置30 min后,4 ℃,8 000 r/min离心30 min,取上清液即为粗酶液。在制备的粗酶液中加入固体硫酸铵,边加边搅拌,使其饱和度达到30%,冰浴静置30 min后,4 ℃,8 000 r/min离心30 min,收集盐析后的沉淀物,将沉淀物用0.2 mol/L磷酸缓冲液溶解,得到待测酶液。
为测定提取过程中匀浆缓冲液pH对酶活力的影响,配制pH 6.1、6.5、6.8、7.0的磷酸缓冲液,分别按上述步骤提取酶液,并进行酶活力测定。
1.4 酚氧化酶酶学特征测定
1.4.1 酚氧化酶活力的测定
采用紫外分光光度计法[17]进行测定。在3 mL测活体系中含有:0.2 mol/L磷酸缓冲液(pH 7.0),终浓度0.01 mol/L邻苯二酚溶液,0.1 mL酶制剂。然后在420 nm波长处测定2 min内光密度随时间的增长曲线,每隔10 s记录1次,从直线的斜率求得酶活力。酶活力单位U定义为每mg蛋白每10 s催化底物氧化光密度增加0.001为1个活力单位。每组试验均重复3次。
1.4.2 蛋白质含量的测定
蛋白质含量的测定采用G-250考马斯亮蓝法[18]进行。
1.4.3 不同pH反应体系对酚氧化酶活力及稳定性的影响
分别以pH 6.1、6.5、6.8和7.0的匀浆缓冲液提取的斜纹夜蛾酚氧化酶作为酶源,测定PO在不同pH环境中的活性。测活体系pH设置为4.6、5.0、5.4、5.8、6.1、6.4、6.5、6.7、6.8、7.0、7.3、7.6、7.9,其中pH 4.6、5.0、5.4采用柠檬酸缓冲液(以0.1 mol/L柠檬酸 + 0.02 mol/L Na2HPO4制备),其他pH采用磷酸缓冲液(以0.2 mol/L NaH2PO4+0.2 mol/L Na2HPO4制备),以终浓度为10 mmol/L邻苯二酚为底物,测定斜纹夜蛾酚氧化酶的最适pH。
分别吸取0.3 mL酶液(pH 7.0缓冲液提取),分别加入4.2 mL pH为5.8、6.1、6.4、6.5、6.7、6.8、7.0、7.3、7.6、7.9的缓冲液中,冰浴30、60、90 min后取出1.5 mL,加入1.5 mL终浓度10 mmol/L的邻苯二酚,测定PO的残留活性。以未曾与缓冲液冰浴、包含对应pH的测活体系的酶活力作为对照,其活力定义为100%,各pH处理的残留活性与对照比较,求得相对活性,根据活性降低的程度确定PO在不同pH缓冲液中的稳定性。
1.4.4 温度对酚氧化酶活力及稳定性的影响
将不含酶液的测活体系分别置于20、25、30、35、40、45、50、55、60 ℃水浴中保温10 min,然后加入0.1 mL酶液,立即测定酶活力,根据活力的大小确定最适温度。
再将0.3 mL酶液分别放置在上述不同温度的水浴中保温90 min,每隔30 min取出一次酶液(0.1 mL),以终浓度10 mmol/L邻苯二酚为底物,测定PO的残留活性。以最适温度下测定的PO活力作为对照,其活力定义为100%,各温度处理后的残留活性与对照比较,求得相对活性,根据活性降低程度确定PO对温度的稳定性。
1.4.5 底物浓度对酚氧化酶酶促反应速率的影响
将1.4 mL、pH 7.0的磷酸缓冲液和0.1 mL酶液加入终浓度分别为1.0、1.25、2.5、5、10、15、20、25、30 mmol/L的邻苯二酚中,测定不同底物浓度下的酶促反应速率,以酶促反应速率对底物浓度作图,得酶促反应速率与底物浓度的关系。
1.4.6 动力学特征参数的测定
以邻苯二酚为底物,在温度30 ℃,pH 7.0、0.2 mol/L磷酸缓冲液测活体系中,设定底物终浓度分别为0.8、1.2、1.6、2.4、3.2 mmol/L,加入0.1 mL酶液,测定酶促反应的初速度(Vo),采用Lineweaver-Burk双倒数作图法作图,求出该酶催化底物氧化的米氏常数(Km)和最大速度(Vm)。
1.5 数据处理与分析
试验数据采用SPSS软件进行单因素方差分析,计算标准误(standard error,SE)后,在图中以平均值±SE来表示试验数据,显著水平0.05。
2 结果与分析
2.1 不同pH反应体系对酶活力及稳定性的影响
以邻苯二酚为底物,分别测定了用pH 6.1、6.5、6.8和7.0的磷酸缓冲液提取的斜纹夜蛾酚氧化酶的活性。结果表明:不同pH缓冲液提取对酶的活力有明显的影响(图1),pH 6.1缓冲液提取的酶活力最低,pH 7.0提取的酶活力最高,pH 6.5和6.8缓冲液提取的酶活力相近,因而在提取PO时宜采用pH 7.0的磷酸缓冲液。试验表明,4种缓冲液提取的酶具有相同的酶活变化趋势(图1):pH在4.6~6.7之间,酚氧化酶活性随pH升高而增加;pH大于7时,酶活性随pH升高下降,且下降的速率明显高于上升的速率;不同pH的磷酸缓冲液提取的斜纹夜蛾酚氧化酶的最适pH均在6.7~7.0之间,其中以pH 7.0缓冲液提取的酶的活性最高。
以pH 7.0提取的斜纹夜蛾酚氧化酶进行稳定性试验,结果表明:在pH 6.8时,酶活力降低的幅度最小,稳定性最好;同一pH处理下,随处理时间的延长,酶的活性逐渐降低(图2)。

图1 pH对不同酸碱度缓冲液提取的斜纹夜蛾幼虫酚氧化酶活力的影响Fig.1 Effects of pH on the activity of phenoloxidase extracted with different pH buffers from Spodoptera litura larvae
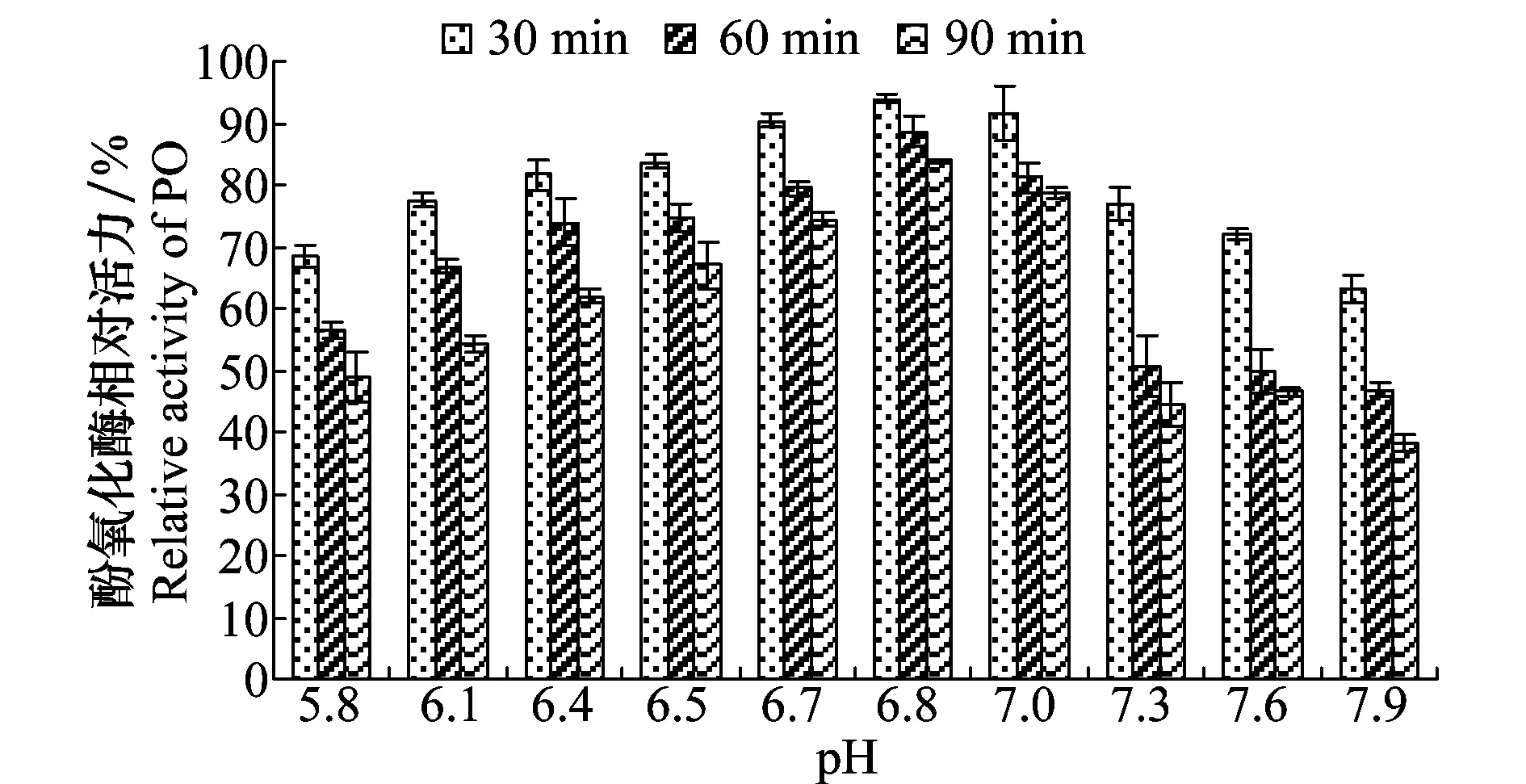
图2 pH对斜纹夜蛾幼虫酚氧化酶稳定性的影响Fig.2 Effects of pH on the stability of phenoloxidase from Spodoptera litura larvae
2.2 温度对酚氧化酶活力及稳定性的影响
由图3可以看出,斜纹夜蛾幼虫酚氧化酶活性受温度影响比较大。以邻苯二酚为底物,在20~30 ℃之间,酚氧化酶活性随温度的升高而增加;在30~60 ℃之间,酶活性随温度的升高而降低;斜纹夜蛾幼虫酚氧化酶的最适温度为30 ℃。稳定性试验表明:在20~35 ℃之间,酚氧化酶的稳定性较好,30 ℃时酶的活性保持在最高;当温度大于50 ℃时酶的活性迅速降低:如在55 ℃时保温30 min,酶活力仅为原活力的27.7%,保温60 min,酶活力仅为原活力的13.4%;同一温度处理下,随处理时间的延长,酶的活性有逐渐降低的趋势(图4)。
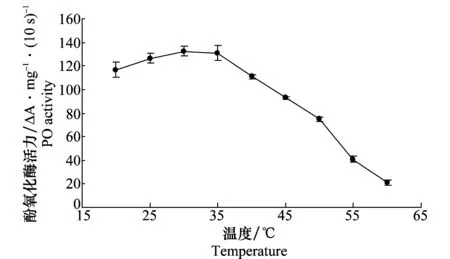
图3 温度对斜纹夜蛾幼虫酚氧化酶活力的影响Fig.3 Effects of temperature on the activity of phenoloxidase from Spodoptera litura larvae

图4 温度对斜纹夜蛾幼虫酚氧化酶稳定性的影响Fig.4 Effects of temperature on the stability of phenoloxidase from Spodoptera litura larvae
2.3 底物浓度对酚氧化酶酶促反应速率的影响
在3 mL的测活体系中,当酶含量为0.1 mL时,改变底物邻苯二酚的浓度,可以获得不同的酶促反应速率。结果表明:当底物浓度在0~10 mmol/L之间时,酶促反应随底物浓度的增加而加快,且增加幅度基本成正比关系;当底物浓度大于10 mmol/L时,随底物浓度的增加,酶促反应速率不再增加,而趋于稳定的状态;当底物浓度为10 mmol/L时,酶促反应最快(图5)。
2.4 动力学特征参数的测定
在3 mL的测活体系中,当酶含量为0.1 mL,温度30 ℃,pH 7.0时,以邻苯二酚为底物,测定斜纹夜蛾酚氧化酶的动力学特征参数,可知其米氏常数Km为7.980 mmol/L,最大反应速度Vm为204.082ΔA/mg·10 s (图6)。

图5 邻苯二酚对斜纹夜蛾幼虫酚氧化酶活力的影响Fig.5 Effects of catechol concentration on the activity of phenoloxidase from Spodoptera litura larvae

图6 斜纹夜蛾酚氧化酶双倒数曲线Fig.6 Lineweaver-Burk plot for the determination of Kmof phenoloxidase from Spodoptera litura larvae
3 讨论
本试验以邻苯二酚为底物,研究了斜纹夜蛾幼虫酚氧化酶的酶学特性。结果表明,斜纹夜蛾幼虫酚氧化酶的最适pH为6.7~7.0,在pH 6.8时,稳定性最好,此研究结果与焦艳艳等报道的斜纹夜蛾酚氧化酶最适pH 6.5[19],舞毒蛾酚氧化酶最适pH 6.5[20],桑尺蠖最适pH 7.0[21]有一定差异。由于昆虫种类的不同,饲养方式的不同,昆虫取食食物的不同,使得体内的酚氧化酶的性质存在一定差异。酚氧化酶是一种含铜酶,活性中心具有双核铜中心结构,两个铜离子之间通过氧原子结合,形成相应的电子通路,活性中心含有许多酸性或碱性的氨基酸侧链基团,pH的改变能影响酶活性中心上必须基团的解离程度,直接影响到酶和底物的亲和力,进而影响酶的活性[22]。
斜纹夜蛾酚氧化酶的最适温度为30 ℃,在20~35 ℃之间,酚氧化酶的稳定性较好,当温度大于50 ℃时酶的活性迅速降低,如在55 ℃时保温30 min,酶活力仅为原活力的27.7%,保温60 min,酶活力仅为原活力的13.4%,保温90 min后酶基本失活,说明斜纹夜蛾酚氧化酶的热稳定性比较差。酶本身也是一种蛋白质,较高的温度会对酶蛋白的三维结构的完整性和稳定性造成一定的破坏,甚至使其变性失活,进而引起酶活性的迅速降低。不同来源的酚氧化酶之间也存在一定的差异。
以邻苯二酚为底物,测得的不同底物浓度与酶促反应的关系,当底物浓度在0~10 mmol/L之间时,酶促反应增加与底物浓度的增加量成正相关,超过10 mmol/L时,随底物浓度的继续增加,酶促反应不再增加而趋于平衡。在反应过程中,酶的量为定值,起始时底物浓度较低,酶促反应速度与底物浓度成正比,而当底物浓度到达一定程度,使得所有的酶分子和底物分子结合生成中间产物,酶促反应达到最大值,即使再增加底物的浓度,由于没有足够的酶再去结合底物,酶促反应的速度也就不会再增加。
以邻苯二酚为底物,测得斜纹夜蛾幼虫酚氧化酶的米氏常数Km为8.5 mmol/L,Km值反映了相关酶与底物的亲和能力。张永亮等报道:桑尺蠖酚氧化酶与L-多巴、邻苯二酚和焦性没食子酸作用的Km值分别为4.30、6.82和9.64 mmol/L,表明该酶对3种底物的亲和能力存在差异,其中,对L-多巴的亲和能力最强,其次为邻苯二酚,而对焦性没食子酸的亲和力最低[21];赵燕等也曾报道,舞毒蛾酚氧化酶与L-多巴、邻苯二酚和焦性没食子酸作用的Km值分别为3.19、10.74和19.26 mmol/L[20],说明其对三种底物的亲和能力强弱趋势与桑尺蠖相似。但不同昆虫的酚氧化酶与同一底物的亲和能力存在差异,即使在同一种昆虫中,不同部位的酚氧化酶与同一底物的亲和能力也存在差异,刘守柱等测得黄粉虫血淋巴源和体壁源酚氧化酶与L-多巴作用的Km值分别为1.176和0.881 mmol/L,表明黄粉虫体壁源酚氧化酶与L-多巴的亲和力大于血淋巴源酚氧化酶的亲和力[23];Aso等也报道过烟草天蛾体壁和血淋巴中的酚氧化酶对同一底物具有不同的Km值[24]。我们认为酚氧化酶与底物表现的不同亲和能力与许多因素有关:一方面,来源不同的酚氧化酶的活性中心上连接的氨基酸侧链基团可能存在一定的差异,在酶蛋白形成过程中螺旋化、折叠化的程度也不完全相同、造成酶蛋白结构存在一定的差异;另一方面,不同来源的酚氧化酶发挥其催化功能所需的条件不同,都具有各自的最适环境,这也是不同昆虫能够适应不同环境的一个因素。
酚氧化酶在昆虫体内是一种重要的免疫因子,在防御反应中具有重要的作用,同时能促进伤口的愈合,参与表皮的鞣化、硬化和黑化,对昆虫正常的生长发育具有不可替代的重要作用,因而研究不同昆虫酚氧化酶的酶学特性,深入了解其生理功能,对于筛选和开发以酚氧化酶为靶标的新型害虫控制剂,探索新的无公害害虫治理方法具有重要的科学意义。在此研究基础之上,我们将进一步进行植物源抑制剂的筛选和抑制机理研究。
[1] 罗万春,薛超彬. 昆虫酚氧化酶及其抑制剂[M].北京:科学出版社,2010:1-19.
[2] 李国荣,张士璀,李红岩,等.酚氧化酶研究概况Ⅰ:特性、功能、分布和在胚胎发育中的变化[J].海洋科学,2003,27(4):4-8.
[3] Brehelin M,Drif L,Buad L,et al. Insect haemolymph:cooperation between humoral and cellular factors inLocustamigratoria[J].Insect Biochemistry,1989,19:301-307.
[4] 尹丽红,王琛柱,钦俊德. 棉铃虫血淋巴酚氧化酶活性的微量测定[J].昆虫知识,2001,38(2):119-122.
[5] 程振衡,梁子才. 亚洲玉米螟血淋巴中酚氧化酶的研究[J].昆虫学报,1990,33(4):424-428.
[6] Vargas-Albores F,Jiménez-Vega F,Yepiz-Plascencia G M.Purification and comparison of beta-1,3-glucan binding protein from shrimp(Penaeusvannamei)[J].Comparative Biochemistry and Physiology,1997,116(4):453-458.
[7] Leonard C,Ratcliffe N A,Rowley A F.The role of prophenoloxidase activation in non-self recognition and phagocytosis by insect blood cells[J].Insect Physiology,1985,31(10):789-799.
[8] Saul S J,Sugumaran M.Prophenoloxidase activation in the hemolymph ofSarcophagabullatalarvae [J].Archives of Insect Biochemistry and Physiology,1988,7(2):91-103.
[9] Asano T,Ashida M.Cuticular pro-phenoloxidase of the silkworm,Bombyxmori. Purification and demonstration of its transport from hemolymph [J].The Journal of Biological Chemistry,2001,276(14):11100-11112.
[10]Binnington K C,Barrett F M.Ultrastructural localization of phenoloxidases in cuticle and haemopoietic tissue of the blowflyLuciliacuprina[J].Tissue and Cell,1988,20:405-419.
[11]刘春英,李方正. 枣尺蠖多酚氧化酶的提取及酶学特性[J].中国农学通报,2012,28(33):214-217.
[12]薛超彬,陈清西,王勤,等. 菜青虫不同虫态及虫龄的多酚氧化酶性质比较[J].昆虫学报,2004,47(3):305-309.
[13]高兴祥,罗万春,谢桂英,等.甜菜夜蛾多酚氧化酶的特性及其对曲酸等抑制剂的反应[J].中国农业科学,2004,37(5):687-691.[14]秦厚国,汪笃栋,丁健,等.斜纹夜蛾寄主植物名录[J].江西农业学报,2006,5(18):51-58.
[15]周晓梅,黄炳球.斜纹夜蛾抗药性及其防治对策的研究进展[J].昆虫知识,2000,39(2):98-102.
[16]涂业苟,曾吉华.斜纹夜蛾的人工饲养技术[J].江西农业科学,2010,22(1):87-88.
[17]肖婷,刘守柱,薛超彬,等. 紫外分光光度计法与酶标仪微量法测定酚氧化酶蛋白含量及活力的比较[J].昆虫知识,2007,45(2):306-309.
[18]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J].Analytical Biochemistry,1976,72(7):248-254.
[19]焦艳艳,刘永杰,邱秀翠,等. 氟铃脲对斜纹夜蛾酚氧化酶活性的影响[J].昆虫学报,2010,53(5):517-524.
[20]赵燕,曹露凡,刘奎伟,等. 舞毒蛾(Lymantriadispar)酚氧化酶的酶学特征及有机溶剂对其活性的影响[J].山东农业大学学报,2011,42(1):11-16.
[21]张永亮,曾媛琴,贾永红,等. 桑尺蠖多酚氧化酶的纯化及其部分生物化学性质[J].西南大学学报,2007,29(9):86-90.
[22]庞秋香,庞书香,赵博生. 酚氧化酶及酶原的生化特性与分子生物学研究进展[J].现代生物医学进展,2008,8(1):196-200.
[23]刘守柱,薛超彬,罗万春. 黄粉虫幼虫体壁硬化过程中酚氧化酶活性的变化[J].昆虫学报,2009,52(9):941-945.
[24]Aso Y,Kramer K,Hopkins T,et al. Characterization of haemolymph protyrosinase and a cuticular activator fromManducasexta(L.) [J].Insect Biochemistry,1985,15(1):9-17.
(责任编辑:田 喆)
Characteristics of phenoloxidase fromSpodopteralitura
Xu Guangzeng, Li Wei, Wang Xinhong, Liu Shouzhu, Wang Guiqing
(College of Agriculture, Liaocheng University, Liaocheng 252059, China)
The properties of phenoloxidase (PO) fromSpodopteralitura(Fabricius) were determined with catechol as substrate. The results showed that the optimum pH for PO fromS.liturawas 6.7-7.0, and the enzyme had the maximum stability at pH 6.8. PO showed the highest activity at 30 ℃, while it had the best thermal stability at 20-35 ℃. When the amount of enzyme was limited to 0.1 mL in a total of 3 mL assay mixture, the reaction velocity increased with the concentration of substrate, and when the final concentration of catechol was 10 mmol/L, the velocity reached the highest, and then kept constant; theKmandVmvalues were 7.980 mmol/L and 204.082ΔA/mg·10 s, respectively, with catechol as substrate.
Spodopteralitura; phenoloxidase; enzyme characteristics; stability; enzyme activity
2014-04-18
2014-05-29
聊城大学博士科研启动基金(31805);聊城大学“园艺植物病虫害控制技术研究”重点建设项目
S 433.4
A
10.3969/j.issn.0529-1542.2015.03.009
* 通信作者 E-mail:liushouzhu@lcu.edu.cn

