人抑瘤素M在大肠杆菌中的表达、纯化及其对胆固醇代谢关键基因表达的影响
杜郁,贾晓健,袁芳,王丽,王丽非,洪斌
人抑瘤素M在大肠杆菌中的表达、纯化及其对胆固醇代谢关键基因表达的影响
杜郁*,贾晓健*,袁芳,王丽,王丽非,洪斌
目的 构建人抑瘤素 M(OSM)的原核表达载体,通过表达及纯化获得重组蛋白,为深入研究 OSM 的功能及机制奠定基础。
方法 利用 PCR 技术,从质粒 pOTB7-hOSM 中扩增出人OSM 蛋白编码序列,与原核表达载体 pET-16b 连接,构建表达质粒 pET16b-OSM。在 BL21(DE3) 工程菌中表达目的蛋白,Western blot 法检测 OSM 蛋白的表达。为提高OSM 的可溶性表达,采用共表达分子伴侣的方法提高其上清产物的表达量。将放大发酵的产物处理后,经镍亲和层析法纯化,获得 OSM 成熟蛋白,SDS-PAGE 电泳分析蛋白纯度。MTT 法检测 OSM 对 A375 细胞的抑制活性,实时荧光定量 PCR 试验分析 OSM 对 HepG2 细胞中胆固醇代谢相关基因(LDLR、ABCA1、ApoA-I 和 SR-BI)表达的影响。
结果 成功构建 pET16b-OSM 原核表达质粒,酶切鉴定和测序分析与预期结果完全一致。在 E. coli BL21(DE3) 中实现了目的蛋白的表达,通过共表达分子伴侣质粒 pTf16,进一步提高了可溶性表达的水平。放大发酵产物经镍亲和层析纯化获得 OSM 成熟肽,电泳检测纯度大于 98%。MTT 法检测所制备的 OSM 蛋白抑制 A375 细胞生长的 EC50为315 ng/ml。mRNA 水平检测证实 OSM 能剂量依赖地上调胆固醇代谢相关的低密度脂蛋白受体和 ABCA1 基因的表达。
结论 成功构建了 OSM 的原核表达载体,获得了具有生物学活性的目的蛋白,证实了其对胆固醇代谢关键基因转录的影响,为下一步功能及机制研究奠定基础。
抑瘤素 M; 原核表达; 分子伴侣; 胆固醇代谢
抑瘤素 M(oncostatin M,OSM)最早是从U937 组织型瘤细胞的培养上清中分离出的一种对A375 黑色素瘤细胞有生长抑制作用的细胞因子,主要由活化的 T 淋巴细胞、单核细胞和巨噬细胞表达产生。OSM 同 IL-6、IL-11 和白血病抑制因子(leukemia inhibitory factor,LIF)等细胞因子都属于糖蛋白 130(glycoprotein 130,gp130)细胞因子家族,该家族成员的生物活性具有多样化的特点,在细胞分化、增殖,血细胞生成,免疫调节,炎症应答和协调细胞因子间功能等方面发挥着广泛而重要的作用[1]。体外研究发现 OSM 不仅能调控多种肿瘤细胞生长。而且,OSM 在脂质代谢和心血管病研究领域也具有显著活性,Liu 等[2]发现OSM 能诱导 HepG2 细胞中低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)的表达,并且显著降低高脂高胆固醇饮食地鼠的血浆总胆固醇、低密度脂蛋白胆固醇和甘油三酯的水平[3]。Pöling 等[4]报道 OSM 通过诱导心肌细胞去分化,刺激心脏重构,在心肌梗死过程中发挥保护效应。上述这些结果提示 OSM 在心血管疾病的研究中具有重要的价值。
人 OSM 的相对分子量约为 28 kD,其成熟肽由 196 个氨基酸组成,是一个耐热、耐酸的单链糖蛋白。尽管 OSM 的成熟肽包含有两个 N-糖基化位点,但是尚无研究显示糖基化修饰与 OSM 的体外生物学活性相关,因此,本工作根据 OSM 成熟肽的序列,采用高效的宿主系统和载体,对带有组氨酸标签的重组人抑瘤素 M(HIS-OSM)进行可溶性表达,并利用镍柱亲和层析的方法,分离得到高纯度的 HIS-OSM。在此基础上,对产物的抑瘤和体外调节胆固醇代谢的活性进行了鉴定,本工作为进一步系统研究 OSM 在心血管领域中的应用奠定了基础。
1 材料与方法
1.1 主要材料与仪器
1.1.1 菌株、细胞株和质粒 大肠杆菌 E. coli TG1、E. coli BL21(DE3) 为本实验室保存;质粒pOTB7 购自北京纽朴生物技术有限公司;质粒载体 pGEM-T 购自美国 Promega 公司;质粒载体pET-16b 购自美国 Novagen 公司;Chaperone Plasmid Set 购自大连宝生物工程公司;A375 人黑色素瘤细胞购自中国医学科学院基础医学研究所细胞中心。
1.1.2 培养基 大肠杆菌培养基 LB 的配制参见分子克隆实验指南[5];氨苄青霉素(Amp)在 LB 培养基中使用浓度为 100 μg/ml;A375细胞所用DMEM 培养基购自美国 Gibco 公司。
1.1.3 工具酶和生化试剂 限制性内切酶、T4 DNA 连接酶等均购自大连宝生物工程公司;Pfu DNA 聚合酶购自上海生工生物工程公司;TA 克隆试剂盒购自美国 Promega 公司;UNIQ-10 柱式DNA 胶回收试剂盒购自上海生工生物工程公司。人 OSM 抗体购自美国 Santa Cruz 公司;逆转录试剂盒购自北京全式金公司;SYBR 定量 PCR 试剂盒购自瑞士 Roche 公司。
1.1.4 仪器 MiniCycleTMPTC-200 型 PCR 仪为美国 MJ Research 公司产品;TE 70 型半干转膜仪和 iQ5 多色实时 PCR 仪为美国 Bio-Rad 公司产品;ÄKTA Explorer 系统为美国 GE Healthcare公司产品;Multi Shot 型高压细胞破碎仪为英国Constant 公司产品。
1.2 方法
1.2.1 人 OSM 与组氨酸标签融合蛋白重组表达菌株的构建 根据人 OSM 的 cDNA序列,委托上海生工生物工程公司进行全基因合成,然后插入到质粒 pOTB7 中,构建重组质粒 pOTB7-OSM。以其作为模板,进行 PCR 扩增,设计并合成引物,上游引物:5' TCCATATGGCGGCTATAGGCAGCT GCTC 3'(下划线处为 Nde I 酶切位点)和下游引物:5' CGGGATCCTTACCGGGGCAGCTGTCCCC TG 3'(下划线处为 BamH I 酶切位点),采用 Pfu高保真 DNA 聚合酶进行扩增。将 PCR 产物电泳后进行切胶回收纯化,3' 端加 dATP,克隆到pGEM-T 载体上,得到重组质粒 pGEM-OSM。将重组质粒转化至 E. coli TG1 感受态细胞,挑取白斑,提取其中的重组质粒进行 Nde I 和 BamH I双酶切鉴定。鉴定正确后,琼脂糖凝胶电泳回收Nde I 和 BamH I 双酶切片段和同样经过上述酶切回收的载体 pET-16b 进行连接,转化 E. coli TG1,在含有 Amp 100 μg/ml 的 LB 琼脂平板上挑选转化子。转化子提取质粒进行酶切鉴定,鉴定正确的重组表达质粒命名为 pET16b-OSM。将重组表达质粒转化 E. coli BL21(DE3) 感受态细胞,获得重组表达菌株 E. coli BL21(DE3)/pET16b-OSM。
1.2.2 组氨酸标签人 OSM 在大肠杆菌中的表达 将菌株 E. coli BL21(DE3)/pET16b-OSM 接种于 5 ml LB 培养基,37 ℃、250 r/min 培养过夜,取 1 ml 上述菌液,转种 50 ml LB 培养基,于 37 ℃培养,待菌液 OD600为 0.6 ~ 1.0 时,以 0.1 mmol/L IPTG 诱导 8 h,取 1 ml 菌液 10 000 r/min 离心1 min,收集菌体,1 ml PBS 重悬,冰上超声破碎细胞。超声后于 4 ℃、10 000 r/min 离心 5 min,分别收集细胞裂解物上清和沉淀,SDS-PAGE 和Western blot 检测分析目的蛋白的表达情况。
1.2.3 组氨酸标签人 OSM 与分子伴侣的共表达 OSM 与伴侣蛋白共表达体系的构建采用两步法进行转化,先将 Chaperone Plasmid Set 中三种分子伴侣表达质粒(pG-Tf2、pTf16 和 pKJE7,分别表达 GroES-GroEL-Tig、Tig 和 DnaK-DnaJ-GrpE伴侣蛋白)分别转化 E. coli BL21(DE3) 细胞,再制备转化有伴侣蛋白质粒的感受态细胞,然后将OSM 表达质粒 pET16b-OSM 转化上述相应的E. coli BL21(DE3) 细胞,抗性筛选获得转化子。含有 OSM 表达质粒和分子伴侣的转化子接种于含20 μg/ml 氯霉素和 50 μg/ml Amp 的 LB 培养液中,以 0.5 mg/ml L-阿拉伯糖(用于 pKJE7 和pTf16 质粒)或 10 ng/ml 四环素(用于 pG-Tf2 质粒)分别诱导分子伴侣的表达,37 ℃ 振摇培养,当 OD600达到 0.4 ~ 0.6 时,加入 IPTG 使终浓度为 0.1 mmol/L,37 ℃ 诱导 8 h。收集菌体,离心,超声破碎,通过 SDS-PAGE 分析 OSM 可溶性表达的情况。
1.2.4 组氨酸标签人 OSM 的纯化 表达菌株以40 L 发酵罐放大发酵,溶氧 25%,37 ℃ 下发酵4 h 后以 0.1 mmol/L IPTG 进行诱导,3 h 后终止发酵,收集菌体,用平衡缓冲液(0.02 mol/L Tris-HCl、0.5 mol/L NaCl、0.01 mol/L 咪唑,pH 8.0)悬浮,利用细胞高压破碎仪进行处理,直至无明显菌体。12 000 r/min 离心 10 min,收集上清液,0.45 μm 过滤除菌备用。采用 ÄKTA Explorer 系统,将过滤后的样品上样至以 5 倍体积平衡缓冲液平衡的 His-Trap FF crude 亲和柱,以洗脱缓冲液(0.02 mol/L Tris-HCl、0.5 mol/L NaCl、0.25 mol/L咪唑,pH 8.0)进行梯度洗脱,UV280 nm检测收集目的蛋白样品,SDS-PAGE 分析其表达及纯化情况。
1.2.5 OSM 抑制 A375 细胞生长活性测定 用含 10% FBS 的 DMEM 培养液将 A375 细胞制成密度为 3 × 104/ml 的细胞悬液,接种于 96 孔板,每孔 100 μl。置于 37 ℃、5% CO2条件下培养 6 h。以含 5% FBS 的 DMEM 制备 OSM 浓度梯度,浓度分别为 1050、700、525、262.5、131.25、65.63、32.82 和 16.40 ng/ml,小心吸弃细胞培养液上清,再分别加入制备好的浓度梯度、细胞对照以及空白对照各 100 μl,每样设 3 个复孔。37 ℃、5% CO2培养 5 d,于显微镜下观察细胞形态及增殖情况,每孔加入 MTT(5 mg/ml)10 μl,37 ℃ 继续培养 4 h,加入酸性三联裂解液(10 g SDS、5 ml异丙醇、0.1 ml 10 mol/L HCl,总体积 100 ml),每孔 100 μl,37 ℃ 溶解过夜。于酶标仪 570 nm 处检测吸光度,按下式计算细胞生长抑制率,并利用Sigma plot 9.0 软件计算半数有效浓度(EC50)。
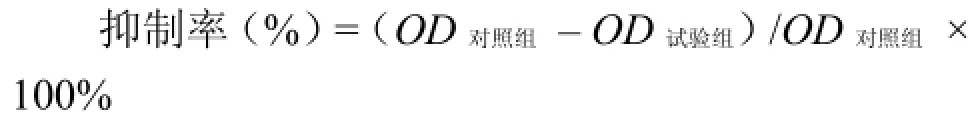
1.2.6 实时荧光定量 PCR 反应法检测靶基因表达 HepG2 细胞接种于 12孔板,加不同浓度的OSM 作用 1 h 后,收集各组细胞提取总 RNA,经逆转录合成 cDNA 后进行 PCR 检测。扩增条件:95 ℃ 预变性 10 min;95 ℃ 变性 15 s,60 ℃退火 30 s,共 40 个循环。用 GAPDH 作为内参基因校正,样本进行 3 次独立的重复实验。并根据各组目的基因及参照基因的 Ct 值通过 2-ΔΔCT法计算靶基因表达。GAPDH 正向引物为 5' A GCCACATCGCTCAGACAC 3',反向引物为 5' G CCCAATACGACCAAATCC 3';载脂蛋白 A-I (apolipoproteinA-I,ApoA-I)正向引物为 5' TGTG TACGTGGATGTGCTCAAAG 3',反向引物为 5' G TCACGCTGTCCCAGTTGTCA 3';ATP 结合转运子 A1(ATP-binding cassette transporter A1,ABCA1)正向引物为 5' GCCTGCTAGTGGTCATC CTG 3',反向引物为 5' CCACGCTGGGATCACTG TA 3';LDLR 正向引物为 5' GAGCCTCTACATGA AATCTGTCG 3',反向引物为 5' ACCTTGGGCATC AACACCAG 3';B 类 I 型清道夫受体(scavenger receptor B type I,SR-BI)正向引物为 5' CTATAGCA AATGCCCCAGGT 3',反向引物为 5' TCCACCTGC TGTGTCATCAT 3'。
1.3 统计学处理
数据用 GraphPad Prism 5 统计软件分析,采用± s 表示,计量组间比较用 one-way ANOVA 检验。P < 0.05 为差异有统计学意义。
2 结果
2.1 人 OSM 与组氨酸标签融合蛋白重组表达载体的构建及表达菌株的获得

图1 OSM 的 PCR 扩增(A)和 pET16b-OSM 的酶切鉴定(B)Figure 1 PCR product of OSM (A) and restriction enzymatic analysis of pET16b-OSM (B)
人 OSM 的编码序列分布于三个外显子上,其成熟肽的编码区位于第二和第三个外显子序列[6]。通过检索 NCBI 中 GenBank 数据库获取人 OSM 的 cDNA 全基因序列(NM_020530.4),全基因合成后插入到 pOTB7 质粒中,构建重组质粒pOTB7-OSM。以此为模板,进行 PCR 扩增,得到预期大小的 PCR 产物(图 1A)。PCR 产物进行序列测定,测序结果与 GenBank 数据库进行 Blast比对和分析,表明获得的片段序列与已知人 OSM的基因序列完全一致。本工作采用质粒 pET-16b作为表达载体,将人 OSM 基因克隆至载体组氨酸标签编码序列之后,可表达组氨酸标签与人 OSM的融合蛋白。将人 OSM 基因片段克隆至载体pET-16b,提取转化子质粒进行酶切鉴定,获得与PCR 扩增的基因大小一致的片段(图 1B),表明人 OSM 基因成功插入了 pET-16b 质粒。将获得的重组表达质粒命名为 pET16b-OSM。将重组表达质粒转化 E. coli BL21(DE3) 感受态细胞,获得重组表达菌株 E. coli BL21(DE3)/pET16b-OSM。
2.2 组氨酸标签人 OSM 的表达分析
37 ℃ 培养条件下,以 0.1 mmol/L 的 IPTG 诱导 8 h,离心收集菌体,超声破碎后离心,分别收集沉淀和上清进行 SDS-PAGE 分析,结果表明表达产物主要存在于包涵体中,细胞裂解液上清中也有少量表达产物,其考马斯亮蓝染色条带所在分子量位置与 OSM 的预测相对分子量相符(图 2A)。Western blot 结果显示 28 kD 相对分子质量处的蛋白条带可与抗人 OSM 抗体特异结合,并且阳性条带主要在 0.1 mmol/L 的 IPTG 诱导表达后的包涵体中出现(图 2B)。由于产物以包涵体形式存在,不利于后续的纯化,为提高 OSM 的可溶性表达,采用分子伴侣共表达的方法,提高其上清产物的表达量。共表达分子伴侣后的 SDS-PAGE 结果分析显示,对照组 OSM 上清表达产物占可溶性产物的14.1%,表达三种伴侣质粒 pG-Tf2、pTf16 和pKJE7 的宿主中 OSM 的总表达量和可溶性表达均有不同程度提高,其中共表达分子伴侣 Tig 的pTf16 质粒的宿主菌中可溶性表达产物所占比例最高,达到 37.4%(图 3)。我们选用该菌株进行后续的放大发酵。
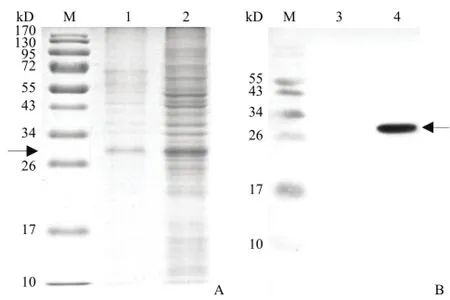
图2 HIS-OSM 的 SDS-PAGE 分析(A)和 Western blot分析(B)Figure 2 SDS-PAGE analysis (A) and Western blot analysis (B) of the expression of HIS-OSM
2.3 组氨酸标签人 OSM 蛋白的纯化
将组氨酸标签人 OSM 表达菌株 E. coli BL21(DE3)/pET16b-OSM(pTf16)在最适条件下发酵,采用 HisTrap FF crude 亲和柱纯化,收集目的蛋白,SDS-PAGE 电泳分析结果显示,通过亲和层析纯化,目的蛋白的纯度可达到 98% 以上(图 4)。经梯度透析,冷干。每升发酵液可获得 33 mg 纯化后的组氨酸标签人 OSM 蛋白。
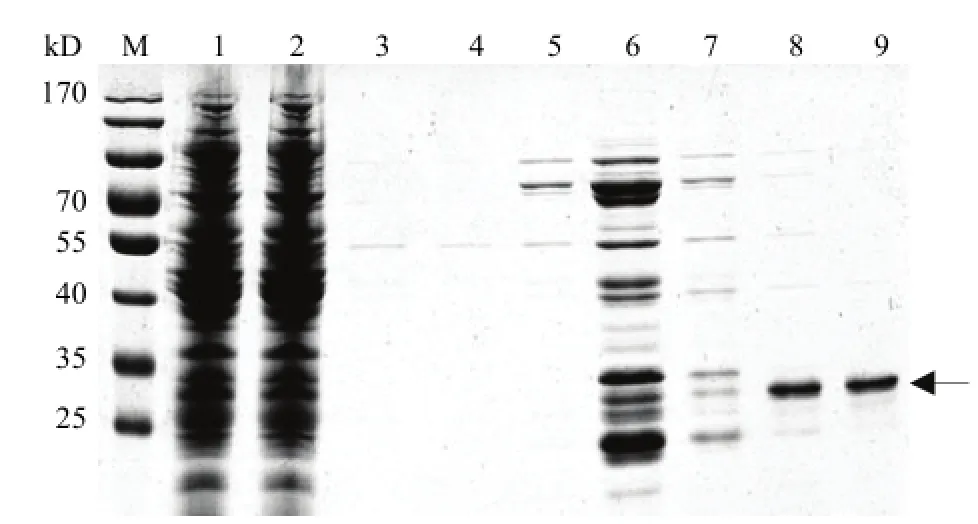
图4 HIS-OSM 蛋白的纯化Figure 4 SDS-PAGE analysis of purified HIS-OSM protein
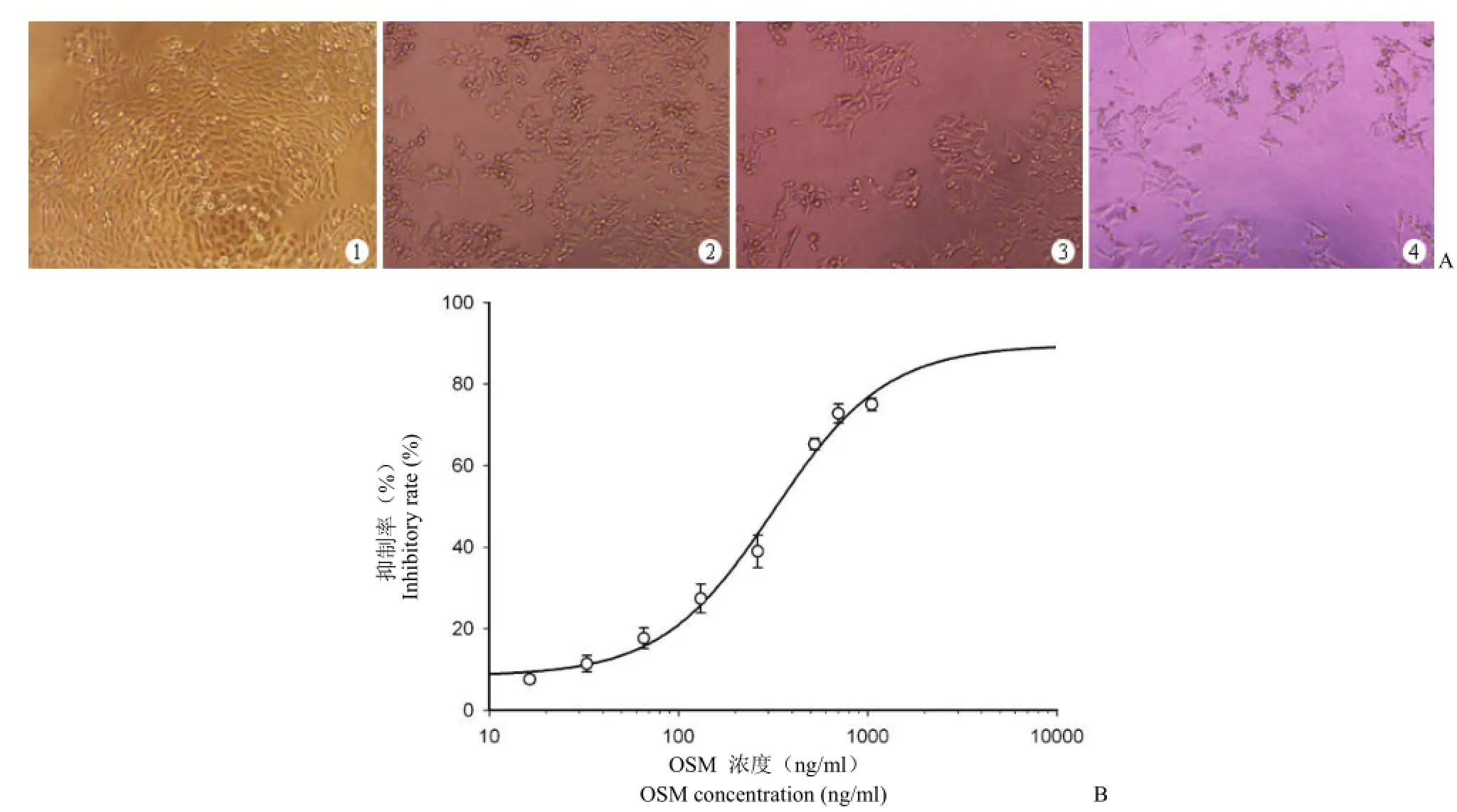
图5 HIS-OSM 对 A375 黑色素瘤细胞的抑制活性分析(A:HIS-OSM 抑制 A375 细胞生长的光镜照片(× 40);1:对照组;2:262.5 ng/ml OSM;3:525 ng/ml OSM;4:1050 ng/ml OSM;B:MTT 法测定 HIS-OSM 对 A375 细胞的抑制活性)Figure 5 Effect of HIS-OSM on the growth of human A375 melanoma cells (A: Microscopy images of inhibitory effect of HIS-OSM on A375 cell (× 40); 1: Control; 2: 262.5 ng/ml OSM; 3: 525 ng/ml OSM; 4: 1050 ng/ml OSM; B: MTT analysis of inhibitory activity of HIS-OSM on A375 cell)
2.4 组氨酸标签人 OSM 蛋白对 A375 细胞的抑制活性
采用经典测活方法,利用人黑色素瘤 A375 细胞株,对人 OSM 进行肿瘤细胞抑制活性测定,结果证明组氨酸标签人 OSM 蛋白对该细胞株具有明显的抑制活性,A375 细胞随 OSM 作用浓度增加,细胞形态发生改变,增殖速度明显变慢,细胞数目逐渐减少(图 5),通过 MTT 法对其活性进行确定,结果显示 OSM 对 A375 细胞的生长呈浓度依赖性抑制,EC50为 315 ng/ml。
2.5 组氨酸标签人 OSM 蛋白调控 HepG2 细胞中胆固醇代谢相关基因表达的活性
以浓度为 50 ~ 1000 pg/ml 的重组人 OSM 作用于人肝 HepG2 细胞,提取 RNA,逆转录后利用实时荧光定量 PCR 的方法对相关靶基因的表达水平进行检测。与空白对照组相比,OSM 处理后,HepG2 细胞中 ApoA-I 和 SR-BI 基因的 mRNA水平未发生明显变化,而 LDLR 和 ABCA1 的 mRNA 水平明显升高,呈现浓度依赖性(图 6)。在 OSM 浓度为 1000 pg/ml 时,对 LDLR 和ABCA1 mRNA 水平的上调作用达到最大,分别是对照组的 5 倍(P < 0.001)和 1.8 倍(P < 0.05)。

图6 HIS-OSM 对 HepG2 细胞中胆固醇代谢相关基因表达的影响Figure 6 Effects of HIS-OSM on mRNA levels of genes involved in cholesterol metabolism in HepG2 cells
3 讨论
本工作通过全基因合成获得人 OSM 成熟肽的基因,利用 pET-16b 和 E. coli BL21(DE3) 表达菌株在大肠杆菌表达系统中成功地对其进行了高效表达,在表达的蛋白 N 端加上组氨酸标签,有利于表达产物的纯化。本工作的结果表明利用大肠杆菌表达体系成功获得了组氨酸标签人 OSM 蛋白。Western blot 分析显示表达的 HIS-OSM 可与人 OSM 抗体产生结合反应,证实其与天然表达的OSM 具有相同的免疫原性,为后续研究其体内外生物学功能提供了保证。利用 Ni sepharose 亲和层析纯化,从大肠杆菌裂解物的上清中分离得到电泳纯度大于 98% 的细胞因子。OSM 抑制 A375 细胞生长试验也表明,获得的组氨酸标签的人 OSM具有明显的体外抑瘤活性,EC50为 315 ng/ml。为进一步研究其生物学功能奠定了基础。
大肠杆菌表达体系具有遗传背景清楚、易于转化、表达量大、适于高密度培养、发酵工艺成熟等优点,但重组蛋白的高水平表达通常会伴随蛋白的异常折叠与包涵体的形成,影响对重组蛋白后续结构和功能的研究。曹勇等[7]在大肠杆菌中对GST-OSM 融合蛋白进行了表达,发现融合蛋白主要以包涵体形式存在,可溶性蛋白中融合蛋白约占15%。本研究在摇瓶发酵初期阶段的结果也表明,OSM 主要表达产物存在于包涵体内。通过调研文献发现,共表达分子伴侣是提高大肠杆菌中可溶性蛋白表达产量的有效策略,分子伴侣可以帮助新合成蛋白正确折叠至自然状态,并辅助折叠错误的蛋白重新进行折叠。大肠杆菌细胞质中主要包括三种伴侣系统:Trigger factor(Tig)、DnaK-DnaJ-GrpE 和GroEL-GroES。各伴侣蛋白间协同作用、共同参与蛋白质折叠[8]。本工作所选用的 pTf16 质粒编码的Trigger factor 伴侣蛋白是大肠杆菌中新生肽链所遇到的第一个分子伴侣,体内外实验证实其在促进蛋白质和新生肽链正确折叠方面起着非常重要的作用[9]。此外,OSM 的成熟肽分子中含有 5 个半胱氨酸残基,可形成两对分子内二硫键,其中第二个和第五个半胱氨酸残基之间形成的二硫键是维持 OSM 生物活性所必需的,该二硫键将螺旋 4同螺旋 1 和螺旋 2 之间的转角连接起来[5]。由此我们推断,OSM 的肽链必须通过一定程度的折叠,才能使肽链上处于不相邻位置的巯基相互接近到可以正确形成二硫键的位置。而分子伴侣通过帮助OSM 正确折叠从而使相应的巯基配对,可能有利于天然二硫键的稳定形成。本研究的结果也支持了这一观点。当然,考虑到大肠杆菌中的还原态是破坏二硫键形成的主要原因[10],所以,在今后的工作中,可以尝试利用带有谷胱甘肽还原酶(gor)突变和(或)硫氧还蛋白还原酶(trxB)突变的菌株,为二硫键的形成提供更合适的氧化还原环境,进而提高 OSM 的可溶性和活性。
在动脉粥样硬化的发病进程中,炎症的作用已经被广泛认识到,巨噬细胞作为介导炎症反应的重要细胞,参与了斑块早期的形成及破裂的过程[11]。由巨噬细胞分泌的 OSM、IL-6 等炎性因子,发挥了多方面的作用。在人和 ApoE 基因敲除的小鼠斑块中都检测到 OSM 的表达,OSM 可能通过促进SMC 细胞的增殖、迁移及细胞外基质蛋白的合成在动脉粥样硬化进程中扮演重要角色[12]。另外,OSM 也能通过减少免疫细胞浸润发挥减轻炎症的作用[13]。众所周知,胆固醇代谢异常与动脉粥样硬化发生密切相关,机体将分布于组织中的胆固醇重新运送回肝脏代谢主要有 LDLR 途径和胆固醇逆转运途径。肝细胞表面 LDLR 能摄取血液中的LDL 并及时清除,降低外源性胆固醇水平。ABCA1将胞内的胆固醇和磷脂转运到 ApoA-I 分子上,是胆固醇逆转运的起始环节,ApoA-I 逐步形成成熟的 HDL 胆固醇,并最终被肝脏表面的 SR-BI 所识别,将胆固醇摄入肝细胞进行代谢。引人关注的是,OSM 不仅能增强 HepG2 细胞中 LDLR 的基因转录[2],Langmann 等[14]还发现 OSM 能诱导人ABCA1 基因启动子的活性。本工作进一步证实了OSM 对 LDLR mRNA 表达水平的上调活性,此外,还首次在 mRNA 水平证实 OSM 以剂量依赖性的方式上调 ABCA1 的表达,证明 OSM 对于介导肝细胞上低密度脂蛋白胆固醇代谢的关键受体 LDLR 和介导胆固醇逆向转运的关键分子ABCA1 都有着明显影响,很有可能是联系炎症反应和脂质代谢紊乱的一个关键因素。因此,OSM 在动脉粥样硬化中具有重要的研究价值,值得我们进一步深入探讨。
志谢 感谢医药生物技术研究所武临专研究员在大规模发酵方面提供的指导帮助。
[1]Richards CD. The enigmatic cytokine oncostatin m and roles in disease. ISRN Inflamm, 2013:512103.
[2]Liu J, Grove RI, Vestal RE. Oncostatin M activates low density lipoprotein receptor gene transcription in sterol-repressed liver cells. Cell Growth Differ, 1994, 5(12):1333-1338.
[3]Kong W, Abidi P, Kraemer FB, et al. In vivo activities of cytokine oncostatin M in the regulation of plasma lipid levels. J Lipid Res,2005, 46(6):1163-1171.
[4]Pöling J, Gajawada P, Richter M, et al. Therapeutic targeting of the oncostatin M receptor-β prevents inflammatory heart failure. Basic Res Cardiol, 2014, 109(1):396.
[5]Sambrook J, Fritsch EF, Maniatis T. Molecular cloning. Jin DY, Li MF,Translation. 2nd ed. Beijing: Science Press, 1992:908. (in Chinese)
J.萨姆布鲁克, EF 弗里奇, T 曼尼阿蒂斯. 分子克隆实验指南.金冬燕, 黎孟枫, 译. 2版. 北京: 科学出版社, 1992:908.
[6]Chen GY. Cao XT, Ye TX. Research progress in Oncostatin M.Immunol J, 1994, 10(2): 71-74. (in Chinese)
陈国友, 曹雪涛, 叶天星. 抑瘤素 M 的研究进展. 免疫学杂志,1994, 10(2):71-74.
[7]Cao Y, Zhang ZS, Wen LM, et al. Expression, purification and bio-activity analysis of oncostatin in GST-fusion expression sysytem. Acta Microbiologica Sinica, 1999, 39(4):333-338. (in Chinese)
曹勇, 张兆山, 文立民, 等. 抑瘤素-M(OSM)在GST融合表达系统中的表达、纯化和活性测定. 微生物学报, 1999, 39(4):333-338.
[8]Cui SS, Lin XZ, Shen JH. Effects of co-expression of molecular chaperones on heterologous soluble expression of the cold-active lipase Lip-948. Protein Expr Purif, 2011, 77(2):166-172.
[9]Nishihara K, Kanemori M, Yanagi H, et al. Overexpression of trigger factor prevents aggregation of recombinant proteins in Escherichia coli. Appl Environ Microbiol, 2000, 66(3):884-889.
[10]Lei RY, Qiao YH, Yan JD, et al. Soluble expression of recombinant human BMP6 in Escherichia coli and its purification and bioassay in vitro. Chin J Biotech, 2008, 24(3):452-459. (in Chinese)
雷荣悦, 乔玉欢, 闫继东, 等. 重组人BMP6在大肠杆菌中可溶表达、纯化及活性分析. 生物工程学报, 2008, 24(3):452-459.
[11]Boyle JJ. Macrophage activation in atherosclerosis: pathogenesis and pharmacology of plaque rupture. Curr Vasc Pharmacol, 2005, 3(1):63-68.
[12]Albasanz-Puig A, Murray J, Preusch M, et al. Oncostatin M is expressed in atherosclerotic lesions: a role for Oncostatin M in the pathogenesis of atherosclerosis. Atherosclerosis, 2011, (2):292-298.
[13]Slaets H, Nelissen S, Janssens K, et al. Oncostatin M reduces lesion size and promotes functional recovery and neurite outgrowth after spinal cord injury. Mol Neurobiol, 2014, 50(3):1142-1151.
[14]Langmann T, Porsch-Ozcürümez M, Heimerl S, et al. Identification of sterol-independent regulatory elements in the human ATP-binding cassette transporter A1 promoter: role of Sp1/3, E-box binding factors,and an oncostatin M-responsive element. J Biol Chem, 2002, 277(17):14443-14450.
Methods The gene encoding mature human OSM protein was amplified from plasmid pOTB7-OSM by PCR and cloned into pET-16b. The fusion protein was expressed in E. coli BL21(DE3) and identified by Western blot. In order to increase the yield of soluble fractions, molecular chaperones were co-expressed along with the OSM. The protein in the cellular lysate supernatant was purified by nickel affinity chromatography after fermentation. The purified HIS-OSM was identified by SDS-PAGE. The biological activity was measured in a growth inhibition assay using A375 cells by MTT test. The functional activity of the HIS-OSM on expression of genes involved in cholesterol metabolism in HepG2 cells was analyzed in vitro by real time PCR assay.
Results The prokaryotic expression plasmid pET16b-OSM was successfully constructed. The results identified by enzyme digestion and nucleotide sequencing corresponded exactly to the expected. The HIS-OSM protein expressed in E. coli BL21(DE3)and identified as OSM by Western blot, and the soluble form of the product was increased by co-expression of chaperone plasmid pTf16. SDS-PAGE analysis showed that HIS-OSM with purity > 98% was harvested by nickel affinity purification. Biological activity tests showed that HIS-OSM inhibits A375 human melanoma cell growth and the EC50was 315 ng/ml. The mRNA levels of ABCA1 and LDLR were increased by HIS-OSM in a dose-dependent manner in HepG2 cells.
Conclusion The prokaryotic expression vector of human OSM protein is successfully constructed. The function of OSM protein on gene transcription related to cholesterol metabolism is identified in vitro. This study establishes a foundation of further research and utilization of OSM.
Prokaryotic expression and purification of human oncostatin M and its effects on the expression level of key players in cholesterol metabolism
DU Yu, JIA Xiao-jian, YUAN Fang, WANG Li, WANG Li-fei, HONG Bin
Objective To construct a new human oncostatin M (OSM) prokaryotic expression vector, and obtain recombinant protein by expression and purification, which is expected to provide basis for the functional mechanism study.
Oncostatin M; Prokaryotic expression; Molecular chaperones; Cholesterol metabolism
s: HONG Bin, Email: binhong69@hotmail.com; WANG Li-fei, Email: lifeiwang2002@hotmail.com
10.3969/cmba.j.issn.1673-713X.2015.03.003
“十二五”国家科技支撑计划(2012BAK25B01);协和青年科研基金(3332013088)
100050 北京,中国医学科学院医药生物技术研究所卫生部抗生素生物工程重点实验室
洪斌,Email:binhong69@hotmail.com;王丽非,Email:lifeiwang2002@hotmail.com
2014-12-15
*同为第一作者
www.cmbp.net.cn 中国医药生物技术, 2015, 10(3):203-210
Author Affiliation: Key Laboratory of Biotechnology of Antibiotics of Ministry of Health, Institute of Medicinal Biotechnology,Chinese Academy of Medical Sciences, Beijing 100050, China
www.cmbp.net.cn Chin Med Biotechnol, 2015, 10(3):203-210

