BRCA1在乳腺癌细胞系中负调控miR-146a并抑制其促癌功能
李丹,康南,张维敏,詹启敏
·论著·
BRCA1在乳腺癌细胞系中负调控miR-146a并抑制其促癌功能
李丹,康南,张维敏,詹启敏
目的 在乳腺癌细胞系中,研究 BRCA1 基因对 miR-146a的调控,以及 miR-146a 的细胞学功能。
方法 采用 Western blot 和实时定量 PCR 检测 BRCA1基因对 miR-146a 的调控;利用生物信息学分析软件对BRCA1 以及 miR-146a 的相互调控进行分析;运用 MTS、克隆形成、Transwell 等实验技术检测 miR-146a 高表达及敲降对 MCF-7 细胞生长增殖、侵袭迁移等能力的影响。
结果 该研究发现 BRCA1 缺失的情况下,miR-146a 表达显著表达升高。通过对 miR-146a 启动子区分析发现BRCA1 可以与 miR-146a 启动子区结合并调控其表达,同时 miR-146a 可以与 BRCA1 3'UTR 不完全互补结合,这提示 BRCA1 对 miR-146a 的调控是一种负反馈作用机制。该研究还发现 miR-146a 高表达可以促进细胞生长增殖和侵袭迁移的能力,而 miR-146a 敲降后却可以抑制细胞这些表型。
结论 在乳腺癌细胞中,BRCA1 通过负调控 miR-146a 的表达来抑制其促癌功能。
微 RNAs; 基因,BRCA1; 基因表达调控,肿瘤
BRCA1 是一种常见的与家族遗传性乳腺癌和卵巢癌有关的抑癌基因[1],在乳腺癌中常存在低表达,并且与恶性程度相关[2]。BRCA1 基因定位于人类第十七号染色体,由 24 个外显子组成,编码一个由 1863 个氨基酸组成的分子量为 220 kD 的蛋白[3]。许多研究表明 BRCA1 参与细胞和生命活动中重要的进程如细胞周期调控、DNA 损伤修复、转录调控及泛素化降解等过程[4],如 BRCA1 通过同源重组的方式参与细胞 DNA 损伤修复过程,当DNA 受到损伤后,BRCA1 蛋白改变原来散在的分布于细胞核中的状态而汇集到 DNA 损伤位点如 R-loops 上,导致转录终止来完成 DNA 损伤修复[5]。另外,BRCA1 还具有泛素化连接酶的活性,催化底物蛋白 FANCD2、NPM 及 γPMCD2 连接酶等,从而参与到 DNA 损伤修复等生物学过程中[6]。
MicroRNA 是一类重要的非编码小 RNA,通过与靶 mRNA 的特异性结合介导靶mRNA 的降解或翻译抑制[7]。MicroRNA 参与调控复杂的基因网络,包括生物进化、胚胎发育、细胞分化、细胞增殖、信号转导等多种生命活动[8-10]。大量研究表明,microRNA 表达的改变会引起一些重要生物学过程的异常调控从而引起疾病甚至肿瘤的发生[11-13],因此 microRNA 可被看作是一类新的抑癌基因和癌基因,通过形成复杂的调控网络来影响肿瘤的发生和发展[14]。MicroRNA 表达谱在人类肿瘤中的变化,可以作为对肿瘤进行分类及诊断的有效方法[15]。研究发现,多于 60% 的细胞 mRNA 是受到 microRNA 调控的,BRCA1 基因也不例外[16]。BRCA1 基因的 3′UTR 长约 1.5 kb,可以与 20 ~200 个 microRNA 结合[17-18],其中 miR-146a 是调控 BRCA1 基因的一个重要的 microRNA,它可以与 BRCA1 基因的 3'UTR 互补结合从而调控BRCA1 基因的表达[19-20]。目前根据启动子区分析研究发现多种转录因子,包括 NF-κB、IRF3/IRF7、C/EBPI 等,可通过结合 miR-146a 启动子区调控miR-146a 的表达[21]。
本研究发现在 BRCA1 基因失活的情况下,miR-146a 表达显著升高。通过启动子区相关分析发现,BRCA1 基因可以与 miR-146a 的启动子区结合,并调控 miR-146a 的表达,我们又在 MCF-7中检测了 miR-146a 对细胞生长增殖、迁移侵袭的影响,旨在揭示 BRCA1 基因在乳腺癌中对miR-146a 的调控功能。
1 材料与方法
1.1 材料
1.1.1 细胞培养 293 sh control、293 shBRCA1、MCF-7 sh control、MCF-7 sh BRCA1、MEF BRCA1+/+、MEF BRCA1-/- 及 MCF-7 采用 90% DMEM 培养基加 10% 胎牛血清,于 37 ℃,5% CO2孵箱中培养。
1.1.2 仪器 7300 荧光定量 PCR 仪为美国ABI 公司产品;iMark 酶标仪购自美国 Bio-Rad公司;GeneGenius 全自动凝胶成像仪购自英国Syngene 公司;ImageQuant LAS4000 超灵敏发光成像分析仪购自美国 GE 公司;BX51 显微镜购自Qlympus 公司。
1.2 方法
1.2.1 实时定量 PCR 提取 MCF-7 细胞的总 RNA,进行逆转录,实时定量 PCR步骤根据 SYBR-Green 半定量进行,每次试验重复至少3 次。其反应体系如下:1 × SYBR-Green Premix EX Taq 试剂、50 ng DNA、基因引物 0.1 μmol/L,终体积为 20 μl。反应条件为 95 ℃ 30 s、95 ℃ 5 s、60 ℃ 31 s,共 40 个循环。通过分析产物的溶解曲线来确定扩增的特异性。采用的特异性引物miR-146a 和内参 U6 均由广州市锐博生物科技有限公司合成。其中 miR-146a 引物是锐博生物科技有限公司提供的试剂盒 Bulge-loopTMqPCR Primer Set,序列没有公开;内参 U6 引物上游:CTCGCTT CGGCAGCACA,下游:AACGCTTCACGAATTTG CGT。
1.2.2 Western blot 提取 MCF-7 细胞的总蛋白,按蛋白分子量要求制备相应浓度的 SDS-PAGE分离胶和积层胶,待积层胶层凝固后,小心地拔出梳子,反复冲洗上样孔,将凝胶玻璃板固定于电泳装置上,加入 1 × Tris-甘氨酸电泳缓冲液,加样孔用电泳缓冲液冲洗后上样,之后先以 80 V 电压电泳,当染料前沿到达分离胶与积层胶交界时,调电压至 100 ~ 120 V 电泳,直至染料到达最下沿,然后进行湿转转膜,恒流 0.3 A 左右转膜 2 h 左右,之后蛋白免疫印迹进行一抗及二抗的孵育,最后进行曝光。
1.2.3 瞬时转染 取对数生长期 MCF-7 细胞接种于相应培养皿中,将 miR-146a mimic,inhibitor和阴性对照转入细胞,转染步骤参照LipofectamineTM2000 试剂盒说明书。其中miR-146a mimic,inhibitor 和阴性对照由广州市锐博生物科技有限公司合成。
1.2.4 MTS 和克隆形成实验 ①MTS:将转染48 h 的 MCF-7 细胞消化,计数,接种于 96 孔板中,每孔加 200 μl 含 2000 个细胞的 10% 胎牛血清的 DMEM 培养基,每组做 5 个复孔,种 4 个96 孔板(分别为 0、24、48、72 h)每次测之前将培养基换成含 1% ~ 2% MTS 的培养基(避光),37 ℃、5% CO2孵箱中孵育 0.5 ~ 1 h,取出,用iMark 酶标仪选择波长 490 nm 为检测光,630 nm为参照光,测细胞的 MTS 值,计数,计算每组的平均值,细胞的生长快慢与 MTS 值成正比。②克隆形成实验:将转染 48 h的细胞消化,计数,以每皿 500 ~ 1000 个细胞接种于 60 mm 的培养皿中,每组做 3 ~ 4 个重复,培养 7 ~ 10 d,每个细胞克隆球里面单个细胞数大于 50 时,收细胞,用1 × PBS 洗 2 次,再用甲醇固定 5 ~ 10 min,之后用结晶紫染 15 ~ 20 min,晾干,用仪器拍照并计数,计算每组的平均值。
1.2.5 Transwell 实验 细胞侵袭实验:将基质胶在 4 ℃ 融化,用无血清 DMEM 培养基配制 2%的基质胶,将配好的胶铺到 24 孔 Transwell 上室,每孔 100 μl,孵育过夜,将转染 36 h 后的MCF-7 细胞用无血清的 DMEM 培养基饥饿 6 ~8 h,消化的细胞用无血清的 DMEM 培养基洗2 遍,以每孔 200 μl 含 105个细胞的 10% 胎牛血清的 DMEM 培养基接种于 24 孔 Transwell上室,在下室中加入 600 μl 含 20% 胎牛血清的DMEM 培养基,于 37 ℃、5% CO2孵箱中培养20 h,用甲醇固定 Transwell 小室 1 min,结晶紫染色 5 min,将小室放入水中冲洗一下,再用棉棒擦去小室内底部表面的细胞,用正置荧光显微镜(10 倍)拍照,每孔选择 9 个视野,计数,计算每组小室细胞的平均数。
1.3 统计学处理
通过 GraphPad Prism 5 软件在 windows7 平台下进行统计学处理,符合正态分布的计量资料用±s表示,组间比较采用 t 检验,P < 0.05 的差异被认为具有统计学意义。
2 结果
2.1 BRCA1 表达的缺失增加 miR-146a 在各种细胞系中的表达量
在多种细胞系中,通过 Western blot 检测BRCA1 的蛋白表达量,如图 1A 所示;在上述细胞系中通过实时定量 PCR 检测 miR-146a 的表达量,发现 BRCA1 基因失活的情况下,miR-146a 表达显著升高,如图 1B 所示。

图1 在不同细胞系中,BRCA1 和 miR-146a 的表达量(A:Western blot 检测 BRCA1 在细胞系中的表达量,其中 β-actin作为对照;B:实时定量 PCR 检测转染 miR-146a 在细胞系中的表达量,miR-146a 表达量标准化到 U6;*P < 0.05)Figure 1 BRCA1 and miR-146a expression in different cell lines (A: The expression of BRCA1 and β-actin was detected by Western blot with the corresponding antibodies. β-actin was used as loading control; B: miR-146a expression inversely correlates with BRCA1 expression in different cell lines. The expression of miR-146a was detected by qRT-PCR and normalized to U6;*P <0.05)

图2 BRCA1 与 miR-146a 启动子区的结合序列及 miR-146a(A)与 BRCA1 的 3'UTR 结合位点(B)Figure 2 BRCA1-binding regions on miR-146a promoter (A) and miR-146a is downstream of BRCA1 (B)
2.2 BRCA1 与 miR-146a 生物信息学研究
通过生物信息学方法,发现人类 miR-146a 位于 5 号染色体上的 LOC285628 中,进一步分析两个 ESTs encompassing LOC285628,发现这两个基因包含两个外显子,中间有 16 kb 基因序列断开,且 miR-146a 位于第 2 个外显子中,如图 2A所示(数据来源于 JASPAR database);而 miR-146a可以与 BRCA1 3'UTR 不完全互补的结合,如图2B 所示(数据来源于 miRbase)。
2.3 MCF-7细胞系中转染 miR-146a mimic 和inhibitor 后 miR-146a的表达量
在 MCF-7 细胞中转染 miR-146a mimic 和inhibitor 后其检测 miR-146a 的 RNA 水平的表达量会有差异(图 3),real-time PCR 结果提示转染 miR-146a mimic 和 inhibitor 与对照组相比分别会增加和降低 miR-146a 在细胞中的表达量,且具有统计学意义,P 值分别为 0.0011 和 0.0027。
2.4 miR-146a 高表达及低表达对 MCF-7 细胞生长增殖的影响
将 miR-146a mimic 和 inhibitor 转入 MCF-7细胞后,检测其对细胞生长增殖的影响,图 4A 是MTS 检测细胞生长,绘制细胞生长曲线,结果发现在 48 h 时转染 miR-146a mimic 组的生长速率相对于实验组明显升高,P = 0.027,存在统计学差异(P < 0.05),而转染 miR-146a inhibitor 组的生长速率相对于实验组降低得并不明显;72 h 时转染miR-146a mimic 组的生长速率相对于实验组明显升高,P = 0.017,具有统计学差异(P < 0.05),而转染 miR-146a inhibitor 组的生长速率相对于实验组明显降低,P = 0.028,有显著差异;96 h 时miR-146a mimic 组的生长速率相对实验组明显升高,P = 0.007,具有显著统计学差异(P < 0.01),而转染 miR-146a inhibitor 组的生长速率相对于实验组明显降低,P = 0.037,有显著差异(P < 0.05),这说明高表达 miR-146a 能够促进细胞生长,抑制后抑制细胞生长。

图3 Real time PCR 检测转染 miR-146a mimic 和inhibitor 后 miR-146a 的表达量(**P < 0.01)Figure 3 The expression of miR-146a in MCF-7 cell line after transfected with miR-146a mimic and inhibitor (**P <0.01)

图4 高表达 miR-146a 促进 MCF-7 细胞生长增殖能力(A:MTS 检测 miR-146a 对细胞生长的影响;B:克隆形成试验检测 miR-146a 对细胞增殖的影响;*P < 0.05 和**P < 0.01)Figure 4 miR-146a overexpression results in increased proliferation and colony formation in MCF-7 cell line [A: Relative cell proliferation (as measured by the MTS assay) of MCF-7 cell transfected with miR-146a mimic and inhibitor; B: Colony images taken after 7 - 10 d of MCF-7 cell transfected with miR-146a mimic and inhibitor are shown;*P < 0.05 and**P < 0.01]
图 4B 是克隆形成实验检测细胞增殖,其中对照组克隆数为(96 ± 17)个,miR-146a mimic 组为(185 ± 58)个,其中 P = 0.035,差异具有统计学意义(P < 0.05);而 miR-146a inhibitor 组为(70 ± 16)个,相对于对照组 P = 0.042,差异具有统计学意义(P < 0.05),这说明高表达 miR-146a 能够促进 MCF-7 细胞生长增殖,抑制其表达后具有抑制MCF-7 细胞生长增殖的能力。
2.5 miR-146a 高表达及低表达对 MCF-7 细胞侵袭转移的影响
将每孔 105个 MCF-7 细胞接种于 Transwell小室经 20 h 培养后计数并计算每个小室平均值,在迁移试验中,对照组细胞数平均为(56 ± 17)个,miR-146a mimic 组平均为(89 ± 26)个,两者相比具有统计学差异 P = 0.022(P < 0.05),而 miR-146a inhibitor 组为(36 ± 14)个,相对于对照组 P = 0.023,差异具有统计学意义(P < 0.05);在侵袭试验中,对照组细胞数平均为(53 ± 12)个,miR-146a mimic 组平均为(76 ± 14)个,两者相比具有明显统计学差异 P = 0.005(P < 0.01),而 miR-146ainhibitor 组为(36 ± 9)个,相对于对照组 P = 0.014,差异具有统计学意义(P < 0.05)。结果说明高表达miR-146a 能够促进细胞生长迁移和侵袭能力,抑制其表达后抑制细胞迁移和侵袭能力。
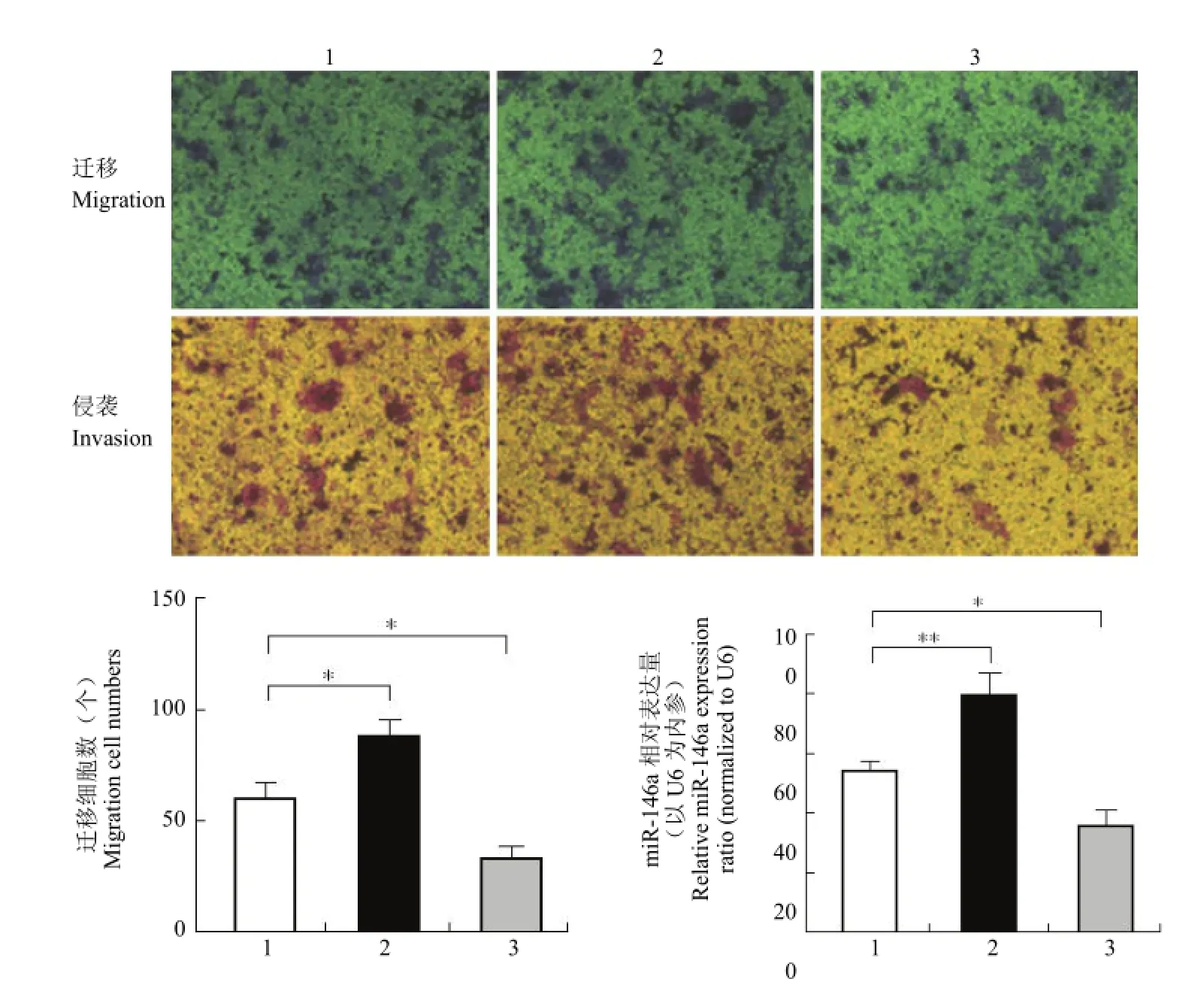
图5 Transwell 试验检测 miR146a 对 MCF-7 细胞迁移、侵袭能力的影响(*P < 0.05 和**P < 0.01)Figure 5 miR-146a positively modulates MCF-7 cell migration and invasion. MiR-146a increased cellular motility of MCF-7 cell. Representative pictures (top) and quantitative data (down) of Transwell (migration or invasion) assays (*P < 0.05 and**P < 0.01)
3 讨论
BRCA1 是世界上首个被发现的家族遗传性乳腺癌抑癌基因,携带突变 BRCA1 基因的人罹患乳腺癌和卵巢癌的风险将极大升高[1]。近年来发现BRCA1 可以与多个 miRNA 结合[17-18],其中miR-146a 是调控 BRCA1 基因的一个重要的miRNA,它可以与 BRCA1 基因的 3'UTR 互补结合从而调控 BRCA1 基因的表达[19-20]。miRNAs 是一些由内源性基因编码的长度约 22 nt 的单链非编码 RNA,它们的靶向序列一般由 2 ~ 8 个核苷酸与 mRNA 3'UTR 的 5' 端或“seed region”互补结合来调控基因的表达,从而阻止靶 mRNA 的翻译或者直接降解靶 mRNA[7]。目前已经发现真核生物 miRNAs 参与基因表达调控,miRNA 参与调控复杂的基因网络,如细胞的凋亡、增殖、分化等[8-10],这说明 miRNA 既可以作为癌基因(mir-17-92 cluster)也可作为抑癌基因(miR-3a)发挥功能[14]。本研究发现在 BRCA1 低表达的情况下,miR-146a的表达量显著升高。通过 JASPAR database 对miR-146a 启动子区进行预测,发现 BRCA1 可以与 miR-146a 的启动区结合。有研究表明,BRCA1 是 miR-146a 的靶基因,我们通过 TargetScan、miRbase 等数据库也发现 BRCA1 的 3'UTR 存在与 miR-146a结合的“seed region”,这提示 BRCA1调控 miR-146a 是一种负反馈方式,但 BRCA1 调控 miR-146a 的具体机制目前还无明确报道,这也为以后的研究提供依据和思路。有研究发现miR-146a 在多种肿瘤中存在异常表达,miR-146a可以靶向细胞黏附分子 L1,并抑制胃癌细胞(MKN-45 cell)的转移能力[22];miR-146a 的多态性与前列腺癌的发病风险有关[23];miR-146a 可以作为结直肠肿瘤定位的一个生物标志物[24];miR-146a 的 SNP 可以作为非黑色素瘤皮肤癌的一个易感因素[25];miR-146a 的多态性促进口腔鳞状细胞癌起始和发展[26];在甲状腺滤泡癌中pre-miR-146a 低表达[27],因此提示 miR-146a 是一种与肿瘤相关的 miRNA,但是目前 miR-146a 在乳腺中的功能还不明确。在本研究中我们通过构建miR-146a mimic 和 inhibitor,转入乳腺癌细胞MCF-7 中,采用 MTS 描绘细胞生长曲线,克隆形成试验,Transwell 试验检测 miR-146a 对细胞生长增殖、迁移侵袭的影响,结果发现 miR-146a高表达可以促进 MCF-7 细胞生长增殖、迁移侵袭,这说明 miR-146a 作为一种癌基因发挥作用,同时,miR-146a 可能成为疾病诊断的新的标志物或者药物靶点,从而为人类疾病及肿瘤的预防、诊断和治疗提供一种新的手段。
[1]Rebbeck TR, Mitra N, Wan F, et al. Association of type and location of BRCA1 and BRCA2 mutations with risk of breast and ovarian cancer. JAMA, 2015, 313(13):1347-1361.
[2]Catteau A, Harris WH, Xu CF, et al. Methylation of the BRCA1 promoter region in sporadic breast and ovarian cancer: correlation with disease characteristics. Oncogene, 1999, 18(11):1957-1965.
[3]Hedau S, Batra M, Singh UR, et al. Expression of BRCA1 and BRCA2 proteins and their correlation with clinical staging in breast cancer. J Cancer Ther, 2015, 11(1):158-163.
[4]Chang S, Sharan SK. BRCA1 and microRNAs: emerging networks and potential therapeutic targets. Mol Cells, 2012, 34(5):425-432.
[5]Hatchi E, Skourti-Stathaki K, Ventz S, et al. BRCA1 recruitment to transcriptional pause sites is required for R-loop-driven DNA damage repair. Mol Cell, 2015, 57(4):636-647.
[6]Baer R, Ludwig T. The BRCA1/BARD1 heterodimer, a tumor suppressor complex with ubiquitin E3 ligase activity. Curr Opin Genet Dev, 2002, 12(1):86-91.
[7]Zaravinos A. The regulatory role of microRNAs in EMT and cancer. J Oncol, 2015, 2015:865816.
[8]Reinhart BJ, Slack FJ, Basson M, et al. The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditis elegans. Nature,2000, 403(6772):901-906.
[9]Brennecke J, Hipfner DR, Stark A, et al. Bantam encodes a developmentally regulated microRNA that controls cell proliferation and regulates the proapoptotic gene hid in Drosophila. Cell, 2003,113(1):25-36.
[10]Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell, 2004, 116(2):281-297.
[11]Hünten S, Siemens H, Kaller M, et al. The p53/microRNA network in cancer: experimental and bioinformatics approaches. Adv Exp Med Biol, 2013, 774:77-101.
[12]Hata A. Functions of microRNAs in cardiovascular biology and disease. Annu Rev Physiol, 2013, 75:69-93.
[13]Wang KC, Garmire LX, Young A, et al. Role of microRNA-23b in flow-regulation of Rb phosphorylation and endothelial cell growth. Proc Natl Acad Sci U S A, 2010, 107(7):3234-3239.
[14]McNally L, Manne U, Grizzle WE. Post-transcriptional processing of genetic information and its relation to cancer. Biotech Histochem,2013, 88(7):365-372.
[15]McManus MT. MicroRNAs and cancer. Semin Cancer Biol, 2003,13(4):253-258.
[16]Menor M, Ching T, Zhu X, et al. mirMark: a site-level and UTR-level classifier for miRNA target prediction. Genome Biol, 2014, 15(10):500.
[17]Griffiths-Jones S, Saini HK, van Dongen S, et al. miRBase: tools for microRNA genomics. Nucleic Acids Res, 2008, 36(Database issue):D154-D158.
[18]JJohn B, Enright AJ, Aravin A, et al. Human MicroRNA targets. PLoS Biol, 2004, 2(11):1862-1879.
[19]Garcia AI, Buisson M, Bertrand P, et al. Down-regulation of BRCA1 expression by miR-146a and miR-146b-5p in triple negative sporadic breast cancers. EMBO Mol Med, 2011, 3(5):279-290.
[20]Shen J, Ambrosone CB, DiCioccio RA, et al. A functional polymorphism in the miR-146a gene and age of familial breast/ovarian cancer diagnosis. Carcinogenesis, 2008, 29(10):1963-1966.
[21]Taganov KD, Boldin MP, Chang KJ, et al. NF-kappaB-dependent induction of microRNA miR-146, an inhibitor targeted to signaling proteins of innate immune responses. Proc Natl Acad Sci U S A, 2006,103(33):12481-12486.
[22]Hou Z, Yin H, Chen C, et al. microRNA-146a targets the L1 cell adhesion molecule and suppresses the metastatic potential of gastric cancer. Mol Med Rep, 2012, 6(3):501-506.
[23]George GP, Gangwar R, Mandal RK, et al. Genetic variation in microRNA genes and prostate cancer risk in North Indian population. Mol Biol Rep, 2011, 38(3):1609-1615.
[24]Omrane I, Kourda N, Stambouli N, et al. MicroRNAs 146a and 147b biomarkers for colorectal tumor's localization. Biomed Res Int, 2014,2014:584852.
[25]Farzan SF, Karagas MR, Christensen BC, et al. RNASEL and MIR146A SNP-SNP interaction as a susceptibility factor for non-melanoma skin cancer. PLoS One, 2014, 9(4):e93602.
[26]Palmieri A, Carinci F, Martinelli M, et al. Role of the MIR146A polymorphism in the origin and progression of oral squamous cell carcinoma. Eur J Oral Sci, 2014, 122(3):198-201.
[27]Roncati L, Pignatti E, Vighi E, et al. Pre-miR146a expression in follicular carcinomas of the thyroid. Pathologica, 2014, 106(2):58-60.
Methods Western blot and real time PCR assays were performed to examined the regulation of BRCA1 on miR-146a.
Bioinformatics tools were applied to analyze the bidirectional regulation between BRCA1 and miR-146a. MTS, colony formation,transwell assays were selected to test the effects of miR-146a mimic and inhibitor on cell growth and proliferation, migration and invasion of MCF-7 cells.
Results The loss of endogenous BRCA1 greatly attenuated the expression of miR-146a. By means of promoter analysis, the results showed that BRCA1 was able to bind the promoter region of miR-146a and regulate its expression, while miR-146a could be partially complementary to bind BRCA1 3'UTR, suggesting that BRCA1 modulated miR-146a in a negative feedback mechanism. miR-146a mimic promoted the ability of cell growth, proliferation, migration and invasion, while miR-146a inhibitor had the reversed function. Conclusions BRCA1 negatively regulates miR-146a and inhibits its tumor promoting functions in breast cancer cells.
BRCA1 negatively regulates miR-146a and inhibits its tumor promoting functions in breast cancer cells
LI Dan, KANG Nan, ZHANG Wei-min, ZHAN Qi-min
Objective To investigate the regulation of BRCA1 on miR-146a and the biological functions of miR-146a in breast cancer cells.
MicroRNAs; Gene, BRCA1; Gene expression regulation, neoplastic
ZHAN Qi-min, Email: zhanqimin@pumc.edu.cn
10.3969/cmba.j.issn.1673-713X.2015.03.002
中国医学科学院肿瘤医院院所基本科研业务费(JK2011B22)
100021 北京,中国医学科学院肿瘤医院/北京协和医学院分子肿瘤学国家重点实验室
詹启敏,Email:zhanqimin@pumc.edu.cn
2015-04-06
www.cmbp.net.cn 中国医药生物技术, 2015, 10(3):196-202
Author Affiliation: State Key Laboratory of Molecular Oncology, Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China
www.cmbp.net.cn Chin Med Biotechnol, 2015, 10(3):196-202

