抗耐药菌药物研究进展
朱俊泰,刘宗英,李卓荣
抗耐药菌药物研究进展
朱俊泰,刘宗英,李卓荣
抗生素的发现被认为是现代医学最重要的突破之一。但是随着抗生素的广泛使用,一些菌株如革兰阳性菌中的耐甲氧西林金黄色葡萄球菌(MRSA)、耐青霉素肺炎链球菌(PRSP)、革兰阴性菌中的耐万古霉素肠球菌(VRE)、铜绿假单胞菌和鲍曼不动杆菌开始出现多药耐药性(MDR),甚至极高耐药性(XDR)和完全耐药性(TDR),给临床治疗造成严重困难[1-3]。我们对细菌感染的治疗选择范围也越来越小,临床医生甚至需要使用那些毒性比较大、临床数据不完善的老药,比如多黏菌素[4]。世界卫生组织 2014年4月发布报告称,抗生素耐药性细菌正蔓延至全球各地,全世界正进入一个后抗生素时代,如不采取措施,目前可治愈的感染性疾病和小的创伤将来可能会导致死亡[5]。因此,研究并发现新的抗耐药菌药物已经势在必行。
细菌接触抗菌药物可发生变异而获得耐药性,其机制主要有 6种:①作用靶点变异,不应答药物;②外膜通透性改变,阻断药物进入;③细菌产生某种或某些酶,破坏某种或某类结构的抗菌药物,使抗生素失活;④增加生化中间体的生成,与抗生素竞争结合作用靶点;⑤激活外排体系,加速泵出进入菌体内的药物;⑥使激活抗生素活性的酶缺失,使抗生素失活[6]。为控制耐药菌感染,研制抗耐药菌药物采用的策略主要有 4种:①筛选具有新作用机制或新作用靶点、新型化学结构的抗菌药;②在作用机制、耐药机制与构效关系等研究的指导下,修饰现有抗生素与抗菌药的化学结构;③寻找增强与保护抗菌药物性能和探索提高机体防御功能与减少微生物病原性的物质;④探索控制与清除耐药性基因的物质[7]。现将近年来研发的一系列新型药物以及有关抗耐药菌药物研究进展概述如下。
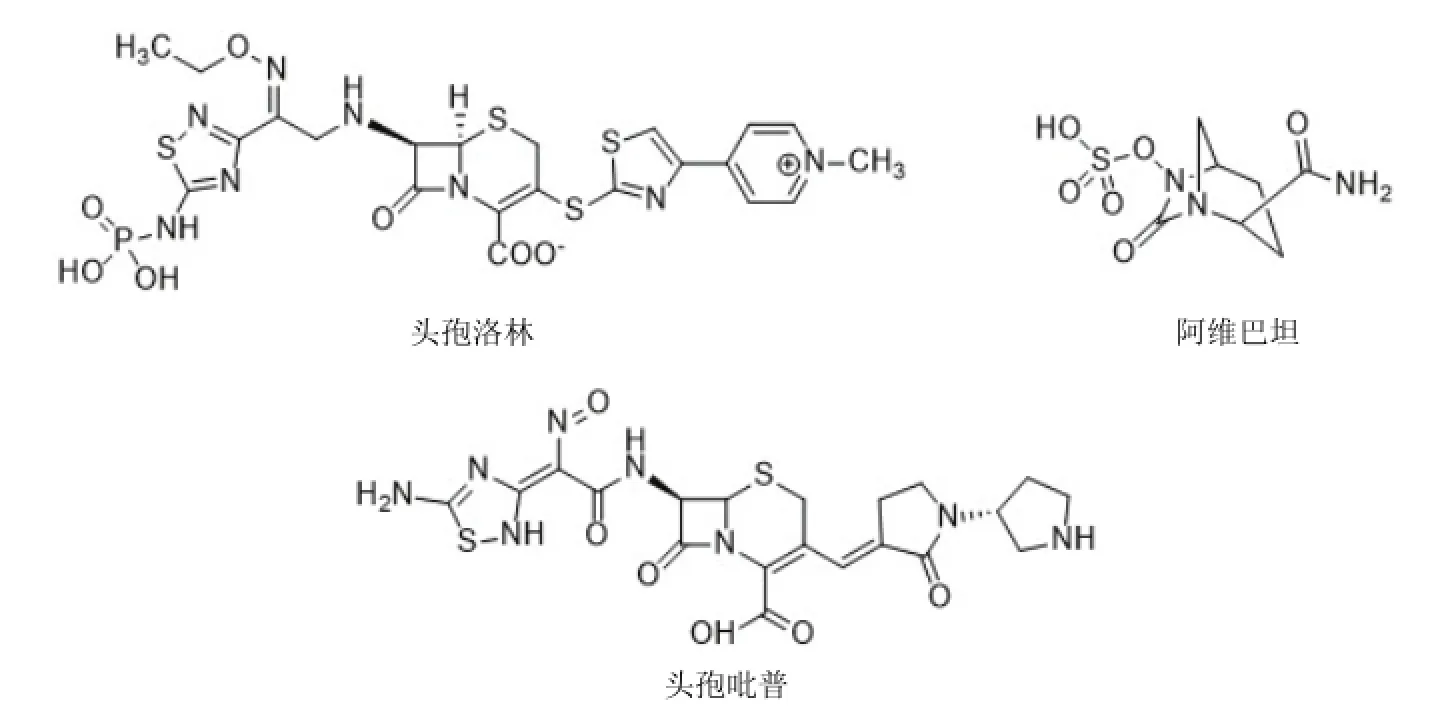
图1 β-内酰胺类抗生素
1 β-内酰胺类抗生素
头孢洛林(teflaro)(图 1)是第五代头孢菌素类抗生素,于 2012年 10月上市,用于治疗社区获得性细菌性肺炎(CABP)、急性细菌性皮肤和皮肤结构感染(ABSSSI),对 MRSA具有明显的活性。III期临床实验证明,头孢洛林对 CABP的活性相当于对照药头孢曲松钠,对复杂皮肤感染的治疗作用跟万古霉素与氨曲南联合用药的治疗作用相当[8]。
头孢吡普(ceftobiprole,BAI 9141)也是第五代头孢菌素类抗生素,对包括 MRSA、甲氧西林敏感金黄色葡萄球菌(MSSA)、耐万古霉素金黄色葡萄球菌(VRSA)、耐甲氧西林表皮葡萄球菌(MRSE)、青霉素敏感的肺炎链球菌(PSSP)、PRSP和氨苄西林敏感肠球菌(ASE)均具有较强的抗菌活性;与青霉素结合蛋白 2a具有极强的结合力,其对 MRSA的最低抑菌浓度(MIC)不受该菌对苯唑西林、头孢西丁或万古霉素敏感或耐药的影响,也不受具有青霉素结合蛋白(SCCmec)的细菌的影响。在治疗社区获得性MRSA的临床前研究中,头孢吡普对该菌的 MIC明显低于万古霉素[9]。
阿维巴坦(avibactam,NXL 104)由 Novexel公司发现,是一类广谱 β-内酰胺酶抑制剂,对 KPC酶家族具有活性。经过联合用药实验发现,头孢他啶和阿维巴坦合用对假单胞菌有效,头孢洛林与阿维巴坦合用具有包括 MRSA在内的较广的抗菌谱[10]。
2 噁唑烷酮类抗生素
利奈唑胺(linezolid)(图 2)是第一个应用于临床的新型噁唑烷酮类抗生素。2000年 4月首次在美国上市,具有良好的药动学特征,对MRSA、MSSA、VRE、VSE、PSSP、PRSP均表现出良好的抗菌作用,对厌氧菌亦具有抗菌活性。临床用于治疗由 MRSA引起的肺炎和综合性皮肤感染,以及由 VRE、PRSP引起的菌血症等[11]。在涉及 5000余名患者的随机对照实验中,利奈唑胺对 MRSA相关的感染在临床治疗方面优于万古霉素[12]。
泰地唑利(tedizolid)是对利奈唑胺修饰后得到的新型噁唑烷酮类化合物,泰地唑利对葡萄球菌、链球菌和肠球菌的 MIC均低于利奈唑胺,甚至对利奈唑胺耐受的菌株也具有活性。在浓度低于 4 μg/ml的情况下,泰地唑利对接近80% 的耐利奈唑胺的菌株表现出抑制作用[13]。泰地唑利对具有氯霉素和氟苯尼考耐受基因的 MRSA菌株仍具有活性[14]。
由辉瑞公司研发的 sutezolid对结核分枝杆菌的活性明显优于利奈唑胺[15],临床研究发现,sutezolid应用于结核病患者具有良好的安全性和耐受性[16]。AZD 5847是阿斯利康公司研制的首个结核病候选药物[17],已经进入 I期临床研究,其生物利用度与剂量成反比[18]。
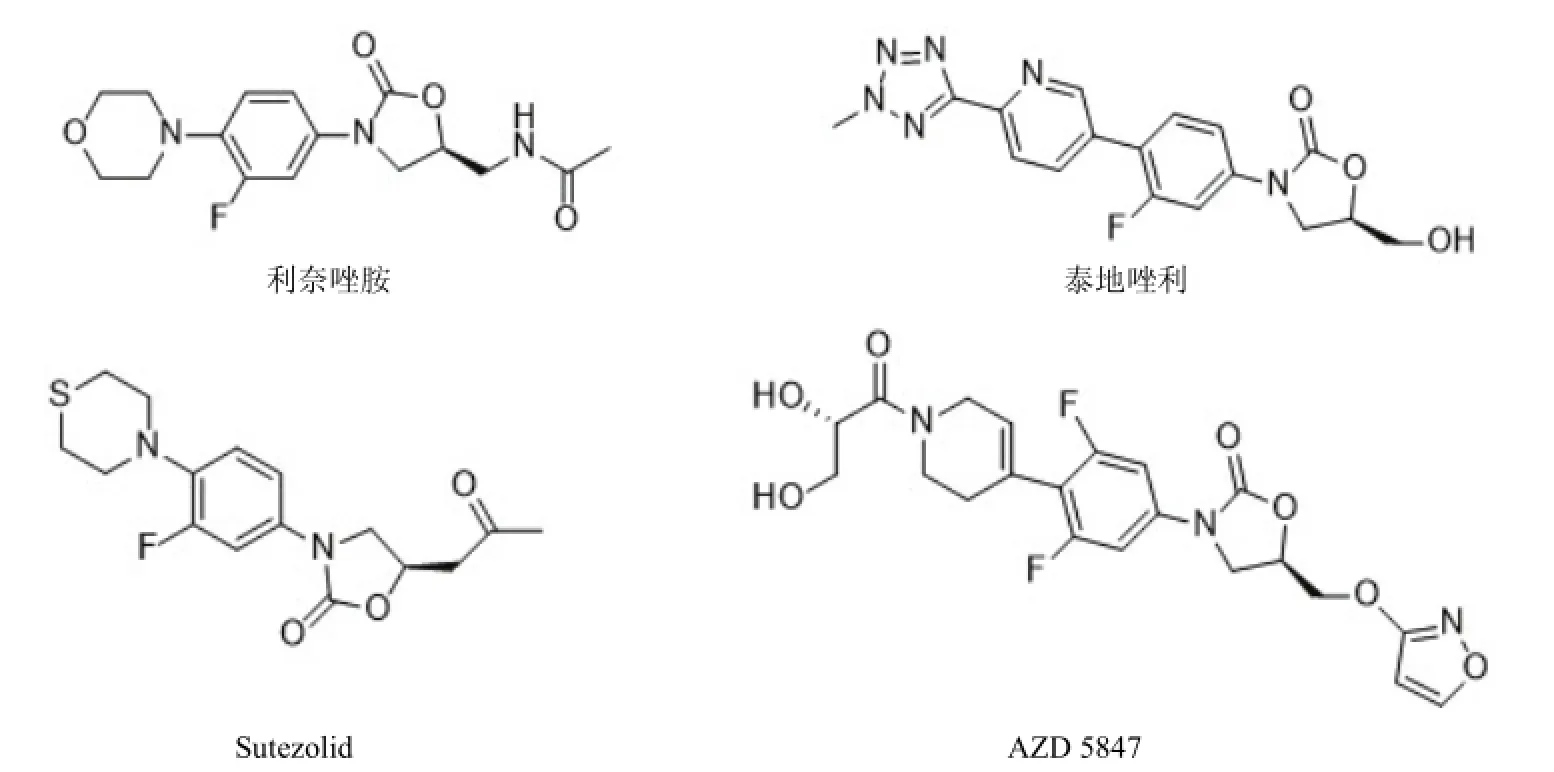
图2 噁唑烷酮类抗生素
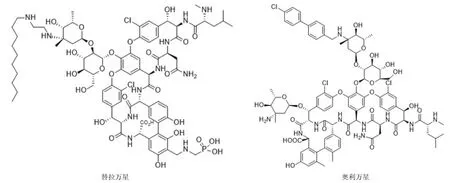
图3 糖肽类抗生素
3 糖肽类抗生素
替拉万星(telavancin)(图 3)是万古霉素的衍生物,用于治疗复杂性皮肤软组织感染,对各种革兰阳性球菌具有抗菌作用,如金黄色葡萄球菌(包括 VRSA)、凝固酶阴性葡萄球菌、肠球菌(包括 VRE)、溶血性链球菌等。替拉万星属于浓度依赖性抗菌药物。试验表明,替拉万星对医院获得性肺炎的治愈率达到 58.9%,与万古霉素相当[19]。
奥利万星(oritavancin)于 2014年 8月经 FDA批准用于治疗革兰阳性菌的皮肤感染,对 VRE和 VRSA具有活性,而且具有半衰期长的特点,体内活性可以持续 24 h[20]。
4 四环素类抗生素
替加环素(tigecycline)(图 4)是一个广谱四环素类抗菌药物,于 2005年 6月批准上市,用于治疗成人复杂皮肤及软组织感染和成人复杂的腹内感染,能够抑制细菌的外排泵作用,破坏细菌对核糖体的保护作用[21-22],克服许多已知四环素耐药性问题。替加环素不仅对 MRSA和 MRSE有活性,对肺炎链球菌也有特殊疗效[23];替加环素还具有适度的抗革兰阴性菌活性,对耐亚胺培南的鲍曼不动杆菌亦具有活性。另有报道称该药对耐万古霉素和利奈唑胺的肠球菌具有一定活性[24]。
奥玛环素(omadacycline)是新一代抗多重耐药菌感染的药物,具有与替加环素相近的抗菌谱,与替加环素不同的是奥玛环素可以口服。TP-434由 Tetraphase Pharmaceuticals公司研制,具有和奥玛环素相似的抗菌作用[25]。
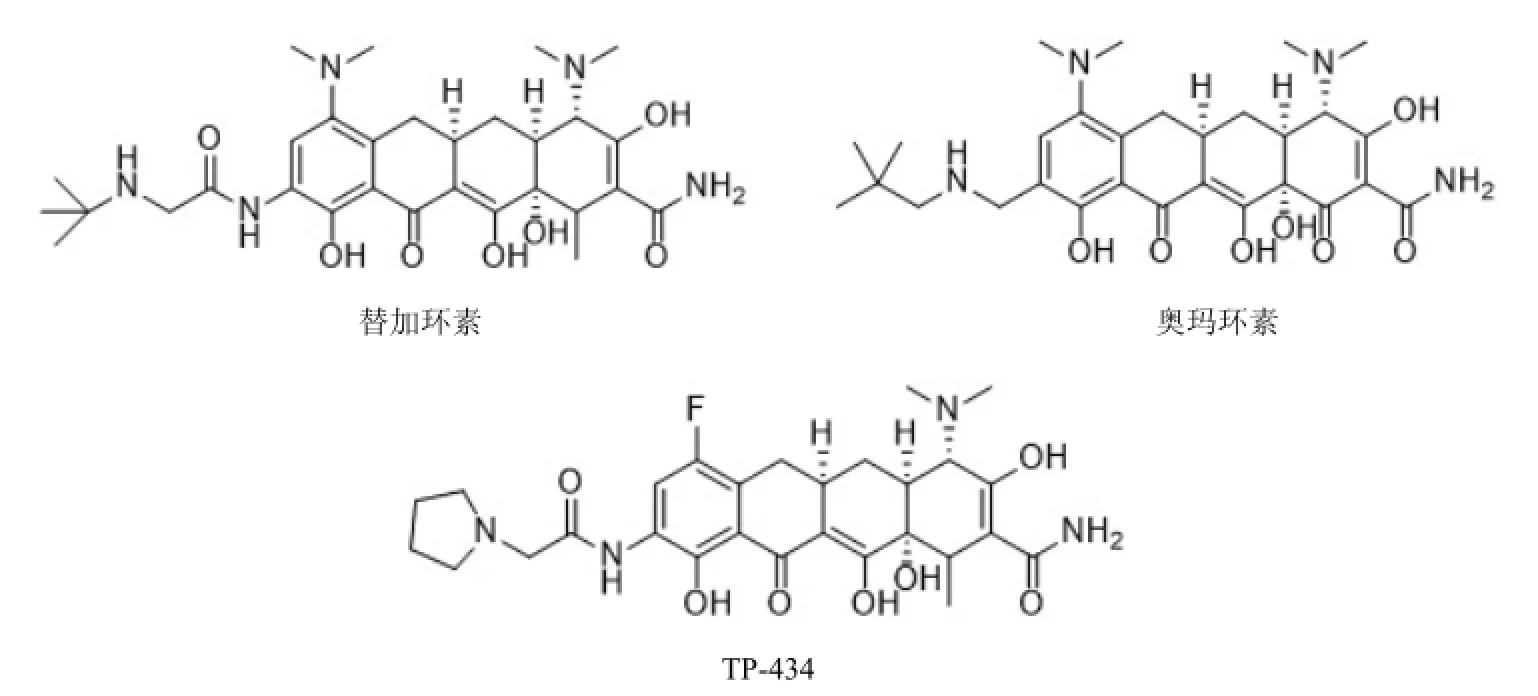
图4 四环素类抗生素
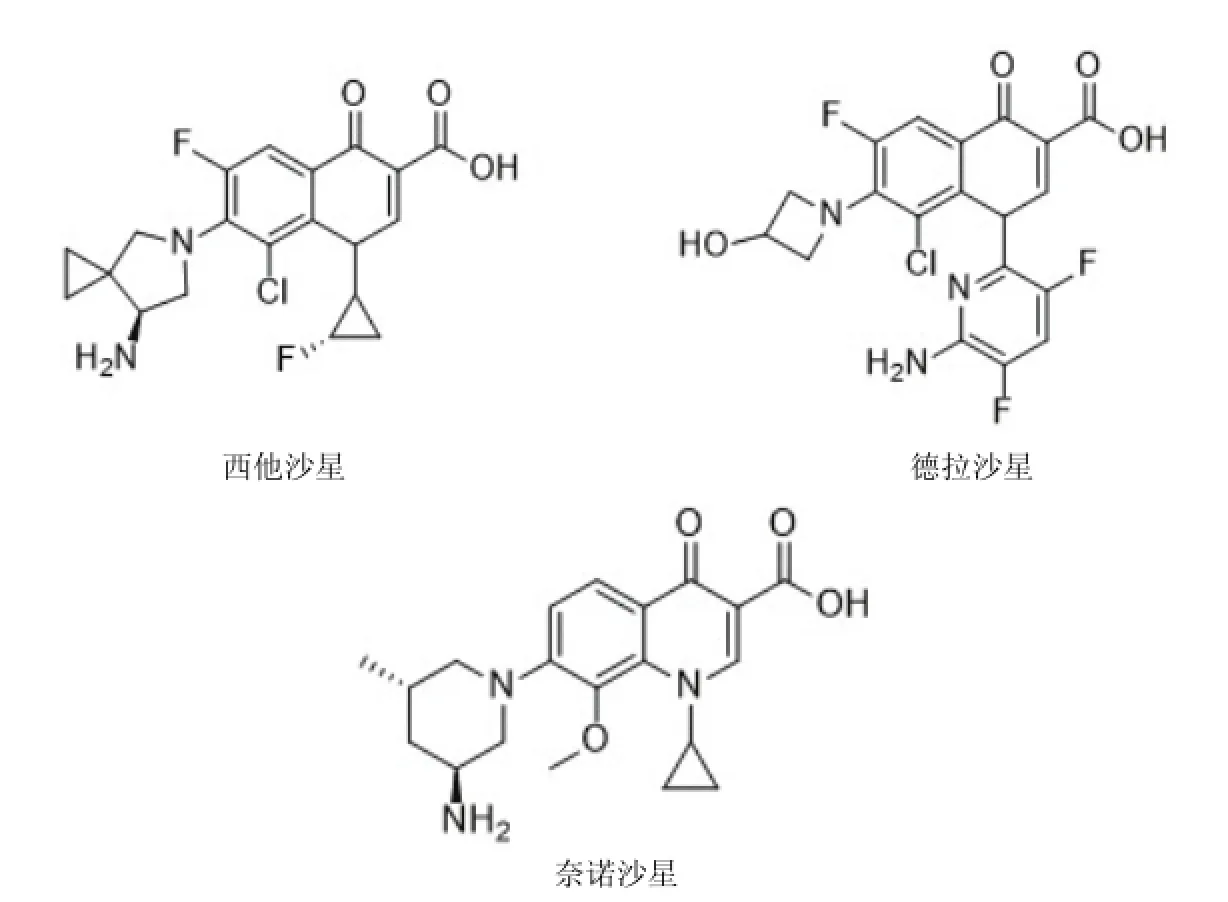
图5 喹诺酮类抗生素
5 喹诺酮类抗生素
西他沙星(sitafloxacin)(图 5)由 Daiichi Sankyo公司开发,于 2008年在日本上市,临床应用其水合物治疗严重难治的感染性疾病,属于超广谱氟喹诺酮类药物。西他沙星对革兰阳性、阴性和厌氧菌都具有抗菌活性,对氟喹诺酮类耐药菌株如 MRSA、PRSP、VRE等也具有抗菌作用;西他沙星的抗厌氧菌作用与亚胺培南、甲硝唑相当[26]。
德拉沙星(delafloxacin)正处于 II期临床研究阶段。德拉沙星对包括 MRSA在内的金黄色葡萄球菌有活性。与其他喹诺酮类化合物相比,德拉沙星在酸性条件下能保持其活性,因此可以在皮肤、泌尿等器官内发挥作用[27];有报道称德拉沙星对 MRSA菌株有活性且不易产生耐药[28]。
奈诺沙星(nemonoxacin)是一类新型广谱的无氟喹诺酮类药物,正处于 III期临床研究阶段,用于治疗社区获得性肺炎,对 MSSA、MSSE、MRSE、肺炎链球菌的活性优于左氧氟沙星,对环丙沙星耐药的 MRSA、左氧氟沙星耐药的葡萄球菌和肺炎链球菌和 VRE表现出强效的抗菌活性[29-30],而且奈诺沙星半衰期较长,每日只需服用一次[31]。
6 酮内酯类抗生素
泰利霉素(telithromycin)(图 6)是半合成大环内酯-林可酰胺-链阳菌素 B(MLSB)家族中的第一个抗菌药物,属酮内酯类抗生素,具有广谱抗菌活性、较低的选择性耐药性和与其他酮类抗生素的交叉耐药性。自从 FDA报道泰利霉素有严重肝损害的不良反应,其应用受到严格限制[32]。
生度米星(semduramicin)具有与泰利霉素类似的抗菌特点,对各种呼吸道感染病原体具有强大抗菌活性,特别是对链球菌抗菌作用突出,0.5 μg/ml可抑制 90%以上的各种肺炎链球菌与化脓性链球菌,对大环内酯耐药菌株和部分耐泰利霉素的链球菌也具有抗菌作用;治疗社区获得性肺炎与慢性支气管炎急性发作的有效率分别为 82%~96%与84%~90%,迄今没有发现严重肝损害作用[33]。
喹红霉素(cethromycin)和 solithromycin是两个正在开发的新型酮内酯类药物,其中喹红霉素被 FDA批准作为治疗炭疽和鼠疫的孤儿药。这两个药物对革兰阳性菌和部分革兰阴性菌有效,在 III期临床试验中对社区获得性肺炎的活性与克拉霉素相当[34],solithromycin的体外活性表明它可能对皮肤、软组织感染和社区获得性肺炎有疗效[35]。
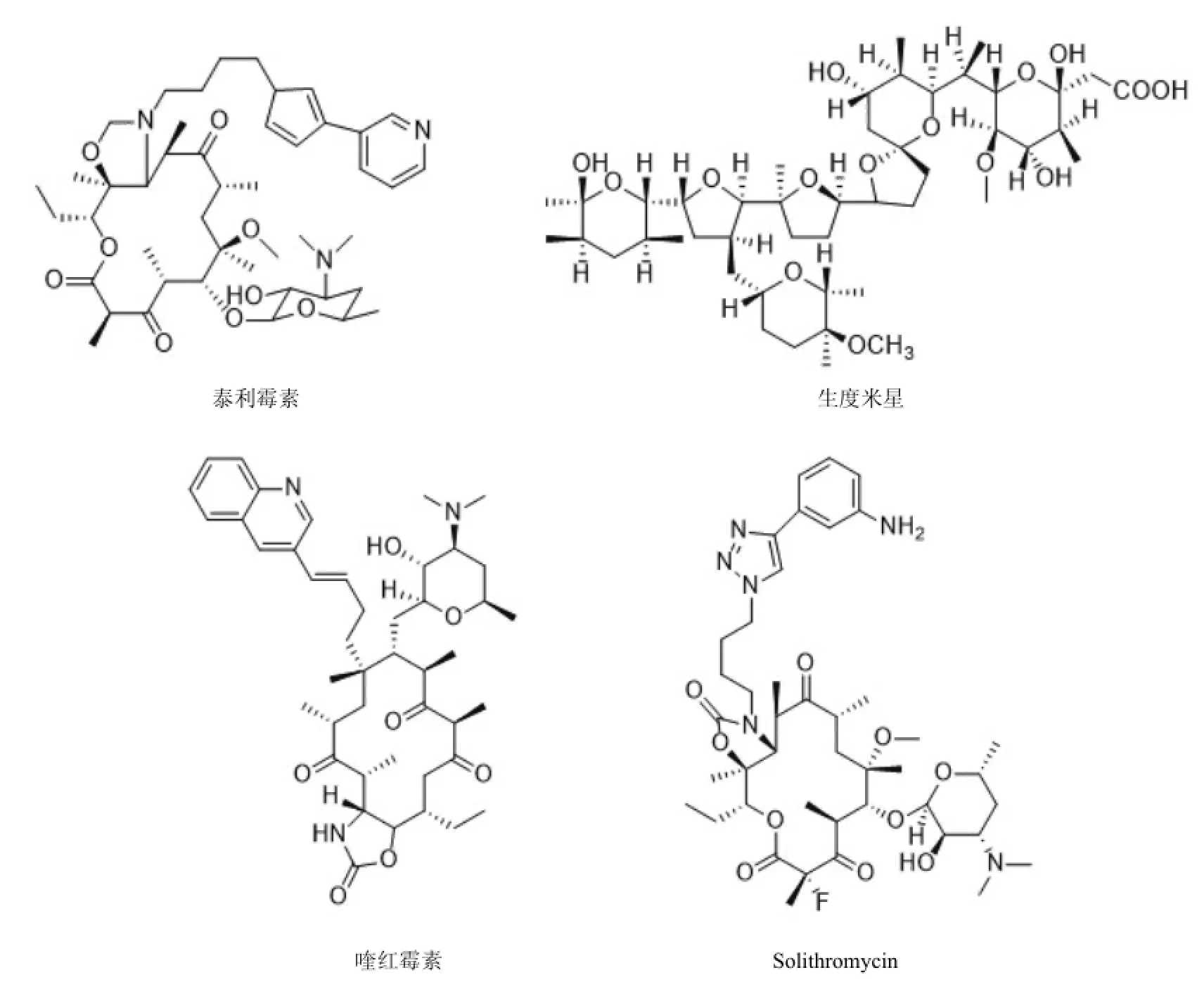
图6 酮内酯类抗生素
7 其他类型的抗菌药物
7.1 外排泵抑制剂
细菌的外排泵可以使药物从细菌内排出,大大降低抗菌药物的治疗效果,其中 RND家族(resistance-nodulationdivision)是抑制细菌外排泵最有希望的靶点之一,这个家族中有 14个靶点已经被确定并即将应用于临床,一些针对该靶点的抑制外排泵的化合物正在被研制,其中 MP 601205[36](图 7)正在进行囊性纤维化患者的 I期临床研究,但由于药物耐受性相关问题并未进一步开发。MC 207110[37]与左氧氟沙星合用能增强对铜绿假单胞菌的治疗效果。通过外排泵抑制剂与抗生素结合来克服细菌的耐药性将是未来抗生素发展的一个重要方向。
7.2 金属纳米颗粒
近来发现,金属纳米颗粒如金、银、氧化镁等具有潜在克服抗生素耐药问题的能力。研究表明金属纳米粒子抗菌作用机制有两个:一是通过影响膜电位的交替来减少细菌内ATP水平或抑制 ATP合成酶的活性;二是通过抑制核糖体tRNA亚基来阻止细菌蛋白质的合成。金属纳米粒子作为抗菌剂治疗耐药菌具有独特的优势:首先,具有较大表面积的金属纳米粒子与细菌接触的方式将会在新的机械、化学、光电学等层面下进行,可以提高与细菌的接触范围,增加抗菌药物的敏感性,降低细菌的耐药性[38];第二,相比于其他药物而言,金属纳米粒子本身不易产生耐药性[39-40]。有实验表明,结合有多克隆抗体的金纳米粒子能有效地杀灭铜绿假单胞菌[41];万古霉素结合的金纳米粒子能成功杀灭鲍曼不动杆菌,以及包括 MASA、VRE在内的耐药细菌[42]。银纳米粒子也对铜绿假单胞菌、氨苄西林耐药的大肠杆菌、红霉素耐药的链球菌具有潜在的活性。然而,金属纳米粒子有潜在的细胞毒积累等缺点,其能否作为抗菌剂用于临床需要进一步研究[43]。
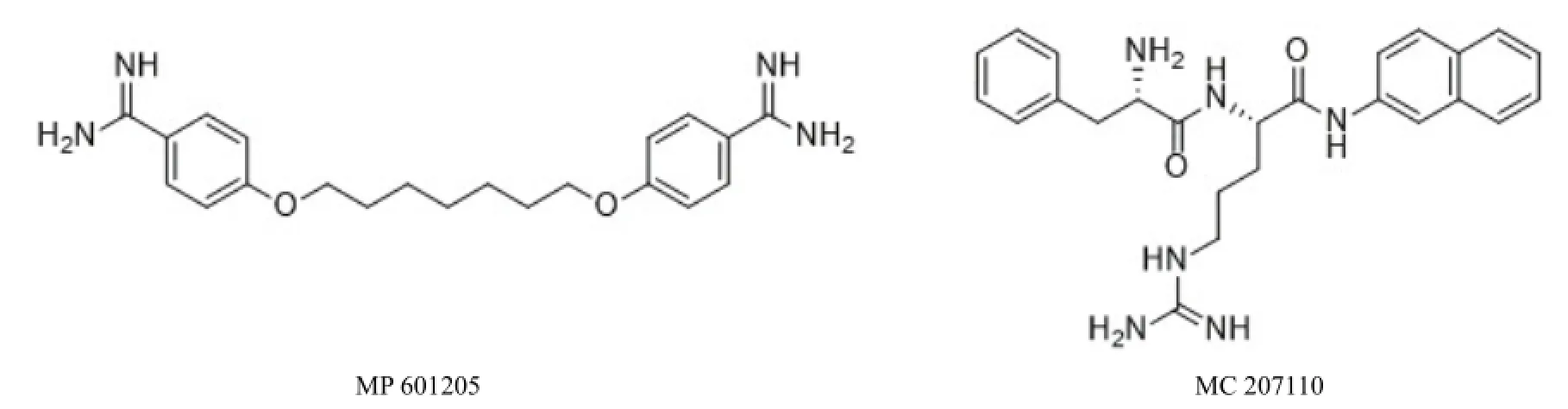
图7 外排泵抑制剂
8 结语
细菌的耐药问题日益严重,人们在抗耐药菌药物的研发过程中,一方面需要根据药物的作用机制及其相关的耐药机制进行抗菌药研发,另一方面还需要研究潜在的细菌耐药机制,开发具有新型结构和新作用机制的新型抗菌药物。随着基础科学的进步、更多筛选模型的建立以及抗微生物新靶位的陆续发现,新药的研发将会取得更大的成果。
[1] Rossolini GM,Arena F,Pecile P,et al.Update on the antibiotic resistance crisis.Curr Opin Pharmacol,2014,18:56-60.
[2] Magiorakos AP,Srinivasan A,Carey RB,et al.Multidrug-resistant,extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance.Clin Microbiol Infect,2012,18(3):268-281.
[3] Willems RJ,Hanage WP,Bessen DE,et al.Population biology of Gram-positive pathogens:high-risk clones for dissemination of antibiotic resistance.FEMS Microbiol Rev,2011,35(5):872-900.
[4] Boucher HW,Talbot GH,Bradley JS,et al.Bad bugs,no drugs:no ESKAPE!An update from the Infectious Diseases Society of America. Clin Infect Dis,2009,48(1):1-12.
[5] World Health Organization.Antimicrobial resistance--Fact sheet N°194.(2014-04) [2014-11-13].http://www.who.int/mediacentre/ factsheets/fs194/en/.
[6] Elufisan TO,Oyedara OO,Oyelade B.Updates on microbial resistance to drugs.Afr J Microbiol Res,2012,6(23):4833-4834.
[7] Zhang ZP.Advances in the research of agents to combat bacterial resistance.Chin JAntibiot,2005,30(7):430-440.(in Chinese)
张致平.抗耐药菌药物研究进展.中国抗生素杂志,2005,30(7): 430-440.
[8] Evans JD, Udeani G,Cole P,et al.Ceftaroline fosamil for the treatment of acute bacterial skin and skin structure infections in obese patients.Postgrad Med,2014,126(5):128-134.
[9] Poon H,Chang MH,Fung HB.Ceftaroline fosamil:a cephalosporin with activity against methicillin-resistant Staphylococcus aureus. ClinTher,2012,34(4):743-765.
[10]MushtaqS,WarnerM,LivermoreDM.Invitroactivityof ceftazidime+NXL104 against Pseudomonas aeruginosa and other non-fermenters.JAntimicrob Chemother,2010,65(11):2376-2381.
[11]Zhang H,Du K,Sang ZP,et al.Synthesis of linezolid.Chin J Pharm,2011,42(4):245-247.(in Chinese)
张慧,杜鲲,桑志培,等.利奈唑胺的合成.中国医药工业杂志,2011,42(4):245-247.
[12]An MM,Shen H,Zhang JD,et al.Linezolid versus vancomycin for meticillin-resistant Staphylococcus aureus infection:a meta-analysis of randomised controlled trials.Int J Antimicrob Agents,2013,41(5):426-433.
[13]Rodríguez-Avial I,Culebras E,Betriu C,et al.In vitro activity of tedizolid(TR-700)against linezolid-resistant staphylococci.J Antimicrob Chemother,2012,67(1):167-169.
[14]Shaw KJ,Poppe S,Schaadt R,et al.In vitro activity of TR-700,the antibacterial moiety of the prodrug TR-701,against linezolid-resistant strains.AntimicrobAgents Chemother,2008,52(12):4442-4447.
[15]Williams KN,Stover CK,Zhu T,et al.Promising antituberculosis activity of the oxazolidinone PNU-100480 relative to that of linezolid in a murine model.Antimicrob Agents Chemother,2009,53(4):1314-1319.
[16]Wallis RS,Dawson R,Friedrich SO,et al.Mycobactericidal activity of sutezolid(PNU-100480)in sputum(EBA)and blood(WBA)of patients with pulmonary tuberculosis.PLoS One,2014,9(4):e94462.
[17]Sutcliffe JA.Antibiotics in development targeting protein synthesis. Ann N YAcad Sci,2011,1241:122-152.
[18]Shaw KJ,Barbachyn MR.The oxazolidinones:past,present,and future.Ann N YAcad Sci,2011,1241:48-70.
[19]Rubinstein E,Lalani T,CoreyGR,etal.Telavancin versus vancomycin for hospital-acquired pneumonia due to gram-positive pathogens.Clin Infect Dis,2011,52(1):31-40.
[20]Zhanel GG,Schweizer F,Karlowsky JA.Oritavancin:mechanism of action.Clin Infect Dis,2012,54 Suppl 3:S214-S219.
[21]Noskin GA.Tigecycline:a new glycylcycline for treatment of serious infections.Clin Infect Dis,2005,41(5):303-314.
[22]Petersen PJ,Jacobus NV,Weiss WJ,et al.In vitro and in vivo antibacterial activities of a novel glycylcycline, the 9-t-butylglycylamido derivative of minocycline (GAR-936). AntimicrobAgents Chemother,1999,43(4):738-744.
[23]Sun HL,Wang H,Chen MJ,et al.An antimicrobial resistance surveillance of gram-positive cocci isolated from 12 teaching hospitals in China in 2009.Chin J Intern Med,2010,49(9):735-740.(in Chinese)
孙宏莉,王辉,陈民钧,等.2009年中国12家教学医院革兰阳性球菌耐药性研究.中华内科杂志,2010,49(9):735-740.
[24]Sader HS,FlammRK,Jones RN.Tigecycline activity tested against antimicrobialresistantsurveillance subsetsofclinicalbacteria collected worldwide(2011).Diagn Microbiol Infect Dis,2013,76(2): 217-221.
[25]Bush K.Improving known classes of antibiotics:an optimistic approach for the future.Curr Opin Pharmacol,2012,12(5):527-534.
[26]Anderson DL.Sitafloxacin hydrate for bacterial infections.Drugs Today(Barc),2008,44(7):489-501.
[27]Lemaire S,Tulkens PM,Van Bambeke F.Contrasting effects of acidic pH on the extracellular and intracellular activities of the anti-gram-positive fluoroquinolones moxifloxacin and delafloxacin against Staphylococcus aureus.Antimicrob Agents Chemother,2011,55(2):649-658.
[28]Remy JM,Tow-Keogh CA,Mc-Connell TS,et al.Activity of delafloxacin againstmethicillin-resistantStaphylococcusaureus: resistance selection and characterization.J Antimicrob Chemother,2012,67(12):2814-2820.
[29]Lauderdale TL,Shiau YR,Lai JF,et al.Comparative in vitro activities of nemonoxacin(TG-873870),a novel nonfluorinated quinolone,and otherquinolones againstclinicalisolates.Antimicrob Agents Chemother,2010,54(3):1338-1342.
[30]Li CR,Li Y,Li GQ,et al.In vivo antibacterial activity of nemonoxacin,a novel non-fluorinated quinolone.J Antimicrob Chemother,2010,65(11):2411-2415.
[31]Van Rensburg DJ,Perng RP,Mitha IH,et al.Efficacy and safety of nemonoxacin versus levofloxacin for community-acquired pneumonia. AntimicrobAgents Chemother,2010,54(10):4098-4106.
[32]Xiao YH.Progress in the research and development of new antibacterial agents.China Licensed Pharm,2011,8(6):9-15.(in Chinese)
肖永红.新型抗菌药物研究进展.中国执业药师,2011,8(6):9-15.
[33]Hammerschlag MR,Sharma R.Use of cethromycin,a new ketolide, for treatment of community-acquired respiratory infections.Expert Opin Investig Drugs,2008,17(3):387-400.
[34]English ML,Fredericks CE,Milanesio NA,et al.Cethromycin versus clarithromycin forcommunity-acquired pneumonia:comparative efficacy and safety outcomes from two double-blinded,randomized,parallel-group,multicenter,multinationalnoninferiority studies. AntimicrobAgents Chemother,2012,56(4):2037-2047.
[35]Farrell DJ,Castanheira M,Sader HS,et al.The in vitro evaluation of solithromycin(CEM-101)against pathogens isolated in the United States and Europe(2009).J Infect,2010,61(6):476-483.
[36]Lomovskaya O,Zgurskaya HI,Totrov M,et al.Waltzing transporters and'the dance macabre'between humans and bacteria.Nat Rev Drug Discov,2007,6(1):56-65.
[37]Thorarensen A, Presley-Bodnar AL, Marotti KR, et al. 3-Arylpiperidines as potentiators of existing antibacterial agents. Bioorg Med Chem Lett,2001,11(14):1903-1906.
[38]Whitesides GM.Nanoscience,nanotechnology,and chemistry.Small,2005,1(2):172-179.
[39]Xu H,Qu F,Xu H,et al.Role of reactive oxygen species in the antibacterial mechanism of silver nanoparticles on Escherichia coli O157:H7.Biometals,2012,25(1):45-53.
[40]Chopra I.The increasing use of silver-based products as antimicrobial agents:a useful development or a cause for concern?J Antimicrob Chemother,2007,59(4):587-590.
[41]Norman RS,Stone JW,Gole A,et al.Targeted photothermal lysis of the pathogenic bacteria,Pseudomonas aeruginosa,with gold nanorods. Nano Lett,2008,8(1):302-306.
[42]Huang WC,Tsai PJ,Chen YC.Functional gold nanoparticles as photothermal agents for selective-killing of pathogenic bacteria. Nanomedicine(Lond),2007,2(6):777-787.
[43]Chen YS,Hung YC,Liau I,et al.Assessment of the in vivo toxicity of gold nanoparticles.Nanoscale Res Lett,2009,4(8):858-864.
10.3969/cmba.j.issn.1673-713X.2015.02.013
国家自然科学基金(81373268)
100050北京,中国医学科学院北京协和医学院医药生物技术研究所合成室
刘宗英,Email:zongyingliu@263.net;李卓荣, Email:l-z-r@263.net
2014-11-13

