檀香形成部位内生真菌多样性研究
孙思胜,张大为,孟志霞,郭顺星
檀香形成部位内生真菌多样性研究
孙思胜,张大为,孟志霞,郭顺星
目的 旨在考查檀香形成部位内生真菌的定植情况,并探讨檀香结香部位木材和正常生长的健康木材之间内生真菌的差异,揭示真菌诱导檀香结香的原因。
方法 采用组织块分离法对檀香结香部位木材和正常生长的健康木材进行内生真菌的分离培养和统计分析,并采用形态学和分子生物学两种方法对分离得到的真菌进行鉴定。
结果 檀香结香部位木材内生真菌定植率较高(92.5%),而正常木材内生真菌定植率较低(27.5%)。分离率也是檀香结香部位木材较高(0.9),健康正常木材较低(0.25)。檀香正常生长的健康白木材分离的内生真菌只有 2种;结香部位木材分离得到 13种,隶属于 4个属,分别为拟茎点霉属、镰孢属、曲霉属和 Phaeoacremonium。在檀香结香部位分离的内生真菌中,优势菌属是镰孢属和拟茎点霉属;在檀香健康木材分离的优势菌属是拟茎点霉属。
结论 檀香结香部位木材内生真菌表现出了较高的种属多样性。檀香局部结香可能是由外界损伤和真菌的侵染诱导而形成的。
檀香; 内生真菌; 结香部位木材; 健康正常木材
檀香(Santalum album Linn.)是檀香科(Santalaceae)檀香属(Santalum)的一种常绿半寄生小乔木,原产于印度、印度尼西亚、澳大利亚、马来西亚以及太平洋上的一些岛屿,我国于 1962年开始在广东进行引种栽培,经过多年的种植推广,目前已在广东、云南、福建等南方各省成功引种栽培,但是较大规模种植的仅限于广东地区。由于种植年限较短,迄今为止尚未形成商品药材,因而国内药用的中药檀香均为进口商品。檀香在我国已有一千多年的使用历史[1-7],它是一种集药用、香料、佛教用品、精细工艺雕刻材料于一体的重要经济树种,素有“绿色黄金”之称[1,3]。中药檀香(Santali Albi Lignum)为檀香的芳香心材,供药用需 30~40年,性温味辛;归脾、胃、心、肺经;具有行气温中,开胃止痛之功效[8]。
檀香在自然状态下需要 10年以上才开始形成有芳香气味的心材(俗称“结香”)[2],并且不同种植地区,其结香的时间也不相同。人们在檀香的种植生产实践过程中,常发现某些檀香植株由于被一些微生物侵染后形成局部心材(结香);此外人们在檀香树栽培过程中发现,经过机械损伤或因土壤排水不良引起烂根或在咖啡木蠹蛾(Zeuzera coffeae)蛀入树干的虫道,可以引起局部结香[9]。刘小金[10]利用四种外源真菌接种于未结香的幼龄檀香树干,发现这四种真菌均可以诱导心材形成且均使心材 α-檀香醇含量升高。从这些现象分析,檀香的局部结香可能与微生物的侵染有关。
植物内生真菌是指那些全部或部分生活史在健康植物的各种组织或细胞内部度过的真菌,它们的存在不引起宿主感染明显的症状,但是它们可以通过组织学方法或严格表面消毒的方法从植物组织中分离或从植物组织内部扩增出微生物 DNA的方法来证明其内生性[11-13]。一些研究人员从植物中已分离获得了许多可产生与宿主相似或相同的生物活性代谢产物的内生真菌,这类真菌将成为寻找抗癌新药及其他活性物质的重要来源[14-15]。
本试验首次对檀香结香部位木材和正常生长的健康白木材进行了内生真菌的分离培养及分子鉴定,分析檀香局部结香的形成与真菌的关系,获得的菌株为未来真菌诱导檀香结香的研究以及其他生物活性物质的发现奠定了基础,同时初步探明了内生真菌在这两种不同檀香木材中的分布差异。
1 材料与方法
1.1 材料
2011年 7月中旬,檀香结香部位木材和正常生长的健康白木材均采集于广东省揭阳市绿世纪南药种植有限公司的檀香林(东经 115°59′,北纬23°19′),海拔 60 m。首先是寻找檀香局部结香的部位(10年生檀香树的机械损伤位置),进行样品的采集;然后随机选取 3株正常生长的健康 7~8年生檀香,对其茎干进行样品的采集;将样品置于低温(4℃)的样品盒中,在 24 h之内进行内生真菌的分离。檀香局部结香木材和正常生长的茎干木材见图1。

图1 檀香树(A)及檀香局部结香木材(B)和正常生长的茎干木材(C)Figure 1 The tree of Santalum album(A),sandalwood(B)and normal white healthy wood(C)
1.2 方法
1.2.1 培养基制备 土豆培养基(PDA)配方:将去皮土豆 200 g、葡萄糖 20 g和琼脂 12 g用去离子水定容至 1000 ml,pH自然;122℃ 灭菌22 min。孟加拉红培养基配方:将孟加拉红 35 g用去离子水定容至 1000 ml,pH自然。122℃ 灭菌22 min。
1.2.2 檀香内生真菌的分离培养 采用组织块分离法[16]。将采集到的檀香结香部位木材和正常木材在自来水下冲洗干净,晾干后分别切成 0.5 cm× 0.5 cm×0.5 cm大小的组织块,在无菌条件下,浸入 75%乙醇中漂洗 30~60 s,然后再放入 3%的次氯酸溶液中浸泡 8~12 min,无菌水冲洗 4次,再用无菌滤纸吸干水分。然后在无菌条件下,将表面消毒后的样品切成 0.2 cm×0.2 cm×0.2 cm 大小的组织块,从檀香结香部位木材和正常木材中各随机选取 40个组织块用于檀香茎内生真菌的分离。将组织块置于改良的 PDA培养基和孟加拉红培养基上,每个平皿接种 4个组织块。将上述样品置于 25℃ 恒温培养 2个月,定期观察内生真菌菌落形成情况,当丝状真菌菌落直径长至 1 cm左右时,即可挑取其菌落边缘部位,接种到新的PDA平板上,反复接种至单菌落时,根据菌株的菌落特征,进行菌株合并,得到菌落特性不同的真菌菌株。菌株用 PDA试管斜面保藏和 10%甘油管妥善保藏;其中 PDA试管放 4℃ 冰箱保藏,10% 甘油管放于 –80℃ 超低温冰箱保存。
1.2.3 内生真菌的鉴定 对分离的真菌进行编号之后,采用形态学和分子生物学两种方法对它们进行鉴定;先根据形态和显微特征以及产孢结构对能够产孢的菌株进行鉴定;再对不能产孢的菌株初步归为不产孢类群,然后利用分子生物学技术对其进行鉴定。
1.2.3.1 形态学特征鉴定:将已经纯化好的真菌接种于 PDA平板上,观察记录菌落形态,生长特性,结合显微结构中的孢子形态、大小和产孢结构等对其进行经典的形态鉴定[17-19],同时,通过对相关文献的收集和查阅,最终鉴定出其种属。
1.2.3.2 分子生物学手段鉴定:将分离获得的真菌进行纯培养,提取核糖体 rDNA,对转录间隔区(ITS1-5.8S-ITS2)进行扩增,将扩增后获得的DNA片段中 500~750 bp的序列与 GenBank (http://ncbi.nim.nih.gov)中的数据对比,确定其种属类别。
主要操作步骤:
⑴将用于分子鉴定的真菌接种到 PDA培养基上,25℃ 恒温暗培养 1~3周后待真菌菌落的直径6 cm左右,就可以满足提取 DNA所需要的1 g左右重量的菌丝。
真菌核糖体 DNA参照真菌 DNA提取试剂盒的使用说明进行提取。
⑵PCR扩增 DNA提取后,通过设计的引物对特定区段进行 PCR扩增,从而使目的片段的浓度得以提高。PCR扩增反应在 Eppendorf Mastercycler梯度 PCR仪上进行。本研究所用的引物是真菌通用引物 ITS1和 ITS4,具体序列、反应体系以及反应条件如下:ITS1:5'TCCGTAGGT GAACCTGCGG 3';ITS4:5'TCCTCCGCTTATTGA TATGC 3'。25 μl PCR扩增反应体系:Mix 12.5 μl,ddH2O 9.5 μl,引物各 1 μl,模板 1 μl,总体积 25 μl。PCR反应条件:94℃ 预变性 3 min;94℃ 变性30 s;55℃ 退火 30 s;72℃ 延伸 2 min;32个循环,之后再 72℃ 延伸 5 min,4℃ 保存。
DNA序列由苏州金唯智生物科技有限公司进行双向测序,正反引物分别是 ITS1和 ITS4,得到 ITS(ITS1-5.8S-ITS4)序列,提交到 GenBank,得到序列号 KC981090-KC981109。运用 BLASTN程序在 NCBI(http://www.ncbi.nlm.nih.gov)中进行相似性查询,获得与其同源性最高的序列信息,进而获得试验菌株的鉴定信息。但是,在 GenBank数据库中选择同源性序列时,需要注意的是,目前GenBank数据库中不少序列的注释是不正确的;一般而言,已出版在权威专业杂志如 Mycotaxon、Studies in Mycology、Mycological Progress、Fungal Diversity和 Fungal Biology等,或者国际上一些比较著名的菌种保藏机构(CBS、ATCC、AFTOL等)的序列可信度较高。序列比对后,如果目标序列和参考序列有 95%以上的同源性,就暂定到参考序列所在的属,如果 ≥99% 的相似性就暂定到种[20]。
1.3 数据统计分析
内生真菌在每种植物组织中的丰度,采用定植率(colonization rate,CR)、分离率(isolation rate,IR)和相对频率(relative frequency,RF)等指标[21-22]运用 Microsoft Excel 2003和 SASS 8.0软件进行统计分析。

定植率能够反映出不同植物或同一植物的不同器官受内生真菌的侵染程度,表示的是百分数;分离率可以衡量植物组织中内生真菌的丰富程度和每个组织块受多重侵染的频率,不表示百分数。相对频率是指样本中分离到的某种内生真菌的菌株数占分离到的总菌株数的百分数。
2 结果
2.1 檀香结香部位木材和正常木材内生真菌的定植率和分离率
从檀香植物结香部位木材和正常木材的 80个表面消毒的组织块中共分离获得 46株内生真菌菌株;其中从檀香结香部位分离获得 36株,正常木材分离获得 10株。檀香结香部位木材和正常木材内生真菌的定植率和分离率见表 1。
由表 1可以看出,檀香结香部位木材内生真菌定植率较高(92.5%),而正常木材内生真菌定植率较低(27.5%)。分离率也是檀香结香部位木材较高(0.90),檀香健康正常木材较低(0.25)。可见,檀香结香部位的木材易于受到真菌的侵染,而健康的正常树干木材不易受到真菌的侵染而定植。
2.2 正常茎干木材和结香木材中内生真菌的组成和分布
通过对 2011年 7月份采集的檀香健康生长的正常茎干木材和结香木材内生真菌进行严格的无菌分离培养,共得到 46株真菌菌株。通过形态鉴定和分子生物学手段分别对这些真菌进行了鉴定,两种方法的结果大部分是一致的,少数不一致的真菌,经过查阅文献[17-19],进一步分析鉴定,最终确定它们的属或种;最后再对相同菌株进行合并,共得到 13种真菌。从表 2可以看出,檀香正常生长的健康茎干白木材中分离得到的内生真菌只有 2种,分别隶属于拟茎点霉属(Phomopsis)和镰孢属(Fusarium),且内生真菌分离率较低;结香部位木材分离得到 13种,隶属于 4个属,分别为拟茎点霉属、镰孢属、曲霉属(Aspergillus)、Phaeoacremonium;檀香结香部位木材内生真菌表现出了较高的种属多样性。在檀香结香部位木材分离的内生真菌中,优势菌属是镰孢属和拟茎点霉属;而在檀香正常生长的健康白木材分离的内生真菌中,优势菌属是拟茎点霉属。
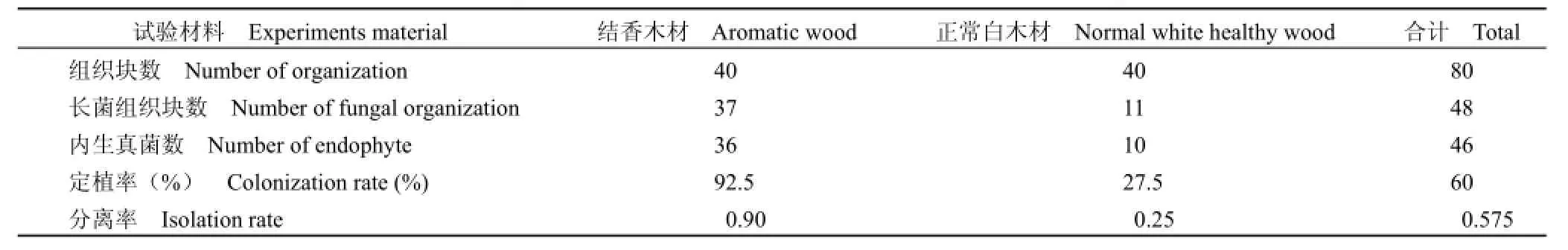
表1 檀香结香部位木材和正常木材内生真菌的定植率和分离率Table 1 Endophyte colonization rate and isolation rate in the two types wood

表2 檀香正常木材和结香部位木材内生真菌的鉴定结果和分布频率Table 2 Identification and distribution frequency of endophytic fungi in the two types wood of Santalum album
3 讨论
从檀香结香部位木材和正常生长的健康茎干白木材样品中总共分离到 46株真菌,其中从檀香结香部位分离获得 36株,正常木材分离获得10株。在同等条件下,经过严格的合并程序和形态学以及分子生物学鉴定,最终确定从正常木材分离的 10株真菌分属于拟茎点霉属和镰孢属;从结香部位木材分离的 36株真菌分布于 4个属,且内生真菌定植率和分布率较高;此外,这两种类型的木材的内生真菌共有菌属是拟茎点霉属和镰孢属;这说明此两属内生真菌在檀香植物茎干部位中分布较广。檀香结香部位木材分布真菌较多,可能是由于外界真菌的入侵并定植导致的;而正常生长的健康茎干木材由于外面有树皮保护和自身木质较好,树干硬度较大,导致真菌定植较少。根据内生真菌的相关理论[11-13],这里的真菌是不是内生真菌还不能下结论。因为檀香结香部位一般都是机械
损伤或虫咬的部位,这里的真菌很可能是来源于檀香树干受伤以后,外界环境中的真菌通过伤口入侵并定植;也可能是由于檀香茎干内生真菌由于外界环境的改变(湿度加大等)而导致的迅速生长繁殖,也可能两种现象同时存在。根据目前这两种类型的木材分离得到的内生真菌情况来看,由于内生真菌的种属专一性和环境差异性,应该是两种情况都存在。总体看来,檀香健康茎干部位的内生真菌与环境中真菌通过伤口侵染茎干木材,然后形成特殊的真菌群落,进而诱导檀香局部心材的形成(结香),因而本研究为内生真菌诱导檀香木形成檀香奠定了一定的基础。
[1] The Editing Committee of Flora of China Editing Committee.Flora of China--Vol 24.Beijing:Science Press,1988:24-57.(in Chinese)
中国植物志编辑委员会.中国植物志--第24卷.北京:科学出版社,1988:24-57.
[2] Rai SN.Status and cultivation of sandalwood in India//Hamilton L,Conrad CE.Proceedings of the symposium on Sandalwood in the pacific.Honolulu,Hawaii:US Forestry Service General Technical Paper PSW-122:66-71,1990:9-11.
[3] Li YL.The introduction study of Santalum album Linn.Beijing: Science Press,2003.(in Chinese)
李应兰.檀香引种研究.北京:科学出版社,2003.
[4] Yan RL,Lin L.Advancement of Santalum album.Traditional Chin Drug Res Clin Pharmacol,2003,3(14):218-220.(in Chinese)
颜仁梁,林励.檀香的研究进展.中药新药与临床药理,2003,3(14):218-220.
[5] Zhang NN,Xu DP,Wang WW,et al.Status and prospects of Santalum album Linn cultivation.Pract Forestry Technol,2006(10):14-16.(in Chinese)
张宁南,徐大平,王卫文,等.檀香栽培现状与发展前景.林业实用技术,2006(10):14-16.
[6] Liu XJ,Xu DP,Zhang NN,et al.Effects of pot host confiuration on the growth of Indian sandalwood(Santalum album)seedlings in south China.Forest Res,2010,23(6):924-927.(in Chinese)
刘小金,徐大平,张宁南,等.苗期寄主配置对印度檀香幼苗生长影响的研究.林业科学研究,2010,23(6):924-927.
[7] Liu XJ,Xu DP,Yang ZJ,et al.Evaluation of growth and heartwood formation of young sandal plantations in Guangdong province,South China.Scientia Silvae Sinicae,2012,48(5):108-115.(in Chinese)
刘小金,徐大平,杨曾奖,等.广东三地幼龄檀香生长和结香的早期评价.林业科学,2012,48(5):108-115.
[8] Chinese Pharmacopoeia Commission.Pharmacopoeia of the People’s Republic of China.Volume 1,2010.Beijing:China Medical Science Press,2010:357-358.(in Chinese)
国家药典委员会.中华人民共和国药典.2010年版一部.北京:中国医药科技出版社,2010:357-358.
[9] Li YL,Chen FL.Studies on forcing heartwood formation in Santalum album.J Trop Subtropical Botany,1994,2(3):39-45.(in Chinese)
李应兰,陈福莲.人工促成檀香结香的研究.热带亚热带植物学报,1994,2(3):39-45.
[10]Liu XJ.Studies on essential oil composition,distribution and inducing heartwood formation of sandal(Santalum album).Beijing:Chinese academy of forestry,2012:160-180.(in Chinese)
刘小金.檀香精油成分组成、分布及人工促成心材形成的研究.北京:中国林业科学研究院,2012:160-180.
[11]Stone JK,Bacon CW,White JF Jr.An verview of endophytic microbes: endophytism defined.New York:Marcel Dekker,2000:3-29.
[12]Sturz AV,Christie BR,Nowak J.Bacterial endophytes:potential role in developing sustainable systems of crop production.Crit Reviews Plant Sci,2000,19(1):1-30.
[13]Herre EA,Mejia LC,Kyllo DA,et al.Ecological implications of anti-athogen effects of tropical fungal endophytes and mycorrhizae. Ecology,2007,88(3):550-558.
[14]Mohali S,Burgess TI,Wingfield MJ.Diversity and host association of the tropical tree endophyte Lasiodiplodia theobromae revealed using simple sequence repeat markers.Forest Pathol,2005,35(6):385-396.
[15]Wei JG,Xu T.Biodiversity of endophytic fungi Pestalotiopsis. Biodiversity Sci,2003,11(2):162-168.(in Chinese)
韦继光,徐同.植物内生拟盘多毛孢的生物多样性.生物多样性,2003,11(2):162-168.
[16]Tan XM,Chen XM,Wang CL,et al.Isolation and identification of endophytic fungi in roots of nine Holcoglossum plants(Orchidaceae)collected from Yunnan,Guangxi,and Hainan provinces of China.Curr Microbiol,2012,64(2):140-147.
[17]Sutton BC.The Coelomycetes.Fungi imperfecti with pycnidia acervuliandstromata.Kew,Surrey,England:Commonwealth Mycological Institute,1980.
[18]Hanlin RT.Illustrated genera of ascomycetes,vol I and II.St.Paul: TheAmerican Phytopathology Society,1998.
[19]Kier E,MoreletM.The deuteromycetes mitosporic fungi classification and generic keys.Enfield,New Hampshire,America: Science Publishers Inc,1999.
[20]Suárez JP,Weiß M,Abele A,et al.Members of Sebacinales subgroup B form mycorrhizae with epiphytic orchids in a neotropical mountain rain forest.Mycol Prog,2008,7(2):75-85.
[21]Taylor JE,Hyde KD,Jones EBG.Endophytic fungi associated with the temperate palm,Trachycarpus fortunei,within and outside its natural geographic range.New Phytologist,1999,142(2):335-346.
[22]Li WC,Zhou J,Guo SY,et al.Endophytic fungi associated with lichens in Baihua mountain of Beijing,China.Fungal Divers,2007,25:69-80.
Methods Tissue block method was used to isolate and statistically analyze the endophytic fungi,which were then identified by morphology and molecular biology methods.
Results The colonization rate of endophytic fungi in sandalwood(92.5%)was higher than that in normal white healthy wood (27.5%).Two fungal strains were recovered from normal white healthy wood,which belonged to two genus respectively.13 fungal stains were isolated from sandalwood,which belonged to four genus,Phomopsis,Fusarium,Aspergillus and Phaeoacremonium.
Conclusion There are diverse endophytic fungi in sandalwood.The most frequently isolated genera are Fusarium and Phomopsisin the sandalwood.While,the most frequently isolated genera is Phomopsis in the normal white healthy wood.External damaging and fungi inducing maybe due to portion sandalwood formation.
Diversity of Endophytic Fungi in sandalwood forming section of Santalum album
SUN Si-sheng,ZHANG Da-wei,MENG Zhi-xia,GUO Shun-xing
Objective To investigate endophytic fungi colonization in sandalwood of Santalum album and the differences in endophytic fungi between sandalwood and normal white healthy wood,which may reveal the cause of sandalwood formation induced by fungi.
SANTALUMALBUM;Endophytic Fungi;Sandalwood;Normal white healthy wood
GUO Shun-xing,Email:sxguo1986@163.com
10.3969/cmba.j.issn.1673-713X.2015.02.005
国家自然科学基金(31170016)
100193北京,中国医学科学院北京协和医学院药用植物研究所生物技术中心(孙思胜、张大为、孟志霞、郭顺星);461000河南省许昌市,许昌学院食品与生物工程学院/河南省博士后研发基地(孙思胜)
郭顺星,Email:sxguo1986@163.com
2014-09-30
www.cmbp.net.cn 中国医药生物技术,2015,10(2):119-124
Author Affiliations:Biotechnology Research Center,Institute of Medicinal Plant Development,Chinese Academy of Medical Sciences&Peking Union Medical College,Beijing 100193,China(SUN Si-sheng,ZHANG Da-wei,MENG Zhi-xia,GUO Shun-xing);Food and Bioengineering College,Xuchang University/Henan Postdoctoral Research Base,Xuchang 461000,China (SUN Si-sheng)
www.cmbp.net.cn Chin Med Biotechnol,2015,10(2):119-124

