蛋白质Nα-末端乙酰化的功能研究进展
刘佳,陈建华
蛋白质Nα-末端乙酰化的功能研究进展
刘佳,陈建华
蛋白质 Nα-末端乙酰化修饰是由 Nα-末端乙酰转移酶(NATs)所催化的酶促反应过程,其结果是蛋白质 N-末端的 α氨基接受来自于乙酰辅酶A(AcCoA)的乙酰基。在真核生物中 Nα-末端乙酰化是一种广泛存在的蛋白质修饰方式,大约有 68%的酵母蛋白质和 85%人蛋白质是 Nα-乙酰化修饰的[1],但原核和古细菌蛋白却很少发生乙酰化。目前已发现在真核生物中存在 6个 NATs亚型(NatA~NatF),每一亚型由一个或多个亚基组成,且各自都有其独特的底物特异性,如起始甲硫氨酸被切除后,N-末端的丝氨酸、丙氨酸、苏氨酸、甘氨酸和缬氨酸都能够被NatA催化乙酰化(N-末端第三个氨基酸为脯氨酸除外)[2]。尽管高等真核生物有更多蛋白质是 Nα-末端乙酰化修饰的,表达更多的 NATs,但是酵母等低等真核生物的 Nα-末端乙酰化模式和 NAT催化机制与高等真核生物是相似的[3]。到目前为止,人们发现 Nα-末端乙酰化具有调节蛋白质降解、抑制内质网易位和调节蛋白质间相互作用等功能,但我们还没能完全了解 Nα-末端乙酰化的所有功能。本文主要对Nα-末端乙酰化和 Nα-末端乙酰转移酶的功能及其与病理联系的研究进展作一综述。
1 Nα-末端乙酰化的功能
1.1 调节蛋白质的降解
Nα-末端乙酰化与泛素介导的蛋白质降解和 N-末端规则途径有着密切的关联[4]。早期的研究表明带有游离 α氨基的蛋白质能被 ATP依赖性的泛素介导而降解,当 N-末端的 α氨基被乙酰化修饰后能够防止泛素介导的蛋白质降解。然而,近年来的研究发现,Nα-末端乙酰化在 N-末端规则途径促进的蛋白质降解中起着重要作用。在真核生物中,Nα-末端降解决定子能够介导蛋白质泛素化和蛋白质选择性地被 26s蛋白酶体分解[5]。例如,保守高尔基体寡聚复合体亚基 Cog1的 Nα-末端乙酰化后会发生降解[6]。
Nα-末端乙酰化的这两个功能分支(促进和抑制蛋白质降解)看似相互矛盾,实际上两者在细胞中可能是同时进行的,但是在特定条件下每一分支分别应用到特定的蛋白质子集,同时细胞所处环境状态对 Nα-末端乙酰化的功能有很大影响。此外,酵母蛋白质组学研究表明,NatB介导的Nα-末端乙酰化不影响蛋白质的稳定性,即 Nα-末端乙酰基既没有稳定蛋白质的作用也没有促进蛋白质降解的作用[7]。
1.2 调节蛋白质间的相互作用
Nα-末端乙酰化可以直接调节蛋白质-蛋白质,蛋白质-生物膜之间的相互作用。NatB催化原肌球蛋白 N末端乙酰化后,可以增强原肌球蛋白二聚体头尾之间的连接作用[8]。近年的研究表明,泛素结合酶 Ubc12的起始甲硫氨酸是被乙酰化的,乙酰基消除了其 N-末端的一个正电荷,从而使Ubc12的 N-末端能与泛素连接酶 Dcn1的疏水口袋结合[9]。这是蛋白质能够识别蛋白质 Nα-末端乙酰化的首个例子,与布罗莫结构域(bromodomain)能特异性地结合组蛋白 N-末端乙酰化的氨基酸残基相似[10]。晶体结构分析显示 Ubc12 N-末端的乙酰基通过氢键直接与 Dcn1的疏水口袋相互作用[9]。此外,Nα-末端乙酰化还被证明能够稳定 α-突触核蛋白的螺旋结构,并且能增强其与细胞膜的亲和力[11]。
1.3 抑制蛋白质内质网易位
蛋白质的靶向作用与 Nα-末端乙酰化有着特殊的联系。研究发现 Nα-末端乙酰化对蛋白质在细胞质中的停留是必不可少的,这是因为某些蛋白质 Nα-末端乙酰化后不再易位到内质网[12],表明 Nα-末端乙酰化能够抑制内质网易位,而Nα-末端缺少乙酰化的蛋白质却可以通过内质网易位进入分泌途径。
分泌蛋白和膜蛋白穿过 Sec61易位子通道进入内质网腔有两个主要的机制:一个是依赖信号识别颗粒的共翻译转运;另一个是依赖 Sec62的翻译后转运。蛋白质进入哪种途径取决于 N-末端 15~30个氨基酸残基长度的导肽中心核的疏水性。Forte等[12]发现,所有依赖 Sec62转运的蛋白质乙酰化后会留在胞浆中。Nα-末端乙酰化的蛋白质不能正确定位到 Sec61易位子,表明乙酰基很可能破坏了转位子自身的相互作用或者破坏了蛋白质与起始靶因子(分子伴侣或者 Sec62复合体)的相互作用。尽管 Forte等明确表示,酵母蛋白为了实现翻译后易位,它们需要处于非乙酰化的状态,但我们仍不清楚,如果没有 Nα-末端乙酰化修饰,是否任何原本发生乙酰化的胞浆蛋白都能够实现易位?
1.4 调节蛋白酶体的定位
蛋白酶体是一个主要的细胞内蛋白酶,并且能够调控许多细胞活动,其中包括细胞内蛋白质质量控制。在细胞存活期间,蛋白质质量控制对防止受损伤的蛋白质累积至关重要[13]。蛋白酶体位于细胞核和细胞质中,蛋白酶体的亚基在细胞质中组装成前体复合物,然后前体复合物被运输进入细胞核以便形成完整的复合物。在哺乳动物细胞中,蛋白酶体平均分布在细胞核和细胞质中。在营养物质充足的条件下,酿酒酵母的蛋白酶体主要累积在细胞核中。当酵母细胞处于饥饿的条件下,蛋白酶体从细胞核再定位到细胞质[14]。在酵母细胞中,NatA、NatB和 NatC是酵母细胞主要的NATs,分别使大约 50%、20%和 20%的蛋白质 N-末端乙酰化。最新的研究表明,在饥饿条件下,酿酒酵母的 NatB 和 NatC介导的蛋白质 Nα-末端乙酰化能够影响蛋白酶体的分布[15]。蛋白酶体从细胞核到细胞质的再定位需要 NatB 和 NatC,敲除酿酒酵母的 NatB和 NatC能够诱导蛋白酶体在饥饿条件下富集于细胞核中[15]。
2 Nα-末端乙酰转移酶的功能
2.1 催化 Nα-末端乙酰化
在真核生物中已发现存在 6种 NATs亚型(NatA~NatF),它们都具有催化蛋白质 Nα-末端乙酰化的生物学活性,表 1列出了人的 6种不同 NATs的亚基组成及各自的底物特异性。这里需要强调的是 NatD在两方面不同于其他的 NATs。首先,在酵母和人细胞中只有两种底物能被NatD催化乙酰化,即组蛋白 H2A和 H4[16];其次,其他NATs亚型的底物特异性由位于底物 N-末端的前 2~5个氨基酸残基所决定,而 NatD的底物特异性由底物 N-末端的前 30~50个氨基酸残基所决定。表 2总结了不同NATs(NatA~NatE)缺失或突变后酵母和人细胞系所产生的功能异常,从中可看出 NATs对细胞的生存和生长具有重要的作用。NatF是近几年被发现的一种 NAT亚型,目前只在高等真核生物中发现有 NatF的存在。此外,NatF还可以催化 N-末端具有 Met-Lys-序列的底物发生 Nα-末端乙酰化,而此 N-末端在酵母中却很少发生乙酰化[19],从而赋予人的 Nα-末端乙酰化丰度高于酵母。
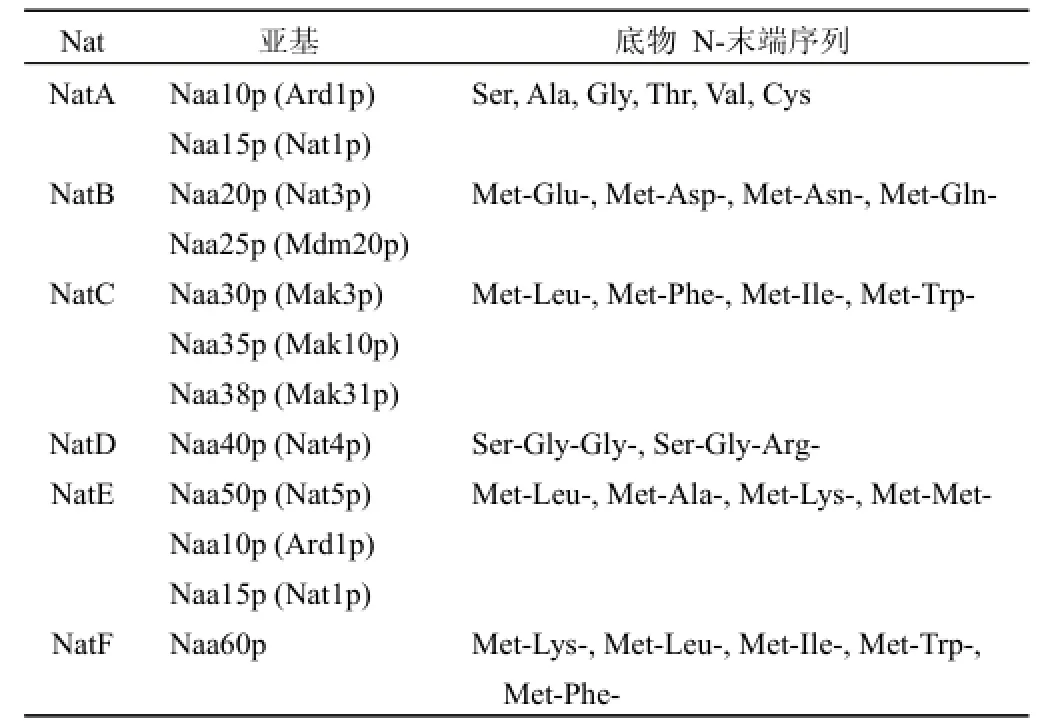
表1 人 NATs的亚基组成和底物特异性

表2 NATs缺失或突变后酵母细胞和人细胞系的影响
2.2 其他生物学活性
NATs催化 Nα-末端乙酰化的生物学活性已经得到了充分证明。而且有证据表明 NATs还具有催化赖氨酸乙酰化的作用,Lim等和 Shin等已经证明,人的 NatA能够催化 β-连环蛋白和肌球蛋白轻链激酶的赖氨酸残基乙酰化[20-21]。NatA也可催化 hNaa10p在 K136处进行自乙酰化。
NATs不但具有催化活性,而且能够不依赖其催化活性对细胞的活动进行调节。例如,人类的Naa10p(hNaa10p)与 p21活化激酶(PAK)结合后能够影响 PAK与鸟苷转换因子(PIX)的相互作用,从而抑制细胞迁移[22]。Lee等[23]提出 hNaa10p可以不依赖乙酰转移酶的活性与 DNA甲基转移酶 1(DNMT1)相互作用,从而促进DNMT1与目标 DNA之间的作用,最终实现 E-钙黏蛋白转录沉默。
3 NATs和 Nα-末端乙酰化与病理的联系
NATs和 Nα-末端乙酰化在病理过程中起着重要的调节作用。人体缺失 NatA活性会导致严重的发育缺陷,且在许多肿瘤中也会出现 NatA失调的情况[24]。2011年,人们发现了第一个由 NAT基因突变引起的人类遗传病——奥氏(Ogden)综合征。它是一种致命的伴 X染色体紊乱疾病,临床表现为颅面骨畸形、张力过低、发育迟缓和心律失常等。编码 NatA催化亚基(hNaa10p)的基因突变是引起该病的主要原因。
一些研究发现,hNaa10同时扮演着双重角色,既可作为癌蛋白起作用,又可抑制肿瘤。Naa10p在肺癌、结直肠癌和乳腺癌等不同类型癌症中过表达。几项研究表明,hNaa10p可以作为癌蛋白起作用,例如当癌细胞缺失hNaa10p后,能够诱导 p53依赖性的细胞凋亡[25];在某些肿瘤中细胞周期蛋白 D1会出现突变、扩增及过表达的现象,hNaa10p可诱导细胞周期蛋白 D1的转录使其表达异常,从而导致肿瘤[26]。同时,另一些研究表明,hNaa10p具有抑癌作用,Kuo等[27]已经报道,当乳腺癌细胞过表达Naa10p时细胞增长减慢和致瘤性降低。除 NatA外,其他几种 NATs亚型同样可以从不同的方面调节细胞的生长和凋亡。研究发现 NatB在肝癌细胞中过表达,而 NatD在同种类型的癌细胞中表达量却降低[28]。
最新的研究发现 Nα-末端乙酰化具有稳定 α-突触核蛋白,促进 Sup35淀粉样蛋白的形成和防止亨廷顿蛋白(Htt)聚集的作用[29]。Nα-末端乙酰化在神经系统变性疾病(如帕金森病、克雅病和亨廷顿病)发生发展中的作用有待进一步研究。
4 展望
蛋白质-末端乙酰化作为一个多功能的调节剂,具有调节蛋白质降解、抑制内质网易位和调节蛋白质复合物形成等作用。此外,NATs和 Nα-末端乙酰化在生理和病理过程中也起着重要的调节作用,这将为某些疾病发病机制研究和治疗开辟新的途径。到目前为止,在真核生物中已鉴定出了6种 NATs(NatA~NatF),是否还存在更多的 NATs仍然是一个有待研究的问题。未来的研究方向应侧重于 Nα-末端乙酰化的发生机制,以及探究是否 Nα-末端乙酰化的功能具有像 Nα-末端乙酰化蛋白一样的多样性。
[1] Hollebeke J,Van Damme P,Gevaert K.N-terminal acetylation and other functions of Nα-acetyltransferases.Biol Chem,2012,393(4): 291-298.
[2] Goetze S,Qeli E,Mosimann C,et al.Identification and functional characterization of N-terminally acetylated proteins in Drosophila melanogaster.PLoS Biol,2009,7(11):e1000236.
[3] Arnesen T.Toward a functional understanding of protein N-terminal acetylation.PLoS Biol,2011,9(5):e1001074.
[4] Hwang CS,Shemorry A,Varshavsky A.N-terminal acetylation of cellular proteins creates specific degradation signals.Science,2010,327(5968):973-977.
[5] Tasaki T,Sriram SM,Park KS,et al.The N-end rule pathway.Annu Rev Biochem,2012,81:261-289.
[6] Shemorry A,Hwang CS,Varshavsky A.Control of protein quality and stoichiometries by N-terminal acetylation and the N-end rule pathway. Mol Cell,2013,50(4):540-551.
[7] Helbig AO,Rosati S,Pijnappel PW,et al.Perturbation of the yeast N-acetyltransferase NatB induces elevation of protein phosphorylation levels.BMC Genomics,2010,11:685.
[8] Coulton AT,East DA,Galinska-Rakoczy A,et al.The recruitment of acetylated and unacetylated tropomyosin to distinct actin polymers permits the discrete regulation of specific myosins in fission yeast. J Cell Sci,2010,123(19):3235-3243.
[9] Scott DC,Monda JK,Bennett EJ,et al.N-terminal acetylation acts as an avidity enhancer within an interconnected multiprotein complex. Science,2011,334(6056):674-678.
[10]Filippakopoulos P,Knapp S.The bromodomain interaction module. FEBS Lett,2012,586(17):2692-2704.
[11]Holmes WM,Mannakee BK,Gutenkunst RN,et al.Loss of amino-terminalacetylation suppresses a prion phenotype by modulating global protein folding.Nat Commun,2014,5:4383.
[12]Forte GM,Pool MR,Stirling CJ.N-terminal acetylation inhibits protein targeting to the endoplasmic reticulum.PLoS Biol,2011,9(5): e1001073.
[13]Amm I,Sommer T,Wolf DH.Protein quality control and elimination of protein waste:the role of the ubiquitin-proteasome system.Biochim BiophysActa,2014,1843(1):182-196.
[14]Laporte D,Salin B,Daignan-Fornier B,et al.Reversible cytoplasmic localization of the proteasome in quiescent yeast cells.J Cell Biol,2008,181(5):737-745.
[15]van Deventer S,Menendez-Benito V,van Leeuwen F,et al.N-terminal acetylation and replicative age affect proteasome localization and cell fitness during aging.J Cell Sci,2015,128(1):109-117.
[16]Hole K,Van Damme P,Dalva M,et al.The human N-alphaacetyltransferase 40(hNaa40p/hNatD)is conserved from yeast and N-terminally acetylates histones H2A and H4.PLoS One,2011,6(9):e24713.
[17]Yi CH,Pan H,Seebacher J,et al.Metabolic regulation of protein N-alpha-acetylation by Bcl-xL promotes cell survival.Cell,2011,146(4):607-620.
[18]Starheim KK,Gromyko D,Evjenth R,et al.Knockdown of human N alpha-terminal acetyltransferase complex C leads to p53-dependent apoptosis and aberrant human Arl8b localization.Mol Cell Biol,2009,29(13):3569-3581.
[19]Van Damme P,Hole K,Pimenta-Marques A,et al.NatF contributes to an evolutionary shift in protein N-terminal acetylation and is important for normal chromosome segregation.PLoS Genet,2011,7(7):e1002169.
[20]Lim JH,Park JW,Chun YS.Human arrest defective 1 acetylates and activates beta-catenin,promoting lung cancer cell proliferation. Cancer Res,2006,66(22):10677-10682.
[21]Shin DH,Chun YS,Lee KH,et al.Arrest defective-1 controls tumor cell behavior by acetylating myosin light chain kinase.PLoS ONE,2009,4(10):e7451.
[22]Hua KT,Tan CT,Johansson G,et al.N-α-acetyltransferase 10 protein suppresses cancer cell metastasis by binding PIX proteins and inhibiting Cdc42/Rac1 activity.Cancer Cell,2011,19(2):218-231.
[23]Lee CF,Ou DS,Lee SB,et al.hNaa10p contributes to tumorigenesis by facilitating DNMT1-mediated tumor suppressor gene silencing. J Clin Invest,2010,120(8):2920-2930.
[24]Kalvik TV,Arnesen T.Protein N-terminal acetyltransferases in cancer. Oncogene,2013,32(3):269-276.
[25]Gromyko D,Arnesen T,Ryningen A,et al.Depletion of the human Nα-terminal acetyltransferase A induces p53-dependent apoptosis and p53-independent growth inhibition.Int J Cancer,2010,127(12):2777-2789.
[26]Lim JH,Chun YS,ParkJW.Hypoxia-induciblefactor-1alpha obstructs a Wnt signaling pathway by inhibiting the hARD1-mediated activation of beta-catenin.Cancer Res,2008,68(13):5177-5184.
[27]Kuo HP,Lee DF,Chen CT,et al.ARD1 stabilization of TSC2 suppresses tumorigenesis through the mTOR signaling pathway.Sci Signal,2010,3(108):ra9.
[28]Ametzazurra A,Larrea E,Civeira MP,et al.Implication of human N-alpha-acetyltransferase 5 in cellular proliferation and carcinogenesis.Oncogene,2008,27(58):7296-7306.
[29]Dikiy I,Eliezer D.N-terminal acetylation stabilizes N-terminal helicity in lipid-and micelle-bound α-synuclein and increases its affinity for physiological membranes.J Biol Chem,2014,289(6): 3652-3665.
10.3969/cmba.j.issn.1673-713X.2015.02.015
210009南京,中国药科大学生命科学与技术学院
陈建华,Email:chenjhnj@163.com
2015-02-09

