大孔树脂分离纯化葡萄籽原花青素的研究
梁 敏,何丽娜,董新荣,崔夫知
(湖南农业大学理学院,湖南长沙410128)
大孔树脂分离纯化葡萄籽原花青素的研究
梁 敏,何丽娜,董新荣*,崔夫知
(湖南农业大学理学院,湖南长沙410128)
本文研究了大孔树脂分离纯化葡萄籽提取物中原花青素的方法。先对5种大孔吸附树脂用静态筛选方法选择HPD100和HPD400树脂,进一步以动态吸附与解吸附实验比较了两种树脂对葡萄籽提取物原花青素的吸附与洗脱效果。结果表明:HPD100、HPD400树脂对葡萄籽提取物中原花青素的动态饱和吸附量分别为101.2和92.1mg·g-1,乙醇洗脱的总洗脱率分别为96.5%和92.0%;其中30%乙醇洗脱样品中原花青素含量分别为74.8%和85.0%;50%乙醇洗脱样品中原花青素含量分别为70.0%和73.9%。与HPD100相比较,HPD400更适合葡萄籽原花青素的分离与富集。
葡萄籽;原花青素;大孔树脂;分离
原花青素(Procyanidins,PC)是一类自然界广泛存在的植物多酚类物质,具有良好的抗氧化作用,其清除自由基的能力是VC的50倍,VE的20倍[1]。此外,还具有抗突变、抗心血管疾病、抗癌、延缓衰老等活性[2-4],因而引起了极大的关注。
葡萄籽是原花青素的重要来源。我国是葡萄生产大国,大量葡萄用来酿酒,产生的大量籽具有综合利用的价值。葡萄籽提取物需要分离纯化以提高原花青素的含量,其分离方法很多,其中大孔树脂吸附法由于操作简单、以再生利用、产品纯度高等特点受到人们的广泛关注。曹明华[5]以O3F3大孔吸附树脂作为吸附剂,葡萄籽提取物以水溶解后上样,吸附树脂再以40%的乙醇溶液脱,葡萄籽中原花青素的纯度可达到85.8%,回收率可达到86.6%。范明霞[6]等比较了7种大孔树脂对原花青素的吸附解吸性能,结果表明,AB-8大孔树脂对葡萄籽中原花青素的吸附效果最好,原花青素洗脱率为94.37%,所得溶质纯度可达89.63%。
葡萄因品种、产地等差异,葡萄籽中原花青素含量、杂质种类往往不同,导致葡萄籽提取物的原花青素的含量也不一样,其纯化的技术一般需要根据具体情况进行。本文以国内某葡萄酒厂提供的葡萄籽为原料,对HPD系列大孔树脂富集其提取物中的原花青素进行了探讨,以期为该品种葡萄籽中原花青素的利用提供依据。
1 实验部分
称取1g装入锥形瓶,再量取100mL上样溶液于各锥形瓶中,置于20℃的水浴恒温振摇器中振摇,每隔1h准确移取上清液1 mL,显色后测定其吸光度。
静态洗脱:将吸附饱和的树脂过滤,用蒸馏水润洗,去除杂质后滤干。分别加入20mL 95%乙醇,置于20℃的水浴恒温振摇器中振摇,每隔1h准确移取上清液1mL,显色后测定其吸光度。
重复筛选:选取出对原花青素吸附效果、解吸效果都较好的3种树脂,按静态吸附方法进行静态饱和吸附;静态洗脱时则以乙醇浓度30%、50%、70%、95%各20mL进行梯度洗脱,比较乙醇浓度对吸附在大孔树脂上的原花青素的洗脱效果。
1.2.4 大孔树脂的动态吸附与洗脱动态吸附:将静态筛选选取出来的树脂预处理后湿法装柱(树脂体积大约为23mL,自然晾干后湿重约为16g)。将葡萄籽的提取原液(显色后测定其吸光度)缓慢从柱顶加入,调节流速为10mL/30min,每10mL接受一份流出液,显色后测定其吸光度,直至树脂吸附饱和,绘制原花青素的动态吸附曲线。
动态梯度洗脱:用4倍柱床体积(80mL)的蒸馏水清洗树脂床后,再分别用10%、30%、50%、70%、95%乙醇、丙酮各80mL对树脂床进行梯度洗脱,调节流速为10mL/30min,每10mL接受一份流出液,取适量流出液稀释相应倍数,显色后测定其吸光度,绘制原花青素在不同浓度乙醇下的动态洗脱曲线。
2 结果与讨论
2.1 原花青素的标准曲线
按2.2.1方法将原花青素对照样品溶液经显色后,用紫外分光光度计在200~800nm范围内扫描得到原花青素显色后的最大吸收波长,其UV光谱图见图1。
1.1 材料与仪器
葡萄籽(国内某葡萄酒厂);葡萄籽原花青素对照样品(含量≥95%)(湖南三福公司);HPD100,HPD300,HPD400,HPD600,HPD750型大孔树脂(河北宝恩公司);香兰素(中国医药(集团)上海化学试剂公司分析纯试剂);其余均为分析纯试剂;水为二次蒸馏水。
AX-200型万分之一电子天平(日本Shimadzu Philippines公司);80-2型离心沉淀器(上海手术器械厂);SHZ-B多功能水浴恒温振摇器(上海浦东物理光学仪器厂);UNICO 2000可见分光光度计(尤尼柯(上海)有限公司);SB25-12DT超声波清洗器(宁波新芝生物科技股份有限公司)。
1.2 实验方法
1.2.1 原花青素的标准曲线与含量测定
对照样品溶液配制:准确称取原花青素对照样品0.0032g置于小烧杯中,用甲醇溶解,转移至25mL容量瓶中,加甲醇定容摇匀,配制成原花青素标准溶液。
显色溶剂配制:显色溶剂由A和B混合配成,A为1%的香草醛溶液,B为8%的浓HCl,A∶B=1∶1,现配现用。准确称取0.5010g香草醛置于小烧杯中,用甲醇溶解,转移至50mL容量瓶中,加甲醇定容摇匀;用量筒量取的4.0 mL浓盐酸置于小烧杯中,用甲醇溶解,转移至50mL容量瓶中,加甲醇定容摇匀。
标准曲线绘制:分别准确移取1.5、2.5、3.5、4.5、5.5mL原花青素标准溶液于10mL容量瓶中,加甲醇定容摇匀。分别从10mL容量瓶中准确移取原花青素溶液1mL(另取1mL甲醇为空白)于比色管中,精密加入5mL显色剂,摇匀避光,在30±1℃恒温水浴下加热显色30min,取出比色管后冷却10min,用1cm比色皿在最大吸收波长处测定吸光度,并绘制标准曲线。
样品测定:样品通过甲醇溶解,稀释,定容后,通过HCl-香草醛法在原花青素的最大吸收波长处测量其吸光度。
1.2.2 原花青素的提取与上样液的制备称取脱脂葡萄籽30g,以50%的乙醇、料液比1∶20、提取温度90℃的条件下回流4h。冷却后,过滤,收集滤液,减压去除乙醇。稀释一定倍数后用80-2型离心沉淀器离心,直至溶液澄清透明,将其稀释至600mL,按1.2.1中方法显色后测定其吸光度。
1.2.3 大孔树脂的静态筛选
静态吸附:选择5种不同型号大孔树脂,准确
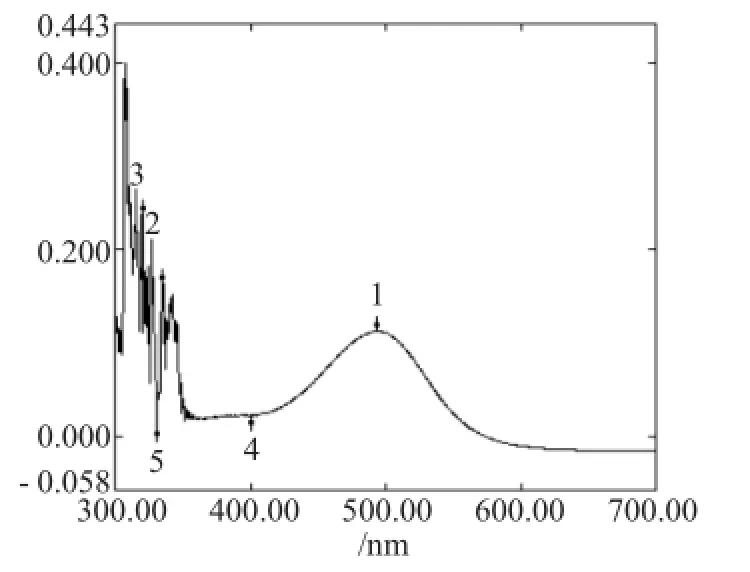
图1 原花青素显色后的紫外光谱图Fig.1UV spectrogram of anthocyanin
从图1可以看出,原花青素显色后在494nm处有最大吸收峰。故选用494nm为原花青素含量测定的波长。
以不同浓度的对照品溶液在494nm处依次测量吸光值,以原花青素浓度(mg·mL-1)为横坐标,吸光度为纵坐标制作标准曲线,结果见图2。
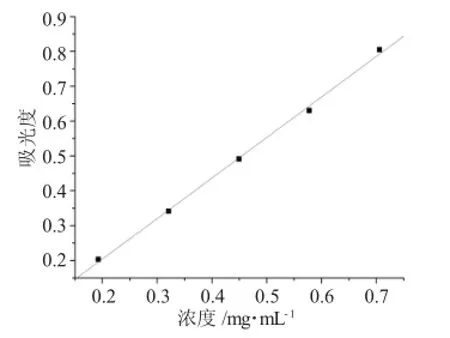
图2 原花青素标准曲线Fig.2Standard curve of anthocyanin
原花青素浓度在0.19~0.77mg·mL-1范围内,浓度与吸光度成线性关系。标准曲线方程为:y=-0. 02855+1.16277χ(R2=0.999,n=5),y为波长494nm处的吸光度,χ为原花青素溶液的浓度(mg·mL-)1。
2.2 大孔树脂的静态筛选
2.2 .1 静态饱和吸附曲线本文考察了5种大孔吸附树脂对葡萄籽原花青素的静态吸附性能。通过测定样品溶液经大孔树脂静态吸附一定时间后上清液吸光度的变化,判断大孔树脂对原花青素的吸附情况,结果见图3。
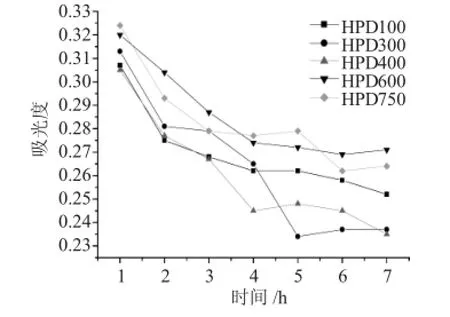
图3 大孔树脂对原花青素的静态吸附曲线Fig.3Static adsorption curve of anthocyanin on macroporous resin
由图3可知,在2h内上清液的吸光度迅速减小,即5种树脂在此段时间内对样品溶液中的原花青素吸附速度较快。其中,HPD100、HPD400、HPD600号在4h的时候基本达到吸附饱和,其中HPD400吸附量最大,HPD600吸附量最小;HPD300号树脂在5h后基本吸附饱和,吸附容量为该系列树脂中最大;HPD750在吸附6h达饱和,吸附时间长而且吸附量较小。综合比较吸附容量,HPD100、HPD300、HPD400大孔树脂对原花青素的吸附效果较好。
2.2.2 静态洗脱为了考察吸附在大孔树脂上的原花青素的解吸效果,本文将吸附饱和的树脂过滤,经水洗后再以95%的乙醇进行洗脱,并考察解吸附1h时的解吸液的吸光度(稀释两倍后),结果见表1。

表1 静态洗脱结果Tab.1Results of static desorption
静态洗脱实验中,解吸液的吸光度越大表明洗脱效果越好,洗脱率高。由表1可知,除HPD600树脂外,其余4种树脂在洗脱1h时的吸光值均较大,说明它们洗脱效果较好。综合吸附能力和洗脱效果,选择HPD100、HPD300、HPD400 3种树脂进行重复筛选。
2.2.3 重复筛选为了进一步比较HPD100、HPD 300、HPD400 3种大孔树脂对葡萄籽提取物中原花青素的吸附和洗脱效果,对上述3种大孔树脂进行重复筛选。结果HPD300、HPD400号两种树脂的吸附量较HPD100的吸附量稍大,与初选结果基本一致。
在静态洗脱时,进一步考察了乙醇浓度对吸附在树脂上的原花青素的梯度洗脱效果。吸附了原花青素的树脂分别以不同浓度的乙醇依次洗脱,并分别测定其洗脱液的吸光度,结果见表2。由表2可知,吸附在上述3种树脂上的原花青素主要都由30%乙醇解吸附。由于HPD100号的吸附量比HPD300、HPD400的稍小,因此,HPD100号树脂的洗脱效果相对比较会更好一些。由于HPD100和HPD300树脂均为非极性树脂,HPD400号为中极性树脂,综合考虑选取HPD100和HPD400大孔树脂进行下一步的动态吸附和洗脱。
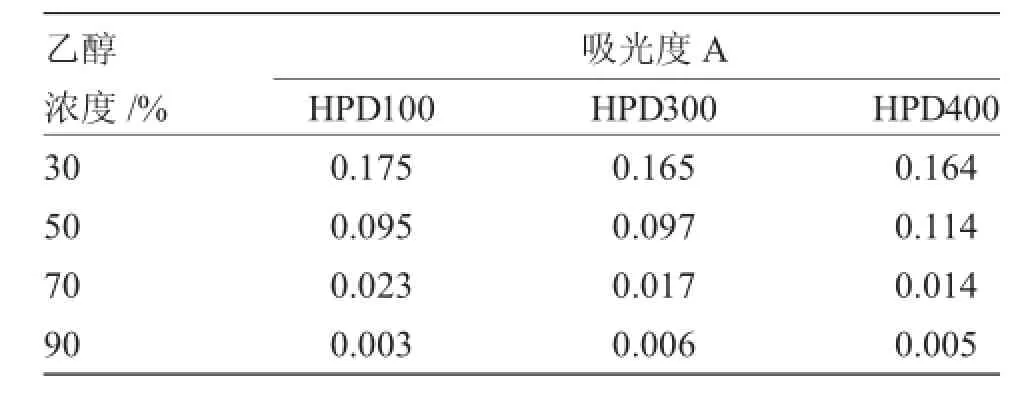
表2 HPD100、HPD300、HPD400号树脂静态梯度洗脱结果Tab.2Results of static desorption on macroporous resin 2,3 and 6
2.3 大孔树脂的动态吸附和洗脱
2.3.1 树脂的动态饱和吸附曲线将等体积的经处理的HPD100和HPD400树脂分别置于玻璃柱中,分别将已知吸光度的样品溶液加入树脂柱顶,以同样的速度流经树脂床,每10mL接受一份流出液,测定其吸光度,直至树脂吸附饱和。绘制动态饱和吸附曲线见图4。
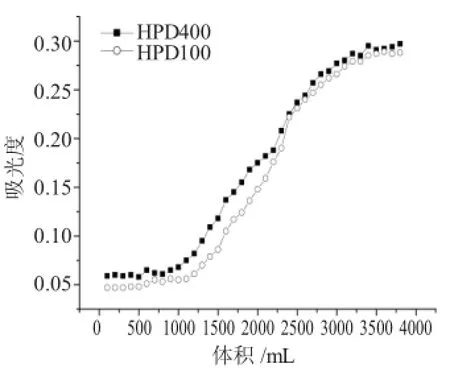
图4 树脂动态吸附曲线Fig.4Dynamic adsorption curve
由图4可知,随着上样量的增大,流出液中的吸光值逐渐增加,即树脂对原花青素的吸附量减小。当HPD400号树脂的上样体积超过1000mL时,流出液的吸光值增加很快,即它对样品溶液中的原花青素的吸附量迅速降低;当上样体积达到3400mL,流出液的吸光值基本与上样液一致,即HPD400树脂吸附葡萄籽原花青素基本达到饱和。通过计算,HPD400树脂对原花青素的动态饱和吸附量达到92.1mg·g-1。对于HPD100号树脂而言,当上样体积达到1100mL时,HPD100树脂对原花青素的吸附量迅速降低;当上样体积达到3500mL,流出液中原花青素的含量与上样液中含量基本相同,此时HPD100树脂吸附葡萄籽原花青素基本达到饱和。通过计算,HPD100树脂对原花青素的动态饱和吸附量达到101.2mg·g-1。
2.3.2 树脂的动态梯度洗脱将吸附饱和的树脂以4BV的不同浓度乙醇(10%、30%、50%、70%、95%)和丙酮梯度洗脱,每10mL(0.5BV)收集,取洗脱液进行比色测定原花青素含量,结果见图5。
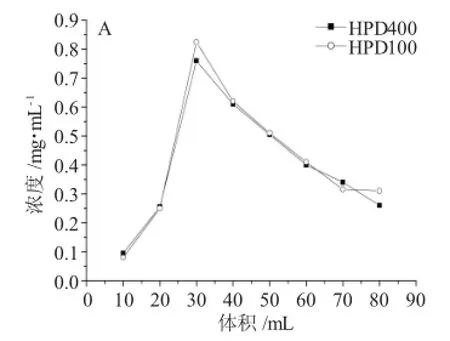

图5 乙醇梯度洗脱曲线(乙醇浓度:A,10%;B,30%;C,50%;D,70%)Fig.5Elution curve(ethanol concentration:A,10%;B,30%;C,50%;D,70%)
从图5可以看出,两种树脂的乙醇梯度曲线相似。原花青素主要均由30%、50%乙醇洗脱液。但HPD100号树脂的洗脱浓度略高于HPD400号树脂。由于95%乙醇洗脱液和丙酮洗脱液中原花青素的含量很低,故未进行讨论。
进一步将两种树脂10%、30%、50%、70%的洗脱液分别合并,减压浓缩至干,得到固体粉状物,测定样品中原花青素的含量,结果表明HPD100、HPD400两种树脂的10%乙醇洗脱物质量少(分别为总洗脱物的12.3%、13.5%)、原花青素含量也很低(分别为9,2%和9.5%);70%乙醇洗脱物非常少。
吸附在HPD400、HPD100树脂上的原花青素主要由30%和50%乙醇洗脱下来。分离前样品(提取物)中原花青素的含量为36.3%。HPD100树脂30%、50%乙醇洗脱样品分别占总量的52.9%和32.9%,原花青素含量为74.8%和70.0%;乙醇梯度洗脱的总洗脱率为96.5%。HPD400树脂30%、50%乙醇洗脱样品分别占总量的47.7%和35.6%,原花青素含量为85.0%和73.9%;乙醇梯度洗脱的总洗脱率达到92.0%。
3 结论
我国葡萄产量大,除部分用于水果消费外,大量的葡萄用于酿酒,产生大量的葡萄籽。葡萄籽是一种可利用的资源,其中原花青素含量较高,具有重要的生物活性,受到广泛关注。本文对某酒厂的葡萄籽原花青素经乙醇提取后,采取大孔树脂的分离纯化。
本文比较了两种极性不同的大孔树脂HPD100和HPD400对葡萄籽原花青素的分离效果。结果HPD100、HPD400树脂对葡萄籽提取物中原花青素的动态饱和吸附量分别为101.2和92.1mg·g-1,乙醇洗脱的总洗脱率分别为96.5%和92.0%;其30%乙醇洗脱样品中原花青素含量分别为74.8%和85.0%;50%乙醇洗脱样品中原花青素含量分别为70.0%和 73.9%。与HPD100相比较,HPD400树脂的洗脱率稍低,但对原花青素的吸附与洗脱的选择性可能好一些。因此,HPD400更适合葡萄籽原花青素的分离与富集。
[1]Wood Jacqueline E,Senthilmohan Senti T,Peskin Alexander V. Antioxidant activityof procyanidin-containingplant extracts at different pH[J].Food Chemistry,2002,77(2):l55-l61.
[2]Kidd P.M.Bioavailability and activity of phytosome complexes from botanical polyphenols:the silymarin curcumin green tea and grape seed extracts[J].Alternative Medicine Review,2009,14(3):226.
[3]Nassiri-Asl M.,Hosseinzadeh H.Reviewofthe pharmacological effectsofvitisviniferagrapeanditsbioactivecompounds[J].PhytotherapyResearch 2009,23(9):1197.
[4]Quesada H.,Delbas J.M.,Pajuelo D,et al.Grape seed proanthocyanidins correct dyslipidemia associated with a high-fat diet in rats and repress genes controllinglipogenesis and VLDLassembling in liver[J].International Journal ofObesity,2009,33(9):1007.
[5]曹明华,陈卫航,张婕,等.O3F3大孔吸附树脂分离葡萄籽中原花青素的研究[J].粮油加工,2008,(7):79-82.
[6]范明霞,刘新桥,陈莹,等.大孔树脂吸附纯化葡萄籽原花青素的研究[J].应用化工,2009,38(6):864-867.
Seperation and enrichment of anthocyanin from grape seed by macroporous resin column chromatography
LIANG Min,HE Li-na,DONG Xin-rong,CUI Fu-zhi
(College of Science,Hunan Agricultural University,Changsha 410128,China)
The method for seperation and purification of anthocyanin from grape seed by macroporous resin column chromatography were studied in this work.Firstly,five kinds of macroporous resin were screened by static screening technology.Then resin HPD 100 and resin HPD 400 were choosed out as adsorbent of dynamic seperation.The results indicated that adsorptive capacity of rensin HPD100 and HPD 400 are 101.2 and 92.1mg·g-1with the elution rate of 96.5%and 92.0%,respectively.The content of anthocyanin in samples eluted by 30%ethanol were 74.8%and 85.0%and the content of anthocyanin in samples eluted by 50%ethanol 70.0%and 73.9%. Compared with resin HPD 100,HPD 400 is more effective for seperation and enrichment of anthocyanin from grape seed.
grape seed;anthocyanin;macroporous resin;seperation
R284.2;O652.62
A
10.16247/j.cnki.23-1171/tq.20150365
2014-08-26
梁敏(1978-),女,内蒙古人,大学本科,助理实验师,从事化学实验教学及管理工作、天然产物化学研究工作。
董新荣,男,博士,教授,主要从事有机化学与天然产物化学的教学与研究工作。

