中药蝉花菌株筛选及发酵条件优化研究
陈显群,羊 悦,杨胜利*
(1.温州市食品研究所,浙江温州325000;2.浙江工业大学药学院,浙江杭州310014)
中药蝉花菌株筛选及发酵条件优化研究
陈显群1,羊 悦2,杨胜利2*
(1.温州市食品研究所,浙江温州325000;2.浙江工业大学药学院,浙江杭州310014)
目的:从蝉花中分离真菌,并采用液体培养考察菌丝收率。方法:在单因素实验基础上,利用正交实验设计,对蝉花菌液态深层发酵条件如摇床转速、接种量、pH等进行了优化。结果:最优的发酵工艺为初始pH 7.0、摇床转速160 r/min、发酵温度25℃。结论:优化发酵工艺条件下蝉花菌发酵生物量为6.57 g/L。
蝉花;液态深层发酵;分离
0 引言
蝉花属虫生性药用真菌,是我国传统名贵中药材,又名蝉蛹草、蝉茸、胡蝉、蜩等,与冬虫夏草同属于菌物界、真菌门、子囊菌纲、麦角菌目、麦角菌科、虫草属,具有广泛的生物活性。中医药学家认为,蝉花具有疏散风热、透疹、熄风止痉、明目退翳之功效。现代医学研究表明,它具有免疫调节[1-3]、抗疲劳抗衰老[4-5]、抗肿瘤[6-8]、改善肾功能[9]、促进造血功能[10]、镇静催眠[11]、滋补强壮[12]等作用。由于蝉花与冬虫夏草同属虫菌复合体,且具有相近的药用价值,所以医家常将蝉花作为冬虫夏草的代用品。由于蝉花生长需要特定的生态环境和寄主昆虫,资源稀少,再加上长期采挖,资源日趋枯竭。开展人工分离、培养及液体发酵培养菌丝体的研究是未来的一个发展方向。近些年对冬虫夏草的研究较多,而对蝉花的研究甚少,蝉花具有与冬虫夏草相似的化学成分,故蝉花可能具有与冬虫夏草相似的药用价值,从而为蝉花作为冬虫夏草的替代品提供了理论依据[13-16]。
1 材料与方法
1.1 蝉花采自浙江安吉竹博园
1.2 培养基
分离培养基:马铃薯20%,葡萄糖4%,蛋白胨0.2%,酵母膏0.2%,K2HPO40.1%,MgSO40.05%,琼脂粉2%。121℃灭菌20 min。
种子培养基:马铃薯20%,葡萄糖4%,蛋白胨0.2%,酵母膏0.2%,K2HPO40.1%,MgSO40.05%。121℃灭菌20 min。
液体发酵培养基:马铃薯提取液20%,葡萄糖4%,蛋白胨0.4%,MgSO40.05%,K2HPO40.1%,酵母膏0.2%,维生素B1 0.002%。121℃灭菌20 min。
1.3 方法
1.3.1 菌种分离
称取5 g天然蝉花样品,分别取自僵虫体、子座芽和孢子,加入到45 mL无菌生理盐水中,振荡30 min。梯度稀释,从各稀释液中吸取0.1 mL到筛选平板并涂布,置于25℃恒温培养箱中培养3~5 d。挑选单个典型的菌落,接种到PDA斜面培养基中,保存备用。
1.3.2 菌种鉴定
用点接法将蝉花真菌接种到PDA平板上进行菌落形态观察,通过显微镜作个体形态观察。
1.3.3 种子培养
250 mL摇瓶装液量50 mL,接种斜面菌块,置于摇床中,转速160 r/min,25℃培养4 d。
1.3.4 发酵培养条件的影响
经初步试验选定pH值、发酵温度、摇床转速作为主要影响因素,以发酵后菌丝体生物量为指标,在单因素试验的基础上采用三因素三水平正交设计试验,对蝉花菌株发酵条件进行优化研究。
1.3.4.1 pH值的影响
在250 mL锥形瓶中装入100 mL发酵培养基,按5%种子液接种,pH值分别调至5.0、5.5、6.0、6.5、7.0、7.5、8.0,25℃培养5 d,发酵结束后,4000 r/min离心,测定菌丝体量。
1.3.4.2 温度的影响
固定其他条件,考查发酵培养温度分别为20℃、22℃、24℃、26℃、28℃、30℃时对蝉花发酵生物量的影响。
1.3.4.3 摇床转速的影响
固定其他条件,考查摇床转速分别为120、140、160、180、200 r/min时对蝉花发酵生物量的影响。
1.3.4.4 正交设计优化
针对发酵过程中pH值、温度和转速对菌丝体生长的影响,选定这3个因素,进行正交实验L9(33),其因素和水平见表1。
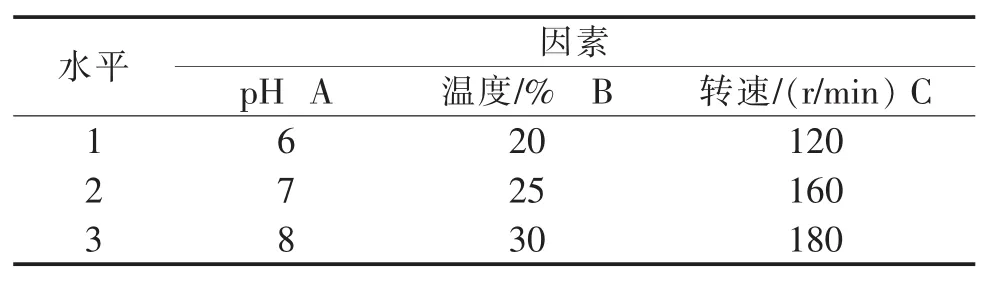
表1 发酵条件因素水平表Table 1 Factors and levels of fermentation condition
1.3.5 生物量测定
采用干重法。发酵液经4000 r/min离心15 min去除上清液,菌丝体用去离子水洗涤3次后离心,置于烘箱内60℃烘干至恒重后称重。
2 结果与分析
2.1 菌种的分离与鉴定
按照1.3.1方法分离出多株菌株,其中在子座芽中分离的一株长势良好。经分离纯化后,点接在PDA平板中观察该菌落形态。发现刚开始菌落圆形呈白色,起初星状放射生长、菌丝平伏,与培养基结合紧密,不易挑取,继续培养颜色逐渐加深,最终呈紫色。在显微镜下观察该菌个体形态,发现菌丝有隔,基部无足细胞。分生孢子梗生于气生菌丝上,具简单分枝,由单侧生、对生的瓶状小梗组成。瓶梗较短,基部膨大和具管状的颈部,可初步判定其为蝉拟青霉。
2.2 发酵条件对蝉花菌丝体生长的影响
2.2.1 pH值对蝉花发酵生物量的影响
一般来讲,pH值过低菌体易衰老,pH值过高易使菌体自溶。本实验研究了不同的培养基pH值对菌体生长的影响,结果如图1所示。由图1可以看出,就生物量而言,出发菌株随着初始pH值的升高出现先上升后下降的变化,在初始pH为7.0时,达到最大值;在初始pH为6.5和pH为7.0时生物量变化不明显,分别是6.24 g/L和6.27 g/L。
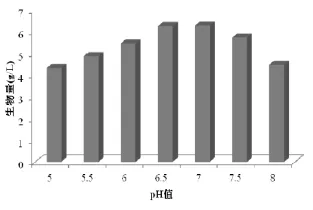
图1 培养初始pH值对生物量的影响Fig.1 Effects of initial pH on biomass
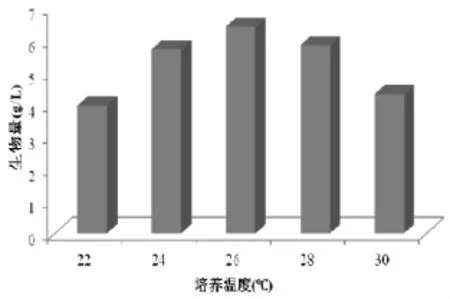
图2 培养温度对生物量的影响Fig.2 Effects of culture temperature on biomas
2.2.2 培养温度对蝉花发酵生物量的影响
对微生物发酵培养来说,温度的影响是双方面的:温度升高,可以加快微生物的生长,但是随着温度的上升,细胞中对温度敏感的酶可能会遭到破坏,而且温度过高,菌体易老化,影响到菌丝体生长及其他代谢产物的积累。一般的较适于真菌生长的温度范围为25℃~30℃,据报道菌丝在10℃~30℃下均能生长。本实验选择温度范围在20℃~30℃之间,考察对菌丝体的生长影响。由图2可以看出,在26℃时的生物量最大,而低于20℃或高于30℃对菌丝体的生物量影响较大,由于长势肉眼便可直观辨别,因此没有进一步研究的必要。因此选定蝉花菌丝生长的最适合的发酵温度为26℃,菌株生物量达到最大值6.42 g/L。
2.2.3 摇床转速对蝉花发酵生物量的影响
由表3可以看出,摇床转速为160 r/min时蝉花菌丝生物量达到最大,菌丝在液体中生长需要消耗氧气,随着摇床转速的提高,液面接触空气的面积增大,利于溶解氧水平的增加;摇床转速继续增加,剪切力增加,菌丝不断被切断,形成新的菌丝球萌发点,从而生长出新的菌丝球;但摇床转速过大,菌丝难以在高速振荡情况下会导致菌丝损伤严重,难以维持正常的生长,因而影响整个生物量,所以摇床转速以160 r/min左右为宜。
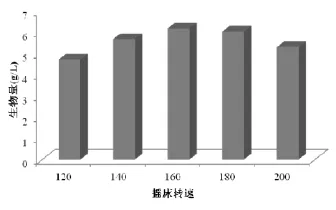
图3 药瓶转速对生物量的影响Fig.3Effects of shaking speed on biomass
2.2.4 pH值、温度、摇床转速正交试验
为考察不同发酵条件对菌丝体生长的影响,在单因素试验基础上,试验选pH值、温度、转速等3因素,进行L9(33)正交试验,在参考已知文献及前期试验的基础上,以生物量为评价指标,优化液态深层发酵工艺。按照表1设计的正交实验,考察了不同发酵条件对蝉花菌丝体的生长的影响,结果示于表2。由此得出优选实验方案为A2B2C2。摇床转速与溶氧浓度有关。溶氧对菌丝体生长有影响。由于氧在水中的溶解度很小,因此氧往往成为发酵过程的限制性因素。摇床转速慢,氧在发酵液中的溶解度就小,在发酵进入对数期后,易造成溶氧不足,影响了菌丝体的生长;摇床转速快,增加了溶氧量。温度对菌丝体的生长具有重要影响,25℃时菌丝体生长迅速,最后得到的生物量高。pH影响代谢过程中各种酶的活性,pH=7.0有利于菌体的生长。
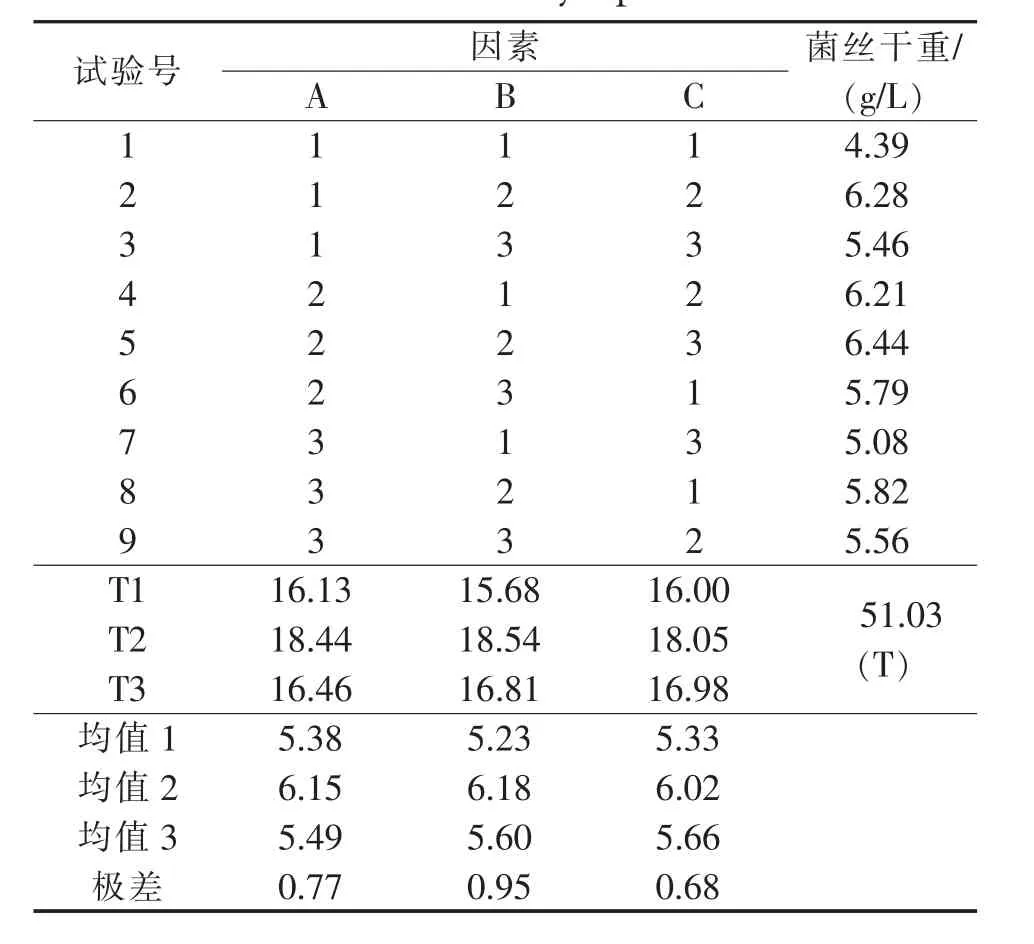
表2 冬虫夏草液态深层发酵正交试验结果与分析Table 2 Results and analysis of orthogonal experiment design in submerged fermentation conditions of Cordyceps sinensis
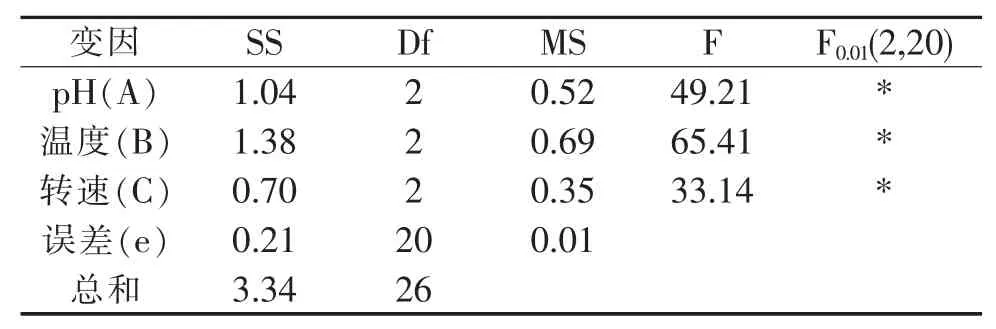
表3 方差分析Table 3Analysis of variance
从以上的方差分析可知,各因素对蝉花菌丝体生成量的影响大小顺序为A(温度)>B(pH)>C(转速),三个因素对结果的影响有统计学意义。最终确定冬虫夏草菌丝体的富硒量的最佳工艺条件为A2B2C2,即pH值为7,温度25℃,转速为160 r/min。
2.3 最佳工艺验证试验
在单因素和正交试验优化的基础上,进行验证试验。结果表明,在培养5 d的条件下,蝉花菌液态深层发酵最优工艺参数:装液量100 mL,pH值7.0,摇床频率为160 r/min,温度25℃。此时蝉花发酵生物量为6.57 g/L。
3 结论
通过对蝉花菌丝体发酵条件的优化研究,发现其工艺的优化是一个非常复杂的动态过程,影响其结果的因素也很多,通过单因素试验和正交试验取得了较好的效果,结合方差分析得到反应条件的最佳点,在此条件下,蝉花发酵生物量为6.57 g/L。本试验找出了蝉花菌丝的最佳发酵条件,为以后的研究提供了一定的基础,今后可进一步选育出优良的蝉花菌株应用到发酵生产中。
[1]Takano F,Yahagi,Yahagi N,et al.The liquid culture filtrates of Paecilomyces tenuipes(Peck)Samson(=Isaria japonica Yasuda)and Paecilomyces cicadae(Miquel)Sam son(=Isaria sinclairii(Berk.)Llond)regulate Th1 and Th2 cytokine response in murine Peyer s'patch cells in vitro and ex vivo[J].Int Immunopharmacol,2005,5(5): 903-916.
[2]杨介钻,金丽琴,吕建新,等.多糖对环磷酰胺处理大鼠生长及外周血的影响[J].贵阳医学院学报,2003,8(5): 389-392.
[3]杨介钻,金丽琴,吕建新,等.蝉拟青霉多糖对大鼠免疫功能的调节作用[J].中国病理生理杂志,2005,21(3):588-591.
[4]王砚,赵小京,唐法娣.蝉花药理作用的初步探讨[J].浙江中医杂志,2001,36(9):219-220.
[5]Majtan J,Kogan G,Kovacova E,et al.Stimulation of TNF-alpha release by fungal cell wall polysaccharides[J].Z Naturforsch,2005,60(11-12):921-926.
[6]Liu J J,Huang T S,Hsu M L,et a1.Antitum or effects of the partially purified polysaccharides from A Antrod iacam phorata and the mechanism of its action[J].Toxicol Appl Pharmacol,2004,201(2):186-193.
[7]陈柏坤,杨介钻,卓佳,等.蝉拟青霉多糖对人外周血单个核细胞及白血病细胞株U 937、K562增殖的调节作用[J] .温州医学院学报,2006,36(4):341-344.
[8]王琳,陈以平.人工培育蝉花菌丝对人系膜细胞增殖及细胞外基质合成的影响[J].中医研究,2006,19(10):9-11.
[9]宋捷民,忻家础,朱英.蝉花对小鼠血糖及造血功能影响[J].中华中医药学刊,2007,25(6):1144-1145.
[10]刘广玉,胡菽英.天然蝉花和人工培养品镇静镇痛作用的比较[J].现代应用药学,1991,8(2):5.
[11]杨介钻,金丽琴,吕建新,等.蝉拟青霉多糖抗衰老作用的实验研究[J].中国老年学杂志,2007,4(24):343-344.
[12]杨介钻,卓佳,陈柏坤,等.蝉拟青霉多糖对老年大鼠免疫功能的调节作用[J].中国中药杂志,2008,33(3):292-295.
[13]陈玲,宋捷民.蝉花的研究进展[J].中国中医药科技, 2009,16(2):159-160.
[14]Smith J E,Rowan N J,Sullivan R.Medicinal mushrooms:a rapidly developing ales of biotechndogy for cancer therapy and other bioactivities[J].Biotechnol Lett,2002,24:1839-1845.
[15]Raham B G,Berger R G.High fungi for generating aroma components through novel biotechnologies[J].J Aric Food Chem,1994,42:2344-2348.
[16]Wasser S P.Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides[J].App Microbiol Biotechnol,2002,60:258-274.
Study on Separation and Fermentation Culture of Strain of Cordyceps Cicadae
CHEN Xian-qun1,YANG Yue2,YANG Sheng-li2
(Wenzhou Food Research Institute,Wenzhou,Zhejiang 325000,China;The College of Pharmaceutical Science,Zhejiang University of Technology,Hangzhou,Zhejiang 310014,China)
Objective:The strain isolated from Cordyceps cicadae and its fermentation culture were studied,mycelia yield was investigated by submerge fermentation.Methods:Single factor examination and orthogonal experiment design were used to investigate the effects of pH,temperature,shaking speed on the biomass of the Cordyceps cicadae.Results:The optimal fermentation conditions:initial pH 6.0,shaking speed 160 r/min,fermentation temperature 25℃.Conclusion:The biomass of Cordyceps cicadae is 34.98 g/L under the optimized fermentation process.
Cordyceps cicadae;submerged fermentation;isolation
1006-4184(2015)2-0018-04
2014-07-04
陈显群(1965-),男,高级工程师,研究方向为食品营养。E-mail:wzspyjs@163.com。
*通讯作者:杨胜利(1972-),男,副教授,博士,研究方向为微生物制药。E-mail:yangshengli01@zjut.edu.cn。

