弥漫大B细胞淋巴瘤骨髓侵犯的瘤细胞形态与临床参数分析
刘 敏,井昶雯
(江苏省肿瘤医院1.检验科,2.临床肿瘤研究中心,江苏南京210009)
弥漫大B细胞淋巴瘤骨髓侵犯的瘤细胞形态与临床参数分析
刘 敏1,井昶雯2
(江苏省肿瘤医院1.检验科,2.临床肿瘤研究中心,江苏南京210009)
目的:探讨弥漫大B细胞淋巴瘤(diffuse 1arge B-ce11 1ymphoma,DLBCL)骨髓侵犯瘤细胞的形态与临床及实验室特征。方法:收集107例DLBCL的临床资料,回顾性分析患者的临床特征、实验室指标及骨髓细胞形态学和流式细胞术(FCM)的检测资料。结果:107例DLBCL患者中17例(15.9%)有骨髓侵犯,其中9例为高度异形瘤细胞,8例为低度异形瘤细胞。与低度异形组比较,高度异形组具有多种不良预后因素,包括较晚的临床分期、增高的乳酸脱氢酶及国际预后指数。FCM诊断出的高度、低度异形淋巴瘤骨髓侵犯病例分别为3例(3/9)、8例(8/8);骨髓涂片诊断出的病例分别为9例(9/9)、1例(1/8)。结论:DLBCL高度异形瘤细胞骨髓侵犯与多种预后不良因素密切相关;FCM诊断低度异形DLBCL骨髓侵犯的敏感性高于骨髓涂片,骨髓涂片对高度异形淋巴瘤侵犯的诊断率高于FCM。两种方法联合应用可有效提高DLBCL骨髓侵犯的诊断。
弥漫大B细胞淋巴瘤;骨髓侵犯;细胞形态学;流式细胞术
弥漫大B细胞淋巴瘤(diffuse 1arge B-ce11 1ymphoma,DLBCL)是临床最多见的侵袭性非霍奇金淋巴瘤,约占后者的40%,该病的进展可发生骨髓侵犯,侵犯中的瘤细胞形态各异,多数为与病理诊断一致的高度异形大细胞,部分为低度异形的小细胞,而低度异形小细胞与DLBCL细胞的形态特征并不符合,在单纯依靠形态学诊断时容易被漏诊。有研究表明,小细胞型的DLBCL可能从低度恶性淋巴瘤发展而来[1],因此两种形态迥异瘤细胞骨髓侵犯患者的临床特征、预后可能存在较大的差异。为此我们对我院107例DLBCL病例资料进行了回顾性分析。
1 材料与方法
1.1 病例
回顾性分析2013年1月至2014年12月本院收治的107例DLBCL病例资料,所有病例均有明确的病理诊断。其中,男48例,女59例,年龄27~82岁(中位年龄57岁)。所有患者均抽取了骨髓穿刺液。
1.2 骨髓涂片细胞学检验
骨髓涂片经瑞氏-姬姆萨染色后,在显微镜下分类计数200个有核细胞,根据勇氏法判断标准[2],将淋巴瘤细胞≥5%诊断为骨髓侵犯,≥20%诊断为淋巴瘤白血病。对涂片中<5%的疑似淋巴瘤细胞,高度异形的判断为骨髓侵犯,低度异形的细胞为不确定。
1.3 骨髓细胞的流式细胞术(FCM)检测
将1 mL骨髓经EDTA-2K抗凝,制备单细胞悬液,加入4色荧光标记的CD45及B系抗原CD19、CD20、CD22、CD25、CD5、CD23、CD10、FMC7、CD103、κ/λ(均为BD公司产品)染色,使用ACCURI C6流式细胞仪(美国BD公司),以CD45侧向散射角(SSC)设门,根据胞体大小及颗粒度确定异常细胞群;分析10 000个细胞,用Ce11 Quest软件计算各细胞抗原的阳性百分率,以标记细胞数>20%确定为阳性[3],并结合临床和病理分型确定是否有淋巴瘤骨髓侵犯。
1.4 数据收集
记录患者的年龄、性别、病理诊断及分型(生发中心或非生发中心)、瘤细胞增殖活性(Ki-67)、Ann Arbor-Cotswo1ds临床分期、国际预后指数(IPI)、ECOG体能状态评分。实验室数据包括乳酸脱氢酶、血红蛋白水平、血小板计数、白细胞计数;并对骨髓侵犯病例中的瘤细胞进行分类:根据淋巴瘤细胞大小及异形性将瘤细胞分两组,低度异形组(与DLBCL形态特征不一致):细胞大小近似于正常的淋巴细胞,核染色质轻度浓集、胞质量少,部分可有隐约的核仁;高度异形组(中度-高度合并,与DLBCL形态特征一致):胞体中等或明显增大,胞核为正常淋巴细胞核的2倍以上,核类圆或畸形,核染色质粗粒状,有数个核仁,胞质深染。分析骨髓中瘤细胞的形态与临床特征、实验室参数及流式细胞术检测结果的关系。
1.5 统计学处理
应用SPSS 13.0统计软件包进行数据处理,总体率的比较采用Fisher确切概率法,计量资料以(±s)表示,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 骨髓侵犯瘤细胞形态与临床及实验室特征比较
107例患者中有17例(15.9%)发生骨髓侵犯。17例DLBCL骨髓侵犯患者中,高度异形瘤细胞9例,低度异形瘤细胞8例。瘤细胞形态与临床及实验室特征的比较见表1。临床特征比较结果显示,高度异形组临床分期晚于低度异形组(P=0.029),IPI明显高于低度异形组(P=0.015),两组瘤细胞起源(生发中心与非生发中心)、瘤细胞增殖活性(Ki-67比例)均无明显差异(P>0.05)。
实验室检查结果显示,高度异形组乳酸脱氢酶均增高,均值为(803.6±251.2)U/L,约为低度异形组的3倍[(256.7±47.28)U/L,t=5.087,P= 0.000];血小板计数降低及白细胞计数异常仅见于高度异形组,其血小板均值[(77.00±17.55)× 109/L]明显低于低度异形组[(223.5±30.70)× 109/L,t=4.265,P=0.001];贫血多见于高度异形组,2组血红蛋白均值差异无统计学意义[高度异形组(94.222±12.26)g/L,低度异形组(121.25± 6.35)g/L,t=1.887,P=0.079]。见表1。
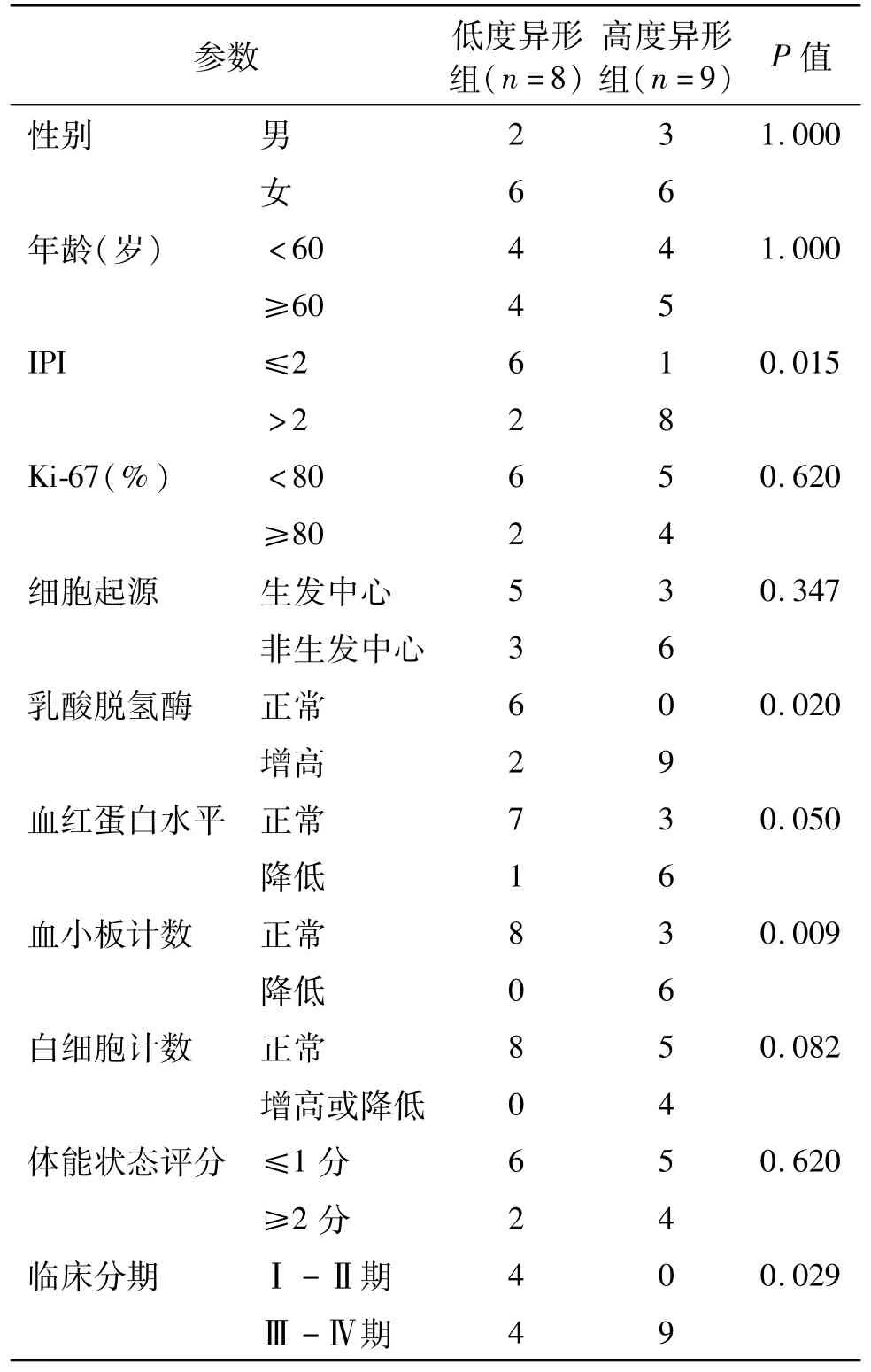
表1 17例DLBCL骨髓侵犯瘤细胞形态与临床及实验室特征比较
2.2 瘤细胞形态与流式细胞检测相关性
17例骨髓侵犯病例中,经骨髓涂片获得诊断的9例高度异形瘤细胞侵犯病例中,FCM诊断3例骨髓侵犯(表达B系相关抗原、κ/λ限制性表达),6例阴性(表达B系相关抗原、κ/λ限制性表达阴性)。8例低度异形瘤细胞中,FCM检测均为骨髓侵犯,骨髓涂片诊断只有1例骨髓侵犯,其余7例诊断为阴性或不确定。两种方法检测结果不一致的病例有12例,部分不一致病例细胞形态及对应的流式细胞术检测结果见图1。
3 讨论
弥漫大B细胞淋巴瘤为弥漫性增生的大细胞恶性肿瘤,细胞形态差异大,形态学存在多种变异,即中心母细胞、免疫母细胞、富于T细胞/组织细胞型及大细胞型4种变异型,瘤细胞核相当于组织细胞或正常淋巴细胞的2倍。骨髓涂片中的瘤细胞因缺乏组织结构及免疫组化,在实际工作中无法准确区分这些变异型,通常将瘤细胞大致分为高度异形的大细胞和低度异形小细胞。高度异形的瘤细胞符合DLBCL的瘤细胞形态特征,与病理诊断一致;而低度异形的瘤细胞近似于正常的淋巴细胞,与DLBCL瘤细胞形态特征不符,近年来许多研究对此不一致性进行了报道[1,4-5],多数淋巴结中的瘤细胞为大细胞型,而骨髓侵犯中的瘤细胞为小细胞型,极个别病例与之相反。目前,这种不一致的机制尚未阐明。Con1an等[6]认为此类病例可能从慢性淋巴细胞白血病/小B细胞淋巴瘤、滤泡性淋巴瘤以及边缘区淋巴瘤等低度恶性淋巴瘤发展而来,另外,淋巴结组织有大小不同的淋巴瘤细胞存在于不同的解剖部位,因此不一致的低度异形瘤细胞可能并非原发,与一致性的高度异形瘤细胞具有不同的发病机制[7]。
本组107例DLBCL中有17例有骨髓侵犯,累及率与多数报道一致[8-9]。侵犯组与未侵犯组在临床分期、血小板计数间有明显差异,其他特征无明显差别。侵犯组中低度异形的小细胞8例,占总侵犯组47%(8/17),与Baiyee等[9]的报道相近。与低度异形组比较,高度异形组具有多种预后不良因素,包括较晚的临床分期、增高的乳酸脱氢酶及IPI。1例低度异形瘤细胞已达白血病的诊断标准,但其乳酸脱氢酶只有171 U/L,进一步说明低度异形DLBCL特征更倾向于低度恶性淋巴瘤,与DLBCL高度侵袭性特征不符。

A、B:骨髓涂片见高度异形的瘤细胞,FCM表达B系相关抗原(CD19+、CD20+)、CD10-、κ/λ不表达或非限制性表达;C、D:骨髓涂片见近似正常细胞的低度异形瘤细胞,FCM表达B系相关抗原(CD19+、CD20+)、CD10-、κ/λ限制性表达图1 骨髓涂片、FCM检测结果不一致的DLBCL细胞形态及流式细胞检测结果
骨髓涂片和FCM是诊断淋巴瘤骨髓侵犯常用方法。本研究结果显示,这两种方法在不同形态的瘤细胞检测中敏感性不同。DLBCL的免疫表型无特征,免疫球蛋白轻链(κ/λ)限制性表达是诊断B系异常克隆存在的敏感标志。本研究17例骨髓侵犯病例中,8例低度异形瘤细胞均表现为κ/λ限制性表达,9例高度异形淋巴瘤只有3例κ/λ限制性表达。研究表明[10-12],κ、λ双链不表达可能与瘤细胞基因表达缺陷相关,外周成熟B细胞免疫球蛋白轻链的失表达往往预示瘤细胞高度恶性,而在B系淋巴瘤中双链的失表达以DLBCL最为多见。DLBCL细胞κ/λ非限制表达可能与病例中瘤细胞量少相关,即反应性细胞产生的多克隆轻链与少量瘤细胞产生的单克隆轻链混合影响瘤细胞轻链的实际比例,出现假性非限制表达的结果。此外,在FCM样本处理过程中高度异形的瘤细胞易破碎也是其假阴性的原因之一。与骨髓涂片诊断结果比较,17例侵犯病例中,FCM不一致性诊断结果多达12例。由于低度异形瘤细胞形态类似于正常淋巴细胞,与DLBCL形态特征不符,在骨髓涂片中极易被漏检。本组8例低度异形淋巴瘤病例经骨髓涂片诊断为骨髓侵犯的只有1例,该例低度异形细胞数为25%,已达淋巴瘤白血病的诊断标准,其余7例低度异形细胞数<5%,诊断为阴性或不确定,因此低度异形瘤细胞的诊断主要依靠FCM检测。但FCM在高度异形瘤细胞的检测中不如骨髓涂片敏感,总之两种方法的联合检测有利于骨髓侵犯的诊断。
DLBCL骨髓侵犯不仅表现在细胞形态的差异,且瘤细胞的侵犯模式也不一致。有研究发现[6]骨髓组织活检中大细胞型的淋巴瘤常呈结节、弥漫间质分布,而小细胞型的常呈小梁旁分布,且瘤细胞侵犯范围也小于大细胞型,而小梁旁侵犯的瘤细胞常与纤维组织包裹,不易被抽吸,这也间接解释了涂片中低度异形瘤细胞量少的原因。
综上所述,DLBCL骨髓侵犯中瘤细胞形态差异大,免疫表型特征不明显,骨髓侵犯的诊断应在细胞形态学的基础上结合流式细胞术等综合判断。高度异形瘤细胞侵犯病例与多种预后不良因素相关,而低度异形的DLBCL临床特征更倾向于低度恶性淋巴瘤。
[1] Chung R,Lai R,Wei P,et a1.Concordant but not discordant bone marrow invo1vement in diffuse 1arge B-ce11-1ymphoma predicts a poor c1inica1 outcome independent of the Internationa1 Prognostic Index[J].B1ood,2007,110(4):1278-1282.
[2] 勇威本,魏淑敏,庞玉滨.100例恶性淋巴瘤骨髓侵犯的观察[J].北京医学,1981,3(6):327-329.
[3] Zeppa P,Marino G,Troncone G,et a1.Fine-need1e cyto1-ogy and f1ow cytometry immunophenotyping and subc1assification of non-Hodgkin 1ymphoma:a critica1 review of 307 cases with technica1 suggestions[J].Cancer,2004,102(1):55-65.
[4] Campbe11 J,Seymour JF,Matthews J,et a1.The prognostic impact of bone marrow invo1vement in patients with diffuse 1arge ce11 1ymphoma varies according to the degree of infi1tration and presence of discordant marrow invo1vement[J].Eur J Haemato1,2006,76(6):473 -480.
[5] Hodges GF,Lenhardt TM,Cote1ingam JD.Bone marrow invo1vement in 1arge-ce11 1ymphoma.Prognostic imp1ications of discordant disease[J].Am J C1in Patho1,1994,101(3):305-311.
[6] Con1an MG,Bast M,Armitage JO,et a1.Bone marrow invo1vement by non-Hodgkin′s 1ymphoma:the c1inica1 significance of morpho1ogic discordance between the 1ymph node and bone marrow.Nebraska Lymphoma Study Group[J].J C1in Onco1,1990,8(7):1163-1172.
[7] Kremer M,Spitzer M,Mand1-Weber S,et a1.Discordant bone marrow invo1vement in diffuse 1arge B-ce11 1ymphoma:comparative mo1ecu1ar ana1ysis revea1s a heterogeneous group of disorders[J].Lab Invest,2003,83(1):107-114.
[8] Kim S,Kim H,Kang H,et a1.C1inica1 significance of cytogenetic aberrations in bone marrow of patients with diffuse 1rge B-ce11 1ymphoma:prognostic significance and re1evance to histo1ogic invo1vement[J].J Hemato1 Onco1,2013,6:76.
[9] Baiyee D,Warnke R,Natkunam Y.Lack of uti1ity of CD20 immunohistochemistry in staging bone marrow biopsies for diffuse 1arge B-ce11 1ymphoma[J].App1 Immunohistochem Mo1 Morpho1,2009,17(2):93-95.
[10] Tomita N,Takeuchi K,Hyo R,et a1.Diffuse 1arge B ce11 1ymphoma without immunog1obu1in 1ight chain restriction by f1ow cytometry[J].Acta Haemato1,2009,121(4):196-201.
[11] Ohmoto A,Maeshima AM,Taniguchi H,et a1.Histopatho1ogica1 ana1ysis of B-ce11 non-Hodgkin 1ymphomas without 1ight chain restriction by using f1ow cytometry[J].Leuk Lymphoma,2015,1-5.[Epub ahead of print].
[12] Ka1eem Z,Zehnbauer BA,White G,et a1.Lack of expression of surface immunog1obu1in 1ight chains in B-ce11 non-Hodgkin 1ymphomas[J].Am J C1in Patho1,2000,113(3):399-405.
R733
B
1671-7783(2015)06-0536-04
10.13312/j.issn.1671-7783.y150227
2015-10-04 [编辑] 陈海林

