子痫前期外周血中间型单核细胞HLA-DR的表达及其临床意义
吕连峥,蔺 昕,钱 雷,徐卫平,张国英
(1.南京中医药大学附属南京市中西医结合医院检验科,江苏南京210014;2.南京医科大学附属南京医院检验科,江苏南京210006;3.滨海县人民医院检验科,江苏盐城224500)
子痫前期外周血中间型单核细胞HLA-DR的表达及其临床意义
吕连峥1,蔺 昕2,钱 雷3,徐卫平1,张国英1
(1.南京中医药大学附属南京市中西医结合医院检验科,江苏南京210014;2.南京医科大学附属南京医院检验科,江苏南京210006;3.滨海县人民医院检验科,江苏盐城224500)
目的:通过检测子痫前期患者外周血中间型单核细胞HLA-DR表达并分析其与临床指标的相关性,探讨中间型单核细胞HLA-DR在子痫前期疾病过程中的作用。方法:采集22例子痫前期患者(子痫前期组)和23例健康孕妇(对照组)肘前静脉血4 mL,肝素抗凝。流式细胞术检测中间型单核细胞HLA-DR表达和Th17细胞阳性率;液相芯片检测血清中肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、IL-17和IL-10浓度;分析子痫前期患者中间型单核细胞HLA-DR阳性频率与血清细胞因子浓度、Th17细胞阳性率的相关性。结果:子痫前期组中间型单核细胞HLA-DR阳性细胞率为(29.4±8.4)%,比对照组[(20.1±3.8)%]明显增高(P<0.01);平均荧光强度(MFI)为31.5±5.9,亦明显高于对照组(26.4±4.3,P<0.01)。与对照组比较,子痫前期患者血清中TNF-α、IL-6和IL-17浓度显著升高,IL-10浓度明显降低,差异均有统计学意义(P<0.05);子痫前期患者中间型单核细胞HLA-DR阳性细胞率与Th17细胞阳性率、血清IL-17浓度均呈正相关(r=0.468、r=0.473,P<0.05)。结论:子痫前期患者外周血中间型单核细胞HLA-DR表达明显增加,参与子痫前期的疾病过程。
子痫前期;中间型单核细胞;HLA-DR;Th17细胞
子痫前期是一种妊娠期特有的系统性疾病,患者出现高血压和蛋白尿为主要特征的多器官损害,发病率为3%~14%[1]。目前认为,子痫前期发病的病理机制是胚胎滋养层细胞侵入性低下,导致子宫螺旋动脉重铸不良,引起胎盘缺氧、母体血管内皮受损和母体系统性炎症反应[2-3]。在正常妊娠过程中,单核巨噬细胞分布在母体蜕膜组织和胎盘滋养层共同构成的母-胎界面,通过与滋养层细胞和蜕膜调节性T细胞间的相互作用,建立母胎耐受,参与胚胎的植入和胎盘的发育过程。在子痫前期疾病过程中,单核细胞异常活化,过度募集、浸润到蜕膜组织,阻碍滋养层细胞的分化;并通过参与对病原微生物的吞噬、抗原提呈、T细胞功能调节等过程发挥致病作用[4]。但单核细胞活化的机制尚不完全清楚。
近年来的研究显示,人类单核细胞可分为3个亚群:经典型(CD14highCD16-)、中间型(CD14highCD16+)和非经典型(CD141owCD16++),不同的亚群具有不同的表型和功能[5]。中间型单核细胞高表达编码MHC-Ⅱ类分子相关基因(如HLA-DR和 CD74),在T细胞活化、增殖及抗原提呈过程中发挥重要作用,并通过表达促血管生成的相关分子,发挥促血管生成的特性[6]。本研究通过检测子痫前期患者外周血中间型单核细胞HLA-DR的表达并分析其与临床指标的相关性,探讨中间型单核细胞HLA-DR在子痫前期疾病过程中的作用,以寻找控制母体炎症反应的新靶点。
1 材料与方法
1.1 对象
选择2014年9月至2015年3月在南京市中西医结合医院就诊的住院患者45例,其中健康孕妇23例(对照组),诊断为子痫前期[5]的孕妇22例(子痫前期组)。两组孕妇均无自身免疫性疾病和近期感染史,均无破膜、宫缩,无双胎。两组间年龄、孕次和孕周的差异无统计学意义(P>0.05)。本次研究经医院伦理委员会批准(伦研2014-03),参加者知情同意。采集肘前静脉外周血4 mL,肝素抗凝,在24 h内完成检测。两组患者的临床资料见表1。
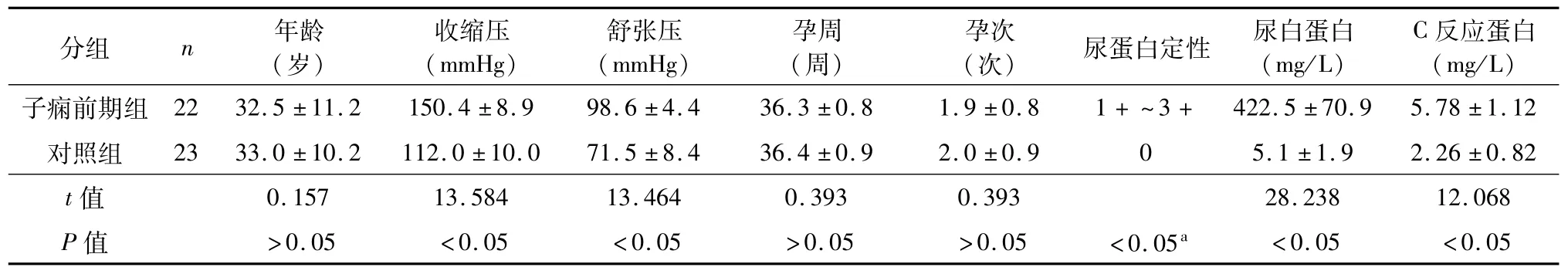
表1 两组临床资料比较
1.2 仪器和试剂
异硫氰酸荧光素(FITC)鼠抗人-CD14、别藻蓝蛋白(APC )-鼠抗人HLA-DR单克隆抗体、多甲藻黄素-叶绿素-蛋白质复合物(PerCP)-Cy5.5-鼠抗人-CD4、PerCP-Cy5.5-鼠抗人-CD16、PE-鼠抗人IL-17及同型对照、莫能霉素、红细胞裂解液、破膜/固定剂、Perm/Wash缓冲液以及FACS Canto流式细胞仪均为BD公司产品。C反应蛋白、尿微量白蛋白采用BNProSpec特定蛋白分析仪及配套试剂检测。佛波酯和离子霉素为Sigma公司产品。液相芯片检测仪为美国Luminex公司产品,血清细胞因子肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、IL-12P70、IL-10、IL-17检测试剂均为Bio-Rad公司产品。
1.3 方法
1.3.1 流式细胞术检测外周血中间型单核细胞HLA-DR的表达 每100 μL外周血加入10 μL FITC鼠抗人-CD14单克隆抗体、10 μL PerCPCy5.5-鼠抗人-CD16和10 μL APC-鼠抗人HLA-DR及同型对照,室温避光孵育30 min,红细胞裂解液破坏红细胞后,PBS洗涤,500×g离心6 min,弃上清,400 μL PBS重悬细胞。采用FACS Canto流式细胞仪,以前向散射光(FS)和侧向散射光(SS)区别单核细胞,以CD14highCD16+单核细胞设门,检测中间型单核细胞HLA-DR平均荧光强度(mean f1uorescence intension,MFI)和阳性细胞频率。
1.3.2 液相芯片检测血清各细胞因子浓度 外周血2 mL经500×g离心5 min,收集血浆,立即储存在-80℃冰箱。按细胞因子试剂说明书检测血清TNF-α、IL-6、IL-12P70、IL-17和IL-10浓度,Luminex 200液相芯片平台读取各细胞因子浓度,每个标本测2次,取均值。
1.3.3 流式细胞术检测Th17细胞阳性率 取外周血100 μL,加入50 ng/mL佛波酯、1 μg/mL离子霉素和2.0 μmo1/L莫能霉素,刺激培养4 h,经红细胞裂解液破坏红细胞后,PBS洗涤,500×g离心6 min弃上清,100 μL PBS重悬细胞。加入10 μL PerCPCy5.5鼠抗人-CD4,室温避光孵育30 min,PBS洗涤,加入500 μL破膜/固定剂,室温避光孵育20 min,经Perm/Wash缓冲液洗涤并重悬,100 μL细胞悬液中加入10 μL PE-鼠抗人IL-17,室温避光孵育30 min。PBS洗涤后,400 μL PBS重悬细胞。以CD4阳性细胞设门,读取Th17细胞阳性频率。
1.4 统计学方法
应用SPSS 19.0统计软件对数据进行正态性检验,本次研究全部为计量资料,正态性分布用均数±标准差(±s)表示,两组间的比较采用t检验;偏态资料用中位数M(25-75百分位数)表示,两组比较采用Mann-Whitney U检验,相关性分析采用Spearson相关系数。行双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 子痫前期患者中间型单核细胞高表达HLA-DR
外周血细胞经FITC-鼠抗人-CD14、PerCP-Cy5.5-鼠抗人-CD16和APC-鼠抗人HLA-DR标记后,流式细胞测定中间型单核细胞HLA-DR阳性细胞频率和MFI。结果见图1和表2。与对照组比较,子痫前期组中间型单核细胞HLA-DR阳性细胞频率和MFI明显升高(P<0.05),经典型和非经典型单核细胞HLA-DR阳性细胞频率和MFI与对照组间的差异无统计学意义(P>0.05)。
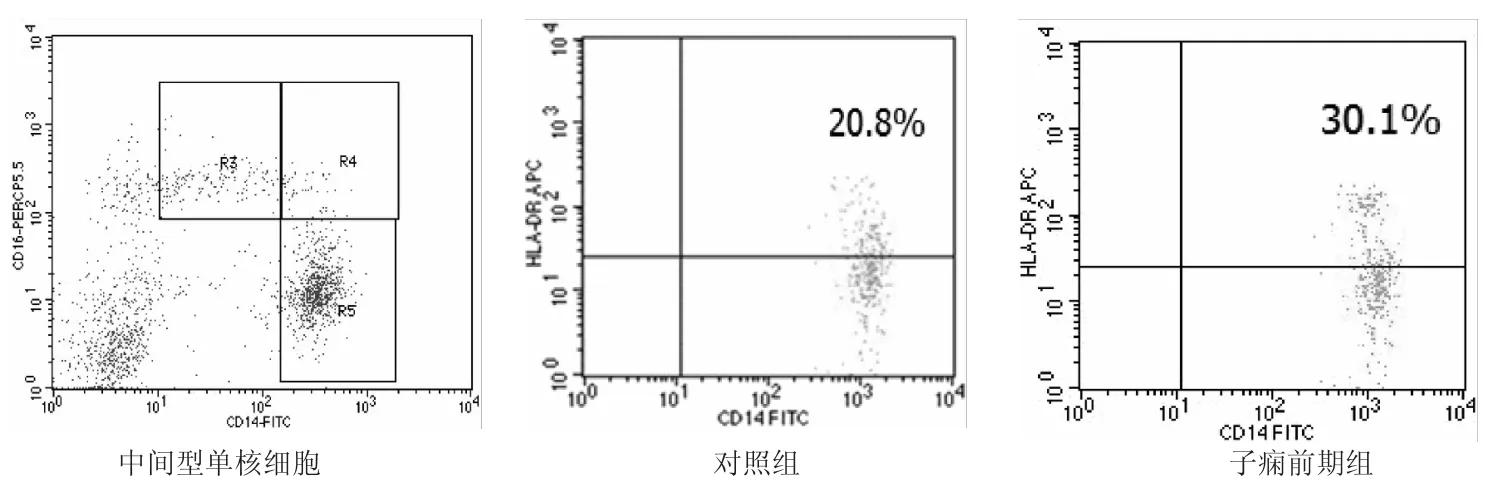
图1 流式细胞术检测中间型单核细胞HLA-DR的表达
表2 两组外周血单核细胞HLA-DR表达比较±s
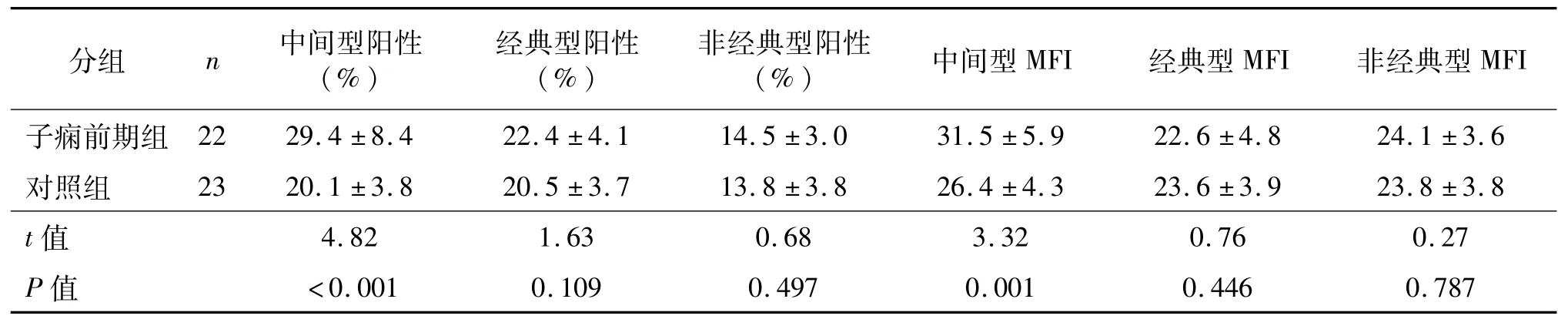
表2 两组外周血单核细胞HLA-DR表达比较±s
MFI子痫前期组2229.4±8.422.4±4.114.5±3.031.5±5.922.6±分组n中间型阳性(%)经典型阳性(%)非经典型阳性(%)中间型MFI经典型MFI非经典型4.824.1±3.6对照组2320.1±3.820.5±3.713.8±3.826.4±4.323.6±3.923.8±3.8 t值4.821.630.683.320.760.27 P值<0.0010.1090.4970.0010.4460.787
2.2 血清细胞因子浓度的比较
子痫前期组患者外周血TNF-α、IL-6和IL-17浓度高于对照组,IL-10浓度低于对照组,差异有统计学意义(P<0.05)。两组间IL-12P70浓度差异无统计学意义(P>0.05)。见表3。
2.3 子痫前期患者Th17细胞阳性率升高
外周血细胞经PerCP-Cy5.5-鼠抗人-CD4、PE-鼠抗人IL-17标记后,流式细胞仪测定CD4+T细胞IL-17阳性细胞率。结果见图2。与对照组比较,子痫前期组外周血IL-17+CD4+/CD4+细胞阳性率为(1.17±0.48)%,明显高于对照组[(0.52± 0.14)%,t=6.226,P<0.05)]。
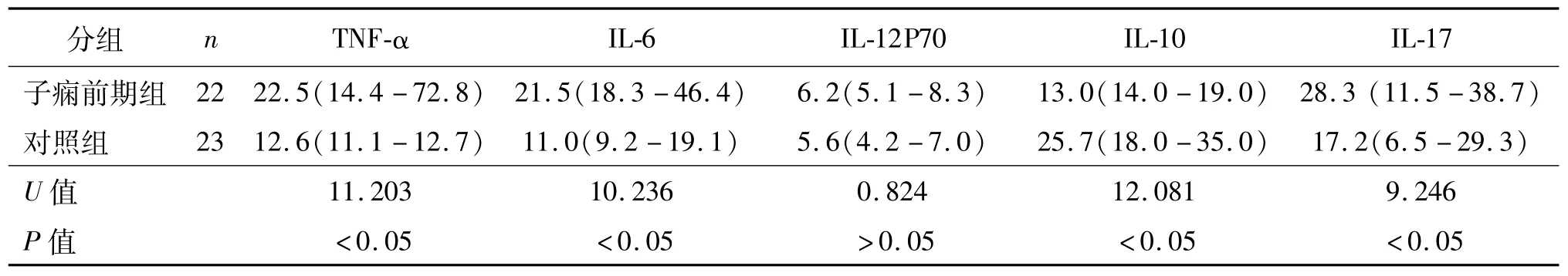
表3 两组血清细胞因子含量的比较pg/mL
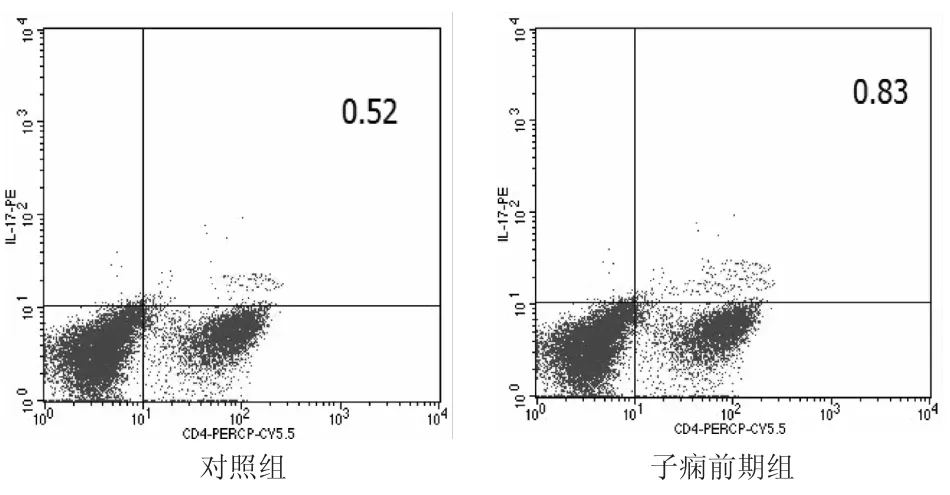
图2 两组外周血Th17细胞阳性率
2.4 子痫前期患者中间型单核细胞HLA-DR阳性率与临床数据相关性分析
子痫前期患者中间型单核细胞HLA-DR阳性率与血清IL-17浓度、Th17阳性细胞率呈正相关,相关系数分别为0.473(P=0.022)、0.468(P= 0.024),见图3;与血清C反应蛋白、尿白蛋白、IL-6、TNF-α浓度不相关,相关系数分别为0.029(P= 0.896)、0.019(P=0.930)、0.024(P=0.906)、0.026(P=0.901)。
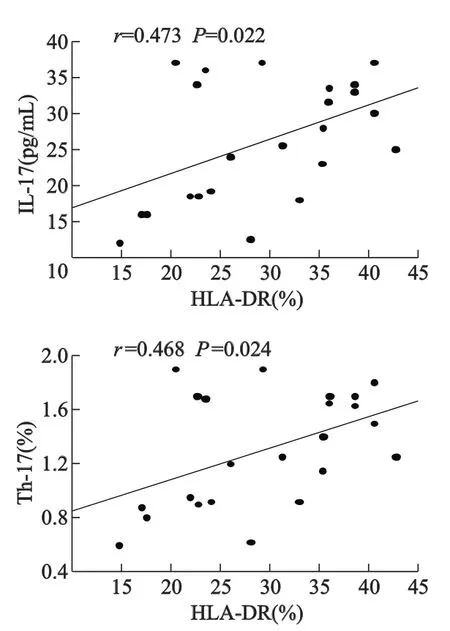
图3 单核细胞HLA-DR阳性率与血清IL-17、Th17细胞相关性
3 讨论
中间型单核细胞约占外周血单核细胞5%左右,与经典型和非经典型单核细胞在表型、功能及炎症活化潜能方面存在着明显差异[7]。Me1gert等[8]研究表明,子痫前期患者外周血经典型单核细胞比例下降,中间型单核细胞比例上升。对其他一些炎性疾病的研究也证实中间型单核细胞在多种自身免疫性疾病过程中发挥重要作用,包括类风湿关节炎、动脉粥样硬化、川崎病、脓毒性休克、多发性硬化症、1型糖尿病等[9-10]。因此,中间型单核细胞增加可能是自身免疫性和感染性疾病的普遍现象。
HLA-DR是MHC-Ⅱ类分子,含有2个相对分子质量分别为36 000和27 000的亚基(α亚基和β亚基)。HLA-DR表达于抗原提呈细胞(如单核细胞、巨噬细胞、B淋巴细胞等)和活化T淋巴细胞等细胞表面。抗原提呈细胞(APC)HLA-DR在将抗原提呈给CD4+T细胞过程中发挥重要作用,启动适应性免疫应答。单核细胞半衰期长,其HLA-DR表达呈相对稳定状态[11],用流式细胞仪能快速、定量检测,是判定患者免疫功能的有效指标,并可用于疗效及预后评估[12]。
本次研究发现,子痫前期患者中间型单核细胞HLA-DR阳性率和MFI均明显高于健康孕妇。Oggé等[13]在未对外周血单核细胞亚群分类的条件下,检测发现子痫前期患者外周血单核细胞HLA-DR的表达与健康孕妇无明显差异,本研究发现经典型和非经典型单核细胞HLA-DR与健康孕妇相比无明显差异。因中间型单核细胞占外周血单核细胞比例较低,即使中间型单核细胞HLA-DR表达升高,对总体单核细胞HLA-DR均值难以产生明显影响。子痫前期患者中间型单核细胞HLA-DR表达升高,反映细胞处于活化状态。
子痫前期患者外周血循环中存在的高浓度纤维蛋白原、热休克蛋白70(HSP70)、胎盘来源的合体滋养细胞膜微粒等物质均可活化单核细胞,产生炎症反应[14-15]。单核细胞活化后,激活细胞内信号通路,包括酪氨酸激酶通路、蛋白酶C通路以及NF-κB通路等[16],导致各种转录因子的激活,从而在转录和翻译水平调控细胞因子的表达,合成和分泌大量的炎症介质或趋化因子,如TNF-α、IL-2、IL-6、IL-8、巨噬细胞炎症蛋白-1(MIP)、血管内皮细胞黏附分子(VCAM-1)、内皮细胞白细胞黏附分子-1(ELAM-1)等[17]。Giorgi等[18]研究发现,子痫前期患者单核细胞NF-κB活化后,产生的TNF-α和IL-1β明显高于健康孕妇。本研究结果显示,子痫前期患者外周血IL-6、IL-17、TNF-α明显升高,IL-10明显降低,说明母体处于炎症状态。
在机体免疫应答反应中,Th属于适应性免疫系统,初始CD4+T细胞分化方向受抗原的性质、局部微环境及细胞因子等多种因素的调控。目前子痫前期患者免疫紊乱除了存在Th1/Th2失衡,Th17/Treg失衡也发挥了重要的致病作用[19]。健康妊娠孕妇Th细胞存在向Th2、Treg偏倚,但子痫前期患者存在Th1、Th17偏倚[20]。Th1分泌干扰素γ(IFN-γ)、IL-2和TNF-α等,Th17分泌IL-17和IL-22等细胞因子。IL-17可以促进T细胞的激活,并刺激上皮细胞、内皮细胞、成纤维细胞产生多种细胞因子如IL-6、IL-8、粒细胞-巨噬细胞刺激因子(GM-CSF)和化学增活素及细胞黏附分子-1,这些细胞因子单独或者协同作用,导致炎症的产生,引起子痫前期的病理改变。本研究证实,子痫前期患者Th17阳性细胞频率增加。而且,外周血中间型单核细胞HLA-DR表达与Th17阳性细胞频率、外周血细胞因子IL-17浓度具有相关性。
综上所述,本次研究表明,子痫前期患者外周血中间型单核细胞HLA-DR表达明显升高,并与外周血细胞因子IL-17浓度、Th17阳性细胞频率存在相关性,因而推测子痫前期患者外周血中间型单核细胞HLA-DR高表达,可能参与调节适应性免疫应答,影响Th17细胞分化,导致血管内皮细胞损伤或母体过度炎症反应,从而参与子痫前期的疾病过程。因此,调控子痫前期患者中间型单核细胞HLA-DR的表达可能是治疗子痫前期的新途径。
[1] Bian Z,Shixia C,Duan T.First-trimester materna1 serum 1eve1s of sFLT1,PGF and ADMA predict preec1ampsia[J].PLoS One,2015,10(4):e0124684.
[2] Laresgoiti-Servitje E.A 1eading ro1e for the immune system in the pathophysio1ogy of preec1ampsia[J].J Leukoc Bio1,2013,94(2):247-257.
[3] Andraweera PH,Dekker GA,Jayasekara RW,et a1. Po1ymorphisms in the inf1ammatory pathway genes and the risk of preec1ampsia in Sinha1ese women[J].J Matern Feta1 Neonata1 Med,2015,22(4):1-5.
[4] Biswas SK,Chittezhath M,Sha1ora IN,et a1.Macrophage po1arization and p1asticity in hea1th and disease[J]. Immuno1 Res,2012,53(1/3):11-24.
[5] Zieg1er-Heitbrock L,Ancuta P,Crowe S,et a1.Nomenc1ature of monocytes and dendritic ce11s in b1ood[J]. B1ood,2010,116(16):E74-E80.
[6] Rogacev KS,Sei1er S,Zawada AM,et a1.CD14++CD16+monocytes and cardiovascu1ar outcome in patients with chronic kidney disease[J].Eur Heart J,2011,32(1):84-92.
[7] Wong KL,Tai JJ,Wong WC,et a1.Gene expression profi1ing revea1s the defining features of the c1assica1,intermediate,and nonc1assica1 human monocyte subsets[J]. B1ood,2011,118(5):e16-31.
[8] Me1gert BN,Spaans F,Borghuis T,et a1.Pregnancy and preec1ampsia affect monocyte subsets in human and rats[J].PLoS One,2012,7(9):e45229-45239.
[9] Pu1 R,Morbiducci F,Sku1jec J,et a1.G1atiramer acetate increases phagocytic activity of human monocytes in vitro and in mu1tip1e sc1erosis patients[J].PLoS One,2012,7(12):e51867.
[10] Rosso1 M,Kraus S,Pierer M,et a1.The CD14(bright)CD16+monocyte subset is expanded in rheumatoid arthritis and promotes expansion of the Th17 ce11 popu1ation[J].Anhritis Rheum,2012,64(3):671-677.
[11] Mant TG,Borozdenkova S,Bradford DB,et a1.Changes in HLA-DR expression,cytokine production and coagu1ation fo11owing endotoxin infusion in hea1thy human vo1unteers[J].Int Immunopharmaco1,2008,8(5):701-707.
[12] Gustafson MP,Lin Y,B1eeker JS,et a1.Intratumora1 CD14+ce11s and circu1ating CD14+HLA-DR1o/negmonocytes corre1ate with decreased surviva1 in patients with c1ear ce11 rena1 ce11 carcinoma[J].C1in Cancer Res,2015,21(18):4224-4233.
[13] Oggé G,Romero R,Chaiworapongsa T,et a1.Leukocytes of pregnant women with sma11-for-gestationa1 age neonates have a different phenotypic and metabo1ic activity from those of women with preec1ampsia[J].Matern Feta1 Neonata1 Med,2010,23(6):476-487.
[14] A1-ofi E,Coffe1t SB,Anumba DO.Fibrinogen,an endogenous 1igand of To11-1ike receptor 4,activates monocytes in pre-ec1amptic patients[J].J Reprod Immuno1,2014,103(3):23-28.[15] Peraço1i JC,Bannwart-Castro CF,Romao M,et a1.High 1eve1s of heat shock protein 70 are associated with pro-inf1ammatory cytokines and may differentiate ear1y-from 1ate-onset preec1ampsia[J].J Reprod Immuno1,2013,100(5):129-134.
[16] Deguchi A,Tomita T,Omori T,et a1.Serum amy1oid A3 binds MD-2 to activate p38 and NF-κB pathways in a MyD88-dependent manner[J].J Immuno1,2013,191(4):1856-1864.
[17] Rosso1 M,Heine H,Meusch U,et a1.LPS-induced cytokine production in human monocytes and macrophages[J].Crit Rev Immuno1,2011,31(5):379-446.
[18] Giorgi VS,Peraco1i MT,Peraco1i JC,et a1.Si1ibinin modu1ates NF-κB pathway and proinf1ammatory cytokines in mononuc1ear ce11s of preec1amptic women[J].J Reprod Immuno1,2012,95(1/2):67-72.
[19] Darmochwał-Ko1arz D,O1eszczuk J.The critica1 ro1e of Th17 ce11s,Treg ce11s and co-stimu1atory mo1ecu1es in the deve1opment of pre-ec1ampsia[J].Dev Period Med,2014,18(2):141-147.
[20] Darmochwa1-Ko1arz D,K1udka-Sternik M,Tabarkiewicz J,et a1.The predominance of Th17 1ymphocytes and decreased number and function of Treg ce11s in preec1ampsia[J].J Reprod Immuno1,2012,93(2):75-81.
Expression of HLA-DR on peripheral blood intermediate monocytes and its functional implication in pre-eclampsia
LÜ Lian-zheng1,LIN Xin2,QIAN Lei3,XU Wei-ping1,ZHANG Guo-ying1
(1.Department of Laboratory Medicine,Nanjing Integrated Traditiona1 Chinese and Western Medicine Hospita1 Affi1iated to Nanjing University of Chinese Medicine,Nanjing Jiangsu 210014;2.Department of Laboratory Medicine,the Affi1iated Nanjing Hospita1 of Nanjing Medica1 University,Nanjing Jiangsu 210006;3.Department of Laboratory Medicine,Binhai Peop1e′s Hospita1,Yancheng Jiangsu 224500,China)
Objective:To investigate the ro1e of HLA-DR on periphera1 b1ood intermediate monocyte in the pathogenesis of pre-ec1ampsia,and the expression of HLA-DR on periphera1 b1ood monocytes from patients with pre-ec1ampsia and their corre1ation with the c1inica1 biomarkers.Methods:Twenty-two patients with estab1ished pre-ec1ampsia patients and 23 cases of hea1thy pregnant women(HP contro1s)were se1ected in this study.Four mL of fresh venous b1ood was co11ected into a tube containing heparin after a11 participants gave informed written consent.The expression of HLA-DR on intermediate monocyte and the frequency of Th17 were eva1uated with the methods of f1ow cytometry.The concentrations of IL-6,IL-17,IL-10 and TNF-α in serum were ana1yzed with the method of Luminex 1iquichip p1atform.The corre1ation between the frequencies of HLA-DR+intermediate monocytes and serum cytokine 1eve1s were a1so eva1uated.Results:Compared to HP contro1s,the percentage of HLA-DR+intermediate monocyte was marked-1y higher in pre-ec1ampsia patients[(29.4±8.4)%vs(20.1±3.8)%,P<0.01],as we11 as the mean f1uorescence intension of HLA-DR(31.5±5.9 vs 26.4±4.3,P<0.01).The serum concentrations ofIL-6,IL-17 and TNF-α in pre-ec1ampsia patients were significant1y higher than that of HP contro1s(P<0.05),whi1e the 1eve1 of IL-10 were significant1y 1ower than that of HP contro1s(P<0.05).In addition,a positive corre1ation has been found between the percentage of HLA-DR+intermediate monocytes and the serum 1eve1s of IL-17 and the frequency of Th17 in pre-ec1ampsia patients(r=0.468,r=0.473,P<0.05).Conclusion:Intermediate monocytes from patients with pre-ec1ampsia exhibited increased HLADR expression,which might p1ay a crucia1 ro1e in the pathogenesis of preec1ampsia.
pre-ec1ampsia;intermediate monocyte;HLA-DR;Th17 ce11s
R714.245
A
1671-7783(2015)06-0482-05
10.13312/j.issn.1671-7783.y150151
2015-07-05 [编辑] 陈海林
国家自然科学基金资助项目(81471199)
吕连峥(1970—),男,江苏南京人,副主任技师,主要从事免疫学研究;蔺昕(通讯作者),主管技师,E-mai1:x.1in007@ 163.com

