间充质干细胞对系统性红斑狼疮患者树突状细胞的免疫抑制作用
裘影影,何建强,汤 郁,李 晶
(江苏大学附属医院1.风湿科,2.肾内科,江苏镇江212001)
间充质干细胞对系统性红斑狼疮患者树突状细胞的免疫抑制作用
裘影影1,何建强2,汤 郁1,李 晶1
(江苏大学附属医院1.风湿科,2.肾内科,江苏镇江212001)
目的:探讨间充质干细胞(mesenchyma1 stem ce11s,MSCs)在体外对系统性红斑狼疮(systemic 1upus erythematosus,SLE)患者外周血单核细胞来源树突状细胞(dendritic ce11s,DC)免疫功能的影响。方法:从人骨髓中分离培养MSCs,采用流式细胞仪(FCM)分析鉴定MSCs的纯度。分离SLE患者外周血单核细胞,用重组人粒—巨噬细胞集落刺激因子(rhGM-CSF)、重组人白细胞介素4(rhIL-4)诱导培养DC的同时加入MSCs共培养,设立MSCs处理组,MSCs未处理组。在第7天收集细胞,流式细胞术检测两组DC表面CD 1a,CD14的表达。SLE患者的不成熟DC与MSCs共同培养加入终浓度为50 ng/mL的重组人肿瘤坏死因子-α(rhTNF-α)48 h后收集细胞,流式细胞术检测两组DC表面CD86、CD83、HLA-DR的表达。分别将MSCs处理或未处理的DC和T淋巴细胞共培养,72 h后用MTT法检测DC刺激淋巴细胞增殖的能力。结果:与对照组相比,MSCs处理组DCs表面CD1a、CD86、CD83以及HLA-DR表达明显下降(P<0.01),CD14表达明显增高,对淋巴细胞的刺激能力明显减弱(P<0.01)。结论:MSCs可能通过抑制SLE患者DC的发育、成熟和功能的途径,抑制SLE患者的免疫反应。
间充质干细胞;系统性红斑狼疮;树突状细胞;免疫调节
间充质干细胞(mesenchyma1 stem ce11s,MSCs)是具有多向分化潜能的一类干细胞,具有免疫调节等功能[1]。细胞免疫应答时,环境中的可溶性外来抗原不能直接触发T淋巴细胞,而是由抗原递呈细胞(antigen-presenting ce11,APC)以特定方式呈递给T淋巴细胞。树突状细胞(dendritic ce11s,DC)作为一类专职性APC,是刺激T淋巴细胞最强的、唯一能激活初始T淋巴细胞的APC。
系统性红斑狼疮(systemic 1upus erythematosus,SLE)是一种累及多系统、多器官的自身免疫性疾病,主要以T、B淋巴细胞高度活化,大量自身抗体产生和累及多器官组织为特点[2]。SLE患者体内高度活化的T、B细胞功能的异常多继发于DC功能的缺陷,因此DC在SLE的发病中起重要作用[3]。研究表明MSCs可以抑制髓系或单核细胞来源的DC成熟,对DC具有免疫抑制作用[4]。目前MSCs对SLE患者DC影响的报道较少,本实验主要探讨MSCs对SLE患者外周血单核细胞来源DC免疫功能的影响。
1 材料与方法
1.1 材料与仪器
Perco11(质量浓度1.073 g/mL)为Pharmacia公司产品,RPMI 1640、胎牛血清及低糖-DMEM(Gibco公司),淋巴细胞分离液(Fico11,1.077 g/mL)购于上海恒信试剂公司,藻红蛋白(PE)或异硫氰酸荧光素(FITC)标记的鼠抗人HLA-DR、CD86、CD83、CD1a、CD14、CD34、CD45、CD105、CD29、CD44单克隆抗体及相应的同型对照抗体(美国e Bioscience公司)。重组人粒—巨噬细胞集落刺激因子(rhGM-CSF)、重组人白细胞介素4(rhIL-4)、重组人肿瘤坏死因子-α(rhTNF-α)均为R&D公司产品。流式细胞仪(美国BD公司,FACSC a1ibur),紫外可见光扫描酶标仪(美国Bio-TEK公司,MQX200)。
1.2 病例
本实验选取初发SLE患者10例,为我科2011年1月至2014年12月住院患者,均为女性,年龄16~54(33.10±11.33)岁。患者入院前均未使用糖皮质激素和免疫抑制剂,均符合1997年由美国风湿病学会推荐的SLE分类标准且SLE活动指数(SLEDAI评分)≥10分。
1.3 方法
1.3.1 MSCs的分离、培养及鉴定 采集成人健康志愿者骨髓10 mL,以Perco11梯度离心,吸取中间单个核细胞层,用PBS洗2次,以2×105/cm2的密度接种于含10%胎牛血清的低糖DMEM培养瓶中,在37℃、5%CO2培养箱中培养24 h。去除悬浮的细胞,每隔3 d换液,当有90%的贴壁细胞层融合时,以0.25%胰蛋白酶消化传代培养,取第3代MSCs,分别与CD14、CD105、CD29、CD34、CD45、CD44单克隆抗体及同型单抗孵育20 min,PBS洗涤后,经流式细胞仪检测,第3代的MSCs经鉴定和确定纯度后冻存于液氮罐中备用。
1.3.2 DC的诱导、培养及鉴定 ①无菌抽取SLE患者外周静脉血20 mL并采用肝素抗凝,Fico11密度梯度离心法收获单个核细胞(2 000 r/min,20 min),PBS液洗涤2次(1 500 r/min,5 min)。②用含10%胎牛血清的RMPI-1640培养基重悬细胞,3×106/孔接种于24孔培养板中,37℃、5%CO2培养箱中孵育2 h后吸去非贴壁细胞,轻轻洗涤2次,加入含rhIL-4 10 ng/mL,rhGM-CSF 20 ng/mL的10%胎牛血清的RMPI-1640培养基1 mL,37℃、5%CO2培养箱中孵育,第3天、第5天各吸弃0.3 mL,加入含等量rhIL-4、rhGM-CSF的新鲜培养基0.5 mL。③部分细胞第7天加入rhTNF-α(50 ng/mL)促其成熟,第9天收获悬浮细胞。加入FITC/PE标记的鼠抗人CD1a、CD14、CD83、CD86、HLA-DR单克隆抗体,流式细胞仪鉴定。
1.3.3 MSCs对SLE患者单核细胞来源DC分化的影响 在培养第0天,经20 Gy照射的MSCs与SLE患者单核细胞共培养,二者的数量比例为1∶10。分为MSCs处理组和MSCs未处理组。诱导体系为含rhGM-CSF(20 ng/mL),rhIL-4(10 ng/mL)和10%胎牛血清的RPMI-1640。诱导3 d后半量换液,在第7天收集细胞,标记荧光抗体,流式细胞仪检测两组DC表面CD1a、CD14的表达,观察MSCs对SLE患者单核细胞来源DC分化的影响。
1.3.4 MSCs对rhTNF-α刺激SLE患者DC成熟的影响 在rhGM-CSF、rhIL-4诱导体系下培养7 d的SLE患者的不成熟DC中,加入终浓度为50 ng/mL的rhTNF-α,与经20 Gy照射的MSCs共同培养,MSCs与DC数量比例为1∶10,作为MSCs处理组。同时设立MSCs未处理组。各组继续培养48 h后收集细胞,流式细胞仪检测两组DC表面HLA-DR、CD83、CD86和CD1a的表达。
1.3.5 MSCs对成熟DC刺激的淋巴细胞增殖的影响 效应细胞:按上述方法分离的外周血单个核细胞,贴壁2 h后吸取悬浮细胞,调整细胞密度为2× 106/mL作为效应细胞。刺激细胞:SLE患者的不成熟DC,加入终浓度为50 ng/mL的rhTNF-α,与经20 Gy照射的MSCs共同培养获得成熟的DC,MSCs与DC数量比例为1∶10,分为MSCs处理组和MSCs未处理组。成熟的DC经20 Gy照射后调整细胞密度为2×105/mL作为刺激细胞。96孔板中每孔加入刺激细胞和效应细胞各100 μL,每组各设3个复孔,共培养72 h,在培养结束前4 h向各孔中分别加入MTT(5 mg/mL),培养结束后250×g离心5 min,弃上清,向各孔中加入二甲基亚砜,静置10 min,以紫外可见光扫描酶标仪检测各孔570 nm的光密度(D)值。
1.4 统计学处理
应用SPSS 18.0软件进行统计分析,百分率数据经平方根反正弦转换,计量数据用均数±标准差(±s)表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 MSCs的分离培养和鉴定
MSCs培养3 d左右可见单个分散存在的克隆,呈现80%融合的时间为7~10 d,第3代MSCs形态均一,呈长梭形。流式细胞仪检测第3代MSCs,均为CD44、CD29、CD105阳性,CD14、CD45、CD34阴性,纯度鉴定达到了90%以上。
2.2 MSCs不能被诱导分化为DC
由于MSCs具有多向分化的潜能,我们首先观察体外诱导DC的培养体系是否能诱导照射后的MSCs分化为DC。结果见图1,在rhGM-CSF和rhIL-4作用7 d后,未发现MSCs表达CD14、CD1a、CD83、CD86。镜下观察仍然为贴壁的成纤维样细胞,说明在此条件下MSCs不能被诱导分化为DC。
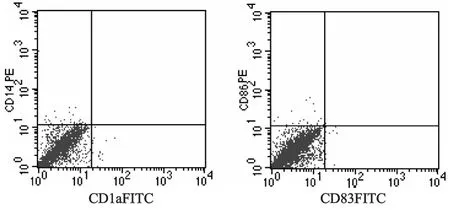
图1 流式细胞术检测MSCs向树突状细胞分化情况
2.3 DC的鉴定结果
SLE患者外周血单个核细胞贴壁2 h后,获得的贴壁细胞为单核细胞,在含细胞因子的血清培养体系中诱导培养外周血单核细胞。随着培养时间延长,细胞逐渐变大,第7天大部分细胞半悬浮生长,相对特异的表面分子CD1a表达率为(61.60±9.91)%。加入rhTNF-α刺激48 h促进DC成熟后细胞边缘有明显突起,细胞毛刺增多,细胞表面抗原HLA-DR表达率为(87.57±5.91)%、共刺激分子CD86表达率为(91.30±4.12)%,成熟标志CD83的表达率为(45.66±7.27)%。见图2,图3。
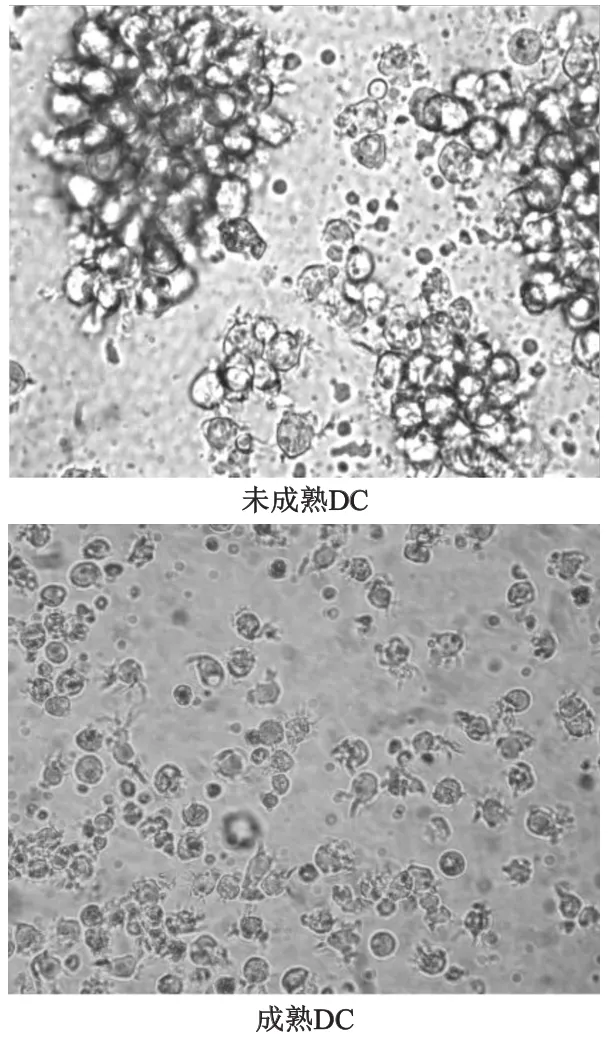
图2 SLE患者单核细胞来源树突状细胞的形态
2.4 MSCs抑制SLE患者单核细胞来源DC的分化
SLE患者单核细胞在rhGM-CSF和rhIL-4的诱导条件下与MSCs共同培养7 d后,与MSCs未处理组相比,MSCs处理组的DC细胞体积虽然变大,但未见明显毛刺(图4);流式细胞术检测结果显示,MSCs处理组CD1a的表达率为(11.12±5.50)%,较MSCs未处理组的(61.60±9.91)%明显下降(t=-14.08,P<0.01);MSCs处理组CD14的表达率为(47.46±4.65)%,较MSCs未处理组的(1.08±0.27)%明显升高(t=31.47,P<0.01)。见图5。说明在MSCs存在的情况下,SLE患者大部分单核细胞没有分化为DC。
2.5 MSCs抑制SLE单核细胞来源DC的成熟
SLE患者单核细胞用rhGM-CSF和rhIL-4培养7天获得不成熟的DC,在rhTNF-α存在的条件下,将其与MSCs共同培养2 d后收集细胞,流式细胞术检测结果发现,MSCs处理组DC较MSCs未处理组DC表面标志物CD86、CD83、HLA-DR的表达均显著降低(P<0.01),提示MSCs能抑制SLE患者未成熟DC的成熟(图6)。
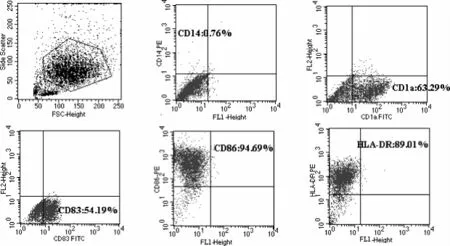
图3 流式细胞术检测树突状细胞的细胞表型

图4 MSCs共同培养的树突状细胞形态

图5 不同培养条件对树突状细胞表型的影响
2.6 MSCs抑制成熟DC刺激同种异体淋巴细胞的增殖
MTT法检测结果表明,MSCs处理组淋巴细胞D值为0.313±0.050,较MSCs未处理组的0.873± 0.048明显降低(t=24.12,P<0.01)。说明经MSCs处理后,SLE患者DC刺激淋巴细胞增殖的能力明显下降。

*:P<0.01,与MSCs未处理组比较图6 MSCs抑制树突状细胞的成熟
3 讨论
SLE主要特征是体内存在大量的自身抗体,这些抗体的产生依赖于T淋巴细胞[5],而T淋巴细胞的激活及分化又依赖于APC。DC是目前认为作用最强的APC,它可以通过递呈抗原肽MHC复合物的作用激活T淋巴细胞,DC和抗原信号及炎症因子共同决定了初始CD4+T淋巴细胞向Th1或Th2分化[6]。SLE患者体内过量的自身反应性T淋巴细胞可能是由DC异常信号传递所诱导的,因此目前认为DC异常是SLE发病机制之一[7]。
MSCs具有低免疫原性,体内外实验均证实MSCs具有较强的免疫抑制作用[8],但其中的作用途径和机制目前不是很明确。由于MSCs具有多向分化的潜能,我们首先检测了在加入rhGM-CSF和rhIL-4的情况下,经直线加速器照射的MSCs能否被诱导分化为DC,结果提示MSCs不能被诱导分化为DC。
为了探讨MSCs是否通过对免疫始动者DC的调节作用来抑制SLE患者T淋巴细胞的增殖,我们进行了MSCs对SLE患者单核细胞来源DC功能影响的实验,结果显示,MSCs对SLE患者DC的发育、成熟和功能均有负调控作用。MSCs可以使DC刺激淋巴细胞增殖的能力显著下降;在DC的分化阶段,MSCs可以明显抑制SLE患者单核细胞向DC的分化,抑制DC上CD1a表达的上调,使其丧失摄取抗原的能力;在DC成熟阶段,MSCs可以显著抑制共刺激分子CD86、抗原呈递分子HLA-DR和成熟标志物CD83的表达。Ger1等[9]发现在SLE活动期,DC的表面标志如CD83、HLA-DR明显增高,提示SLE患者DC分化和T、B淋巴细胞分化均异常增加;同时DC表面的共刺激分子CD86也明显增高。CD86是APC表面提供协同刺激信号的重要分子,它调节着T淋巴细胞的增殖反应及效应功能,因此认为CD83、CD86、HLA-DR与SLE发病及进展具有密切关系。MSCs可能通过抑制SLE患者DC共刺激分子的表达、抑制DC的成熟和抗原递呈能力,进而抑制特异性T淋巴细胞的免疫活性,因此MSCs有诱导SLE免疫耐受的可能。
我们同时发现将DC和MSCs共培养时DC突触数量减少,这可导致DC表面积减小,引起MHC-Ⅱ类分子不能充分发挥其捕获抗原和提呈的作用,导致了DC免疫效应的下降。
综上,MSCs可以抑制SLE患者DC的分化、成熟,抑制DC刺激异体淋巴细胞增殖,从而推断MSCs可能是通过调节DC而抑制T淋巴细胞,进而改变SLE患者的免疫反应。
[1] Wang S,Qu X,Zhao RC,et a1.Mesenchyma1 stem ce11s ho1d promise for regenerative medicine[J].Front Med,2011,5(4):372-378.
[2] Nagy G,Koncz A,Per1 A.T-and B-ce11 abnorma1ities in systemic 1upus erythematosus[J].Crit Rev Immuno1,2005,25(2):123-140.
[3] Mackern-Oberti JP,L1anos C,Vega F,et a1.Ro1e of dendritic ce11s in the initiation,progress and modu1ation of systemic autoimmune diseases[J].Autoimmun Rev,2015,14(2):127-139.
[4] Sadeghi L,Kama1i-Sarvestani E,Azarpira N,et a1.Immunomodu1atory effects of mice mesenchyma1 stem ce11s on maturation and activation of dendritic ce11s[J].Iran J Immuno1,2014,11(3):177-188.
[5] Mou1ton VR,Tsokos GC.T ce11 signa1ing abnorma1ities contribute to aberrant immune ce11 function and autoimmunity[J].J C1in Invest,2015,125(6):2220-2227.
[6] Bri1ot F,Strowig T,Munz C.NK ce11s interactions with dendritic ce11s shape innate and adaptive immunity[J]. Front Biosci,2008,13(17):6443-6454.
[7] Chan VS,Nie YJ,Shen N,et a1.Distinct ro1es of mye-1oid and p1asmacytoid dendritic ce11s in systemic 1upus erythematosus[J].Autoimmun Rev,2012,11(12):890-897.
[8] De Migue1 MP,Fuentes-Ju1ián S,B1ázquez-Martinez A,et a1.Immunosuppressive properties of mesenchyma1 stem ce11s:advances and app1ications[J].Curr Mo1 Med,2012,12(5):574-591.
[9] Ger1 V,Lischka A,Panne D,et a1.B1ood dendritic ce11s in systemic 1upus erythematosus exhibit a1tered activation state and chemokine receptor function[J].Ann Rheum Dis,2010,69(7):1370-1377.
Immunosuppressive effects of mesenchymal stem cells on dendritic cells in systemic lupus erythematosus
QIU Ying-ying1,HE Jian-qiang2,TANG Yu1,LI Jing1
(1.Department of Rheumato1ogy,2.Department of Nephro1ogy,the Affi1iated Hospita1 of Jiangsu University,Zhenjiang Jiangsu 212001,China)
Objective:To investigate the immunoregu1atory effects of mesenchyma1 stem ce11s(MSCs)on periphera1 monocyte-derived dendritic ce11s(DC)in systemic 1upus erythematosus(SLE)patients in vitro. Methods:MSCs were iso1ated and expanded from human bone marrow ce11s.The purity of MSCs was identified by f1ow cytometry(FCM).The monocytes were iso1ated from periphera1 b1ood of SLE patients and cu1-tivated into DC with cytokines such as rhGM-CSF and rhIL-4 for 7 days.Set up the MSCs treated group and MSCs untreated group.Co11ected the ce11s on the 7th day,f1ow cytometry was used to detect the expression of DCs′surface markers CD1a,CD14 in these two groups.The immature DCs of SLE patients were co-cu1-tured with MSCs with adding the rhTNF-α at the fina1 concentration 50 ng/mL.The ce11s were co11ected after 48 hrs.We used f1ow cytometry to check the expression of DCs′surface marker CD86,CD83,HLA-DR in these two groups.The processed or not processed DC by MSCs were co-cu1tivated with T 1ymphocytes respective1y.After 72 hrs the abi1ity of DC stimu1ating 1ymphocytes pro1iferation was detected by MTT.Results:In vitro,compared with contro1 group,expression of CD1a,CD86,CD83 and HLA-DR were significant1y decreased in MSC-treated group(P<0.01),expression of CD14 was significant1y increased(P<0.01),the abi1ity of DC stimu1ating 1ymphocytes pro1iferation was decreased(P<0.01).Conclusion:MSCs can inhibit DC differentiation and function in SLE patients which may p1ay an important ro1e in its immunosuppressive affects in SLE.
mesenchyma1 stem ce11s;systemic 1upus erythmatosus;dendritic ce11s;immunoregu1atory effects
R593.241
A
1671-7783(2015)06-0477-05
10.13312/j.issn.1671-7783.y150142
2015-06-27 [编辑] 何承志
镇江市科技局社会发展项目(SH2012022);江苏大学临床医学科技发展基金资助项目(JLY2010119)
裘影影(1976—),女,江苏镇江人,副主任医师,硕士,主要从事干细胞与自身免疫性疾病的研究;李晶(通讯作者),教授,硕士生导师,E-mai1:11686662@qq.com

