干扰乳酸脱氢酶A表达对肝癌HepG2细胞增殖与迁移的影响
司素华,熊二梦,杜凤仪,彭琬昕,龚爱华
(1.如皋市中医院检验科,江苏如皋226500;2.江苏大学医学院,江苏镇江212013)
干扰乳酸脱氢酶A表达对肝癌HepG2细胞增殖与迁移的影响
司素华1,熊二梦2,杜凤仪2,彭琬昕2,龚爱华2
(1.如皋市中医院检验科,江苏如皋226500;2.江苏大学医学院,江苏镇江212013)
目的:观察靶向乳酸脱氢酶A(1actate dehydrogenase-A,LDHA)的短发夹RNA(short hairpin RNA,shRNA)对肝癌HepG2细胞系的干扰效率及其对细胞增殖与迁移的影响。方法:设计合成LDHA及对照eGFP shRNA序列,克隆至真核表达质粒pLKO.1-TRC,质粒抽提纯化后测序鉴定。重组质粒用脂质体转染肝癌细胞系,采用反转录(RT)-PCR和免疫印迹检测LDHA的表达,验证shRNA的干扰效率。采用CCK-8和克隆形成实验检测干扰LDHA后细胞增殖的变化,划痕实验检测干扰LDHA对细胞迁移的影响。结果:成功构建针对LDHA和对照eGFP的shRNA表达质粒。与转染sh-eGFP组相比,转染sh-LDHA组HepG2细胞中LDHA mRNA和蛋白表达水平明显降低(P均<0.05)。与sh-eGFP组相比,sh-LDHA组72,96 h细胞增殖明显降低,克隆形成数减少,细胞迁移距离短(P均<0.05)。结论:LDHA的干扰质粒能有效干扰LDHA在肝癌HepG2细胞中的表达,明显抑制HepG2细胞的增殖活力和迁移能力。
肝细胞肝癌;乳酸脱氢酶A;RNA干扰
肝细胞肝癌简称肝癌,在世界致死性肿瘤中位居第三,每年死亡人数约70万[1]。由于肝癌患者确诊晚、伴有肝病和缺乏有效的治疗方式,只有30%~40%患者适合治疗[2]。瓦伯格效应(Warburg Effect)是指癌细胞生长很快,使得细胞经常处于一种缺氧状态,于是癌细胞就关闭了线粒体的有氧氧化,通过葡萄糖无氧酵解提供能量的现象。肿瘤细胞依赖糖酵解产生ATP,抑制糖酵解干扰能量代谢治疗肿瘤成为可能[3]。瓦伯格效应的最后一步是丙酮酸经乳酸脱氢酶A(1actate dehydrogenase-A,LDHA)催化转变为乳酸。研究表明LDHA在胰腺癌、胃癌等多种肿瘤中异常表达,与肿瘤发生、进展有关[4]。但LDHA在肝癌细胞中的作用尚不清楚。本研究旨在探讨干扰人肝癌HepG2细胞中LDHA的表达后细胞增殖与迁移的变化。
1 材料与方法
1.1 材料
人肝癌HepG2细胞株购自中国科学院上海细胞库;pLKO.1-TRC环形质粒(美国Addgene公司);DMEM及胎牛血清(美国Gibco公司);LipofectamineTM2000和Stb13感受态细胞(美国Invitrogen公司);细胞计数试剂盒,简称CCK-8(美国Sigma公司);内切酶AgeⅠ、EcoRⅠ和T4连接酶(美国Neb公司);总RNA抽提用Trizo1、RNA反转录试剂盒、PCR试剂盒及胶回收试剂盒(日本TaKaRa公司);质粒大提及小提试剂盒(美国Omega公司);鼠抗人α-微管蛋白抗体、兔抗人LDHA抗体、辣根过氧化物酶标记的羊抗鼠和羊抗人二抗(美国Biowor1d公司);引物及测序由上海生工生物公司完成。
1.2 细胞培养及质粒的瞬时转染
人肝癌细胞HepG2接种于含10%胎牛血清的DMEM中,37℃、5%CO2饱和湿度培养箱中培养。传代24 h后按照LipofectamineTM2000推荐的操作步骤转染质粒。细胞转染24 h后用0.25%胰酶消化,制成单细胞悬液用于后续实验。
1.3 干扰质粒构建
登录www.broad.mit.edu/genome_bio/trc/rnai. htm1网站搜索与pLKO.1质粒相兼容的LDHA shRNA序列,上游序列:5′-CCGGGCCTGTGCCATCAGTATCTTACTCGAGTAAGATACTGATGGCACAGGCTTTTTG-3′,下游序列:5′-AATTCAAAAAGCCTGTGCCATCAGTATCTTACTCGAGTAAGATACTGATGGCACAGGC-3′;对照eGFP shRNA上游序列:5′-CCGGTACAACAGCCACAACGTCTATCTCGAGATAGACGTTGTGGCTGTTGTATTTTTG-3′,下游序列:5′-AATTCAAAAATACAACAGCCACAACGTCTATCTCGAGATAGACGTTGTGGCTGTTGTA-3′,由上海生工合成,按Moffat等[5]报道的方法构建sh-RNA表达载体,构建好的载体经测序确认。
1.4 反转录(RT)-PCR
在转染后48 h Trizo1法提取转染细胞总RNA, RT-PCR检测各组细胞LDHA mRNA的表达,灰度值分析LDHA的干扰效率。LDHA的上游引物为5′-CCAACATGGCAGCCTTTTCC-3′,下游引物为5′-TCACGTTACGCTGGACCAAA-3′,扩增产物片段为149 bp;GAPDH的上游引物为5′-CTCTGCTCCTCCTGTTCGAC-3′,下游引物为5′-GCGCCCAATACGACCAAATC-3′,扩增产物片段为121 bp;PCR反应条件为94℃预变性2 min,然后进入以下28个循环:94℃变性30 s,60℃退火30 s,72℃延伸30 s。循环完毕,72℃延伸5 min。取5 μL扩增产物在2%琼脂糖凝胶中电泳。SmartGe1凝胶成像分析系统成像,Lane 1D Ver 4.0软件进行半定量分析。
1.5 免疫印迹检测蛋白表达
质粒转染72 h后提取蛋白,行10%SDSPAGE,转膜,封闭,洗膜。4℃孵育一抗过夜,LDHA抗体按1∶1 000稀释,α-微管蛋白抗体(内参)按1∶10 000稀释,二抗1∶10 000稀释,室温孵育1 h,用化学发光试剂显示阳性条带,图像分析,每组实验重复3次。
1.6 CCK-8实验
将细胞以1 000个/孔接种于96孔培养板(100 μL/孔),每组6孔,于培养箱培养。于24、48、72、96 h,每孔分别加10 μL CCK-8溶液,培养箱中继续培养2 h后,酶标仪于450 nm波长检测每孔光密度(D)值,记录结果,绘制生长曲线。
1.7 克隆形成实验
细胞以500个/孔接种于6孔板中常规培养,连续培养14 d,经固定、结晶紫染色后,在显微镜下计数,记录含有50个细胞以上的克隆数量。
1.8 划痕实验
细胞以50 000个/孔接种于24孔板中,待接近形成细胞单层时,用10 μL枪头在24孔板内均匀划直线,PBS洗涤3次;加入含1%胎牛血清的培养基继续培养48 h,分别测量0 h和48 h划痕宽度,平均迁移距离=(0 h划痕宽度-48 h划痕宽度)/2。
1.9 统计学处理
应用SPSS 19.0软件进行统计学分析。计量数据用均数±标准差(±s)表示,两组间比较采用t检验;P<0.05为差异有统计学意义。
2 结果
2.1 重组sh-LDHA和sh-eGFP质粒
构建好的干扰质粒sh-LDHA和对照质粒sheGFP经测序确认,与设计完全相符。
2.2 转染干扰质粒后LDHA mRNA和蛋白表达
结果见图1和图2,与sh-eGFP组细胞相比,sh-LDHA组LDHA mRNA表达水平明显降低,下降了76.6%(t=6.045,P<0.05);蛋白表达水平也明显降低,下降了82.6%(t=7.007,P<0.05)。由此表明,LDHA干扰效果明显。

图1 RT-PCR检测LDHA mRNA的表达

图2 蛋白质印迹检测LDHA蛋白的表达
2.3 干扰LDHA后细胞增殖活力和克隆形成能力的改变
如图3所示,干扰HepG2细胞中LDHA的表达,与sh-eGFP组相比,sh-LDHA组细胞增殖逐渐减慢,转染72 h后两组D值差异有统计学意义(t= 5.840,P<0.05),96 h时sh-LDHA组细胞增殖活力受到明显抑制,抑制率为64.5%。

图3 两组HepG2细胞的增殖能力比较
克隆形成实验结果显示(图4),sh-eGFP组克隆数为(429.3±19.8),而sh-LDHA组克隆数为(204.0±10.4),差异有统计学意义(t=18.557,P<0.05),表明干扰LDHA可以明显抑制肝癌细胞增殖。

图4 两组HepG2细胞克隆形成的比较
2.4 下调LDHA表达对细胞迁移能力的影响
划痕实验结果见图5,sh-eGFP组平均迁移距离是(211.3±17.1)μm,而sh-LDHA组平均迁移距离是(83.7±4.9)μm,差异具有统计学意义(t=6. 026,P<0.05),由此表明,干扰LDHA能明显抑制HepG2细胞的迁移能力。
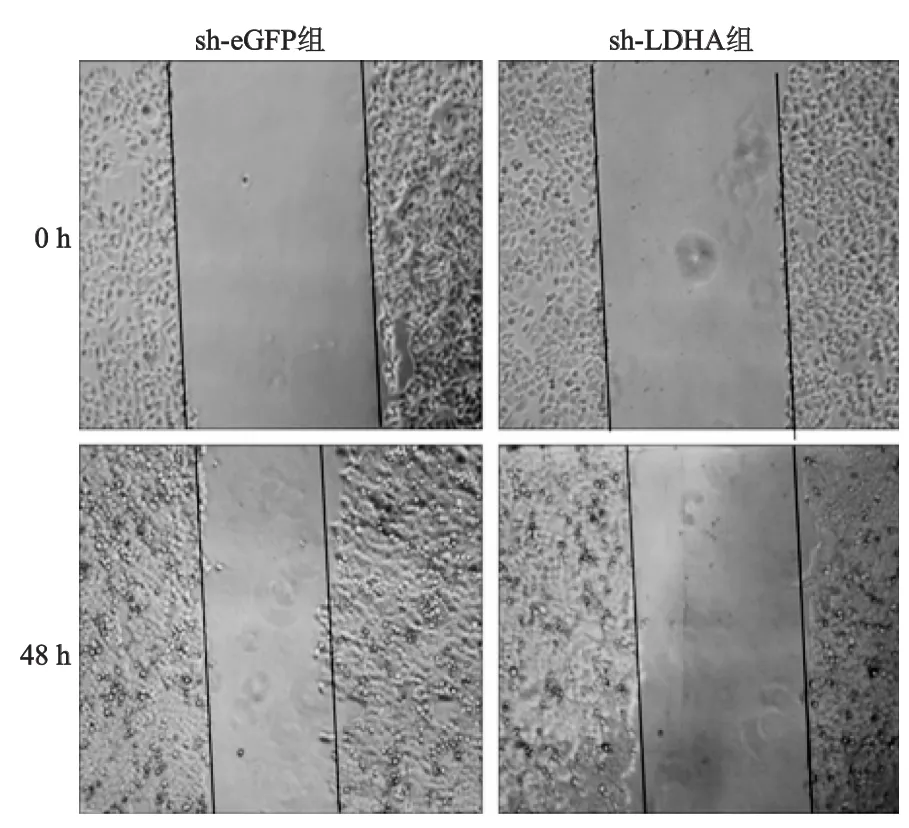
图5 两组HepG2迁移能力的比较
3 讨论
LDHA是糖酵解途径中将丙酮酸转化为乳酸的关键酶,是糖酵解途径的关键检验点,高表达于多种类型的肿瘤,包括淋巴瘤、前列腺癌、肾细胞癌、胰腺癌和黑色素瘤等。LDHA的表达与肿瘤的增殖、维持与侵袭转移密切相关。在小鼠模型的研究中已经表明,肿瘤细胞依赖于LDHA而正常组织细胞依赖于氧化磷酸化,敲除LDHA的小鼠癌旁细胞增殖速率约是癌细胞的100倍,而过表达LDHA则可逆转该增殖抑制[10]。另外,Xie等[11]研究表明LDHA在肺癌A549细胞侵袭转移中起重要作用。因此,抑制LDHA的表达可能限制肿瘤的能量供应,从而抑制肿瘤细胞的增殖和侵袭转移能力。肝癌是发展迅速的实体瘤,肿瘤中存在大片的缺氧区域,同时患者血浆中乳酸活性较健康人异常增强,提示肝癌细胞存在糖酵解活性增强的现象。本研究结果显示,降低LDHA的表达可明显抑制肝癌细胞HepG2的增殖与转移能力,与Rong等[4]报道在胰腺癌中下调LDHA表达可抑制肿瘤增殖活力与转移一致。LDHA遗传缺陷患者只有在剧烈运动后才会出现肌红蛋白尿症[10],因此,在正常情况下抑制LDHA的表达可能不会出现严重不良反应,LDHA有望成为癌症治疗的靶点。
综上,本研究结果显示干扰LDHA后肝癌细胞HepG2的增殖活力及转移能力受到了明显的抑制,但其作用机制尚需进一步研究。
[1] Lee YH,Seo D,Choi KJ,et a1.Antitumor effects in hepatocarcinomaofisoform-se1ectiveinhibitionof HDAC2[J].Cancer Res,2014,74(17):4752-4761.
[2] Bruix J,Sherman M.Management of hepatoce11u1ar carcinoma[J].Hepato1ogy,2005,42(5):1208-1236.
[3] Shaw RJ.G1ucose metabo1ism and cancer[J].Curr Opin Ce11 Bio1,2006,18(6):598-608.
[4] Rong Y,Wu W,Ni X,et a1.Lactate dehydrogenase A is overexpressed in pancreatic cancer and promotes the growth of pancreatic cancer ce11s[J].Tumor Bio1, 2013,34(3):1523-1530.
[5] Moffat J,Grueneberg DA,Yang X,et a1.A 1entivira1 RNAi 1ibrary for human and mouse genes app1ied to an arrayed vira1 high-content screen[J].Ce11,2006,124(6):1283-1298.
[6] 邱嘉斌,何玲.基于瓦博格效应的肿瘤治疗新策略[J].药学进展,2009,33(9):385-395.
[7] Ashrafian H.Cancer′s sweet tooth:the Janus effect of g1ucose metabo1ism in tumorigenesis[J].Lancet,2006,367(9510):618-621.
[8] Gatenby RA,Gi11ies RJ.Why do cancers have high aerobic g1yco1ysis[J].Nat Rev Cancer,2004,4(11):891-899.
[9] 宋奎,许晓军.肿瘤细胞的糖酵解能量代谢机制[J].中国肿瘤临床,2012,39(16):1239-1242.
[10] Miao P,Sheng S,Sun X,et a1.Lactate dehydrogenase A in cancer:a promising target for diagnosis and therapy[J].IUBMB Life,2013,65(11):904-910.
[11] Xie H,Va1era VA,Merino MJ,et a1.LDH-A inhibition,a therapeutic strategy for treatment of hereditary 1eiomyomatosis and rena1 ce11 cancer[J].Mo1 Cancer T-her,2009,8(3):626-635.
Effects of LDHA knockdown on proliferation and migration of HepG2 cells by RNA interference
SI Su-hua1,XI0NG Er-meng2,DU Feng-yi2,PENG Wan-xin2,G0NG Ai-hua2
(1.Department of Laboratory Medicine,Rugao Hospita1 of Traditiona1 Chinese Medicine,Rugao Jiangsu 226500;2.Medica1 Co11ege of Jiangsu University,ZhenJiang Jiangsu 212013,China)
Objective:To exp1ore the pro1iferation and migration effects of 1actate dehydrogenase-A(LDHA)short hairpin RNA(shRNA)on hepatoce11u1ar carcinoma HepG2 ce11s.Methods:LDHA and eGFP shRNA sequences were designed and inserted into pLKO.1-TRC p1asmid.HepG2 ce11s were transfected with the recombinant p1asmids that were identified by sequencing.Reverse transcription(RT)-PCR and Western b1otting were used to eva1uate the si1encing effect,CCK-8 experiment and c1one formation assay for pro1iferation,wound hea1ing assay for migration.Results:In HepG2 ce11s,LDHA shRNA significant1y reduced the expression of LDHA,the efficiency of si1encing were 76.6%and 82.6%on the transcription of LDHA gene and the expression of LDHA protein respective1y.Compared with the sh-eGFP group,sh-LDHA group showed decresed ce11uar vitab1it1y,1ower 1eve1s of the formed c1ones,shorter migration distance(both P<0.05).Conclusion:LDHA shRNA was successfu11y constructed and cou1d effective1y knockdown target gene in HepG2 ce11s.Inhibition of LDHA expression evident1y resu1ted in inhibition of HepG2 pro1iferation and migration.
hepatoce11u1ar carcinoma;1actate dehydrogenase-A;RNA interference
R735.7
A
1671-7783(2015)06-0487-04
10.13312/j.issn.1671-7783.y150180
2015-08-14 [编辑]刘星星
司素华(1979—),男,江苏如皋人,主管检验师,主要从事肿瘤细胞生物学的研究。

