一种可口服使用的壳聚糖季铵盐-紫杉醇纳米粒研制
贺 睿,唐 翠,印春华
(复旦大学 生命科学学院,上海 200438)
口服给药具有使用方便、患者顺应性良好、成本低廉等优势,是一种优选的给药方式[1-2].然而,常用的抗肿瘤化疗药物多属于生物药剂学分类中的Ⅳ类药物(低溶解度、低渗透性药物),诸多问题限制其口服使用[3].紫杉醇(Paclitaxel,PTX)是一种有效的广谱抗肿瘤药物,对乳腺癌、卵巢癌、非小细胞性肿瘤等多种实体瘤具有显著的疗效.但PTX 溶解度低,小肠渗透性差,易受到肠上皮细胞表面P-糖蛋白(Pgp)介导的药物外排及细胞色素P450依赖的药物代谢,口服生物利用度小于10%[1,4].为解决上述问题,国内外学者研究了多种药物递送系统以提高PTX 的口服生物利用度,其中可自组装的聚合物-药物连接物因其可改善难溶性药物的溶解度、控制药物释放、通过口服生理屏障等优点而引起广泛关注[2,4-5].阳离子聚合物壳聚糖季铵盐(N-Trimethyl Chitosan,TMC)生理条件下溶解性好,黏膜黏附性强,可促进小肠转运和吸收,是一种优良的口服递送载体材料.Yin等[6]研究表明分子质量为30ku和200ku,季铵化度为30%的TMC可显著提高胰岛素的小肠转运能力,从而实现其有效口服递送.另外,TMC 含有活性氨基基团,可作为药物的连接位点,制得聚合物-药物连接物.
本文结合了TMC及聚合物-药物连接物的优势,设计并制备了TMC-PTX 纳米粒(TP NPs),用于口服递送PTX.制备分子质量分别为30ku和200ku,季铵化度为30%的TMC,以琥珀酸为连接基团共价连接TMC和PTX,制得聚合物-药物连接物TP,TP在水中可自组装形成TP NPs.研究TP NPs的理化性质、载药与释药、黏膜黏附和促渗透作用.
1 方 法
1.1 材料和动物
壳聚糖,脱乙酰度85%,分子质量分别为30ku和200ku,购自浙江金壳生物化学有限公司;PTX 购自四川西昌制药厂;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl)购自上海源聚生物科技有限公司;N-羟基琥珀酰亚胺(NHS)购自上海源聚生物科技有限公司;罗丹明B(RhB)购自上海国药集团化学试剂公司;其他试剂均为分析纯;实验用水为二次蒸馏水.SD 大鼠,雄性,体重(200±20)g,购自复旦大学实验动物中心.
1.2 TP的制备与表征
参照文献[7]方法制备琥珀酰PTX(PTX-suc).参照Yin 等[6]方法,以30ku 和200ku 壳聚糖制备TMC.称取PTX-suc、NHS和EDC·HCl至高型称量瓶,PTX-suc∶NHS∶EDC·HCl摩尔比为1∶5∶5,加入二甲基亚砜(DMSO)溶解,PTX-suc浓度为1mg/mL,搅拌1h;加入10mg/mL TMC 水溶液,PTX-suc与TMC质量比为1∶5,搅拌12h;以水透析3d(MWCO 3 500u),冷冻干燥.产物以TP(x)命名,其中x 表示壳聚糖分子质量(ku).
以氘水为TMC的溶剂,氘水、氘代DMSO 和氘代三氟乙酸混合液为TP的溶剂,四甲基硅烷(TMS)为内标,AVANCE DMX500型核磁共振仪常温测定样品的核磁共振(1H NMR)图谱.
1.3 粒径、Zeta电势及形态
两亲性TP分散于水中可自组装形成TP纳米粒(TP NPs),Zetasizer Nano-ZS型电位及粒度测定仪测定TP NPs的粒径和Zeta电势.取TP NPs溶液,滴至云母片上,室温自然干燥,黏于铜台,喷金,扫描电镜(SEM)观察其形态.
1.4 临界胶束浓度(CMC)
配制1mg/mL TP NPs溶液,稀释至不同浓度(0.001~0.4mg/mL).量取10μL芘的甲醇溶液(6.0×10-4mol/L),置10mL试管中,吹干.分别量取1mL 上述不同浓度的TP NPs溶液,加至吹干的试管中,超声1h.发射波长为390nm,激发和发射狭缝宽度均为5nm,酶标仪测定各样品激发光谱.以激发波长为335nm 和333nm 处荧光强度的比值I335/I333对lg[C/(mg·mL-1)]作图,计算TP NPs的CMC.
1.5 载药量和体外释放
参照文献[8]方法,精密称取1mg PTX,置10mL 量瓶中,加甲醇溶解,定容至刻度,制得100μg/mL PTX 甲醇溶液;分别精密量取0.2,0.4,0.6,1,1.5,2mL,置10mL量瓶中,加甲醇定容至刻度,摇匀,制得浓度分别为2,4,6,10,15,20μg/mL的PTX 标准溶液,测定227nm 处吸光值,以吸光值对PTX 浓度进行线性回归,制得PTX 标准曲线.配制100μg/mL TP,测定227nm 处吸光值,根据标准曲线计算载药量.
适量TP 分散于水中,制得4 mg/mL TP NPs 溶液,取4 mL TP NPs溶液至透析袋(MWCO 3 500u),以100mL 含0.1%(质量浓度)Tween 80的pH 7.4 磷酸盐缓冲液(PBS)为释放介质,37℃、100r/min振荡温育;分别于设定时间取样0.5 mL,补加0.5 mL 释放介质;样品12 000r/min 离心10min,高效液相色谱法(HPLC)测定PTX 浓度,计算累计释放量.色谱条件:色谱柱Hypersil ODS2柱(中国科学院大连化学物理研究所,200×4.6mm,5μm);流动相为52∶48(体积比)的乙腈∶水;流速为1mL/min;检测波长为227nm;进样量为20μL.
1.6 在体小肠黏附
称取3mg RhB,加1mL pH 4.5HCl溶液溶解,加1.5mg NHS和3mg EDC·HCl,避光搅拌1h;称取0.3g TMC,加9 mL 水溶解,加至RhB 体系中,避光搅拌24h;反应液以水透析3d(MWCO 3 500u),冷冻干燥,得RhB标记的TMC.以RhB标记的TMC替代TMC,按1.2项下方法制备RhB标记的TP NPs.
SD 大鼠,禁食12h,可自由饮水,麻醉后沿腹中线打开腹腔,取约10cm 回肠肠段,生理盐水冲洗至净,两端用手术线结扎成封闭肠环,肠环中注入1mL RhB标记的TMC或TP NPs(1mg/mL)溶液;将肠段放回腹腔,2h后处死大鼠,剪开肠环收集肠液,加生理盐水冲洗肠段,合并肠液和冲洗液,酶标仪测定RhB标记的TMC或TP NPs含量(λex=560nm,λem=590nm).
1.7 小肠离体转运
PTX 溶液配制:以聚氧乙烯蓖麻油/无水乙醇(1∶1,体积比)配制1mg/mL PTX 贮备液,使用时以Kreb's-Ringer缓冲液稀释至100μg/mL;PTX/TMC混合液配制:配制10mg/mL TMC溶液,使用时将PTX 贮备液、TMC溶液和Kreb's-Ringer缓冲液按1∶1∶8(体积比)混合.
SD 大鼠,禁食12h,可自由饮水.颈椎脱臼处死,沿腹中线打开腹腔取出回肠,以Kreb's-Ringer缓冲液清洗干净,剪成约7cm 长,两端约1cm 处用手术线结扎形成封闭肠环,肠环内分别注入0.5mL PTX溶液、PTX/TMC混合液、TP NPs溶液(浓度按PTX 计均为100μg/mL).肠环置高型称量瓶中,加入5mL 37℃氧气饱和的Kreb's-Ringer缓冲液,使肠环保持拉伸状态,37℃、100r/min振荡温育.分别于30,60,90,120,180min取样200μL,补加37℃Kreb's-Ringer缓冲液200μL.样品12 000r/min离心15min,按1.5项下HPLC法测定样品中PTX 含量,计算PTX 的表观渗透系数(Papp).
2 结果与讨论
2.1 TP的制备与表征
图1为TP和TP NPs的合成路线.以二氯甲烷为溶剂,琥珀酸酐以吡啶催化开环,与PTX 的2'位羟基发生酯化反应,真空干燥得PTX-suc.采用分子质量分别为30ku和200ku的壳聚糖与碘甲烷反应合成了TMC.TMC与PTX-suc在DMSO/水混合溶剂中经EDC/NHS催化缩合制得TP.TP含有亲水性聚合物和疏水性药物,水中可自组装形成纳米粒.图2为TMC 和TP的1H NMR 图谱.经1H NMR 图谱计算TMC的季铵化度约为30%[9],TP的1H NMR 图谱中7.3×10-6~8.0×10-6和3.1×10-6~4.0×10-6的信号峰分别为PTX 苯环和壳聚糖糖环上的质子峰,表明PTX 已连接至TMC上,制得聚合物-药物连接物TP.

图1 TP和TP NPs的合成路线Fig.1 Synthetic route of TP and TP NPs
2.2 粒径、Zeta电势及形貌
TP(30)NPs和TP(200)NPs水中平均粒径分别为(166.2±10.8)nm 和(193.7±15.1)nm,Zeta电势分别为(31.6±1.9)mV和(32.1±2.0)mV.图3(a)和(b)分别为TP(30)NPs和TP(200)NPs的SEM 图,可见纳米粒近似球形,表面光滑,粒径为100~200nm,粒径分布均匀且分散性较好.如图3(c)和(d)所示,模拟胃肠道环境的不同pH 条件下,TP NPs粒径无显著变化,表明TP NPs可在胃肠道环境中保持纳米结构的稳定性.采用荧光探针芘,测定两亲性聚合物的CMC.图3(e)和(f)为I335/I333对lg C 线性回归,I335/I333变化的转折点所对应的浓度即为CMC[10].TP(30)NPs和TP(200)NPs的CMC较小,分别为0.065和0.039mg/mL,表明TP NPs在生理环境中经稀释后也可较好的保持粒子状态.
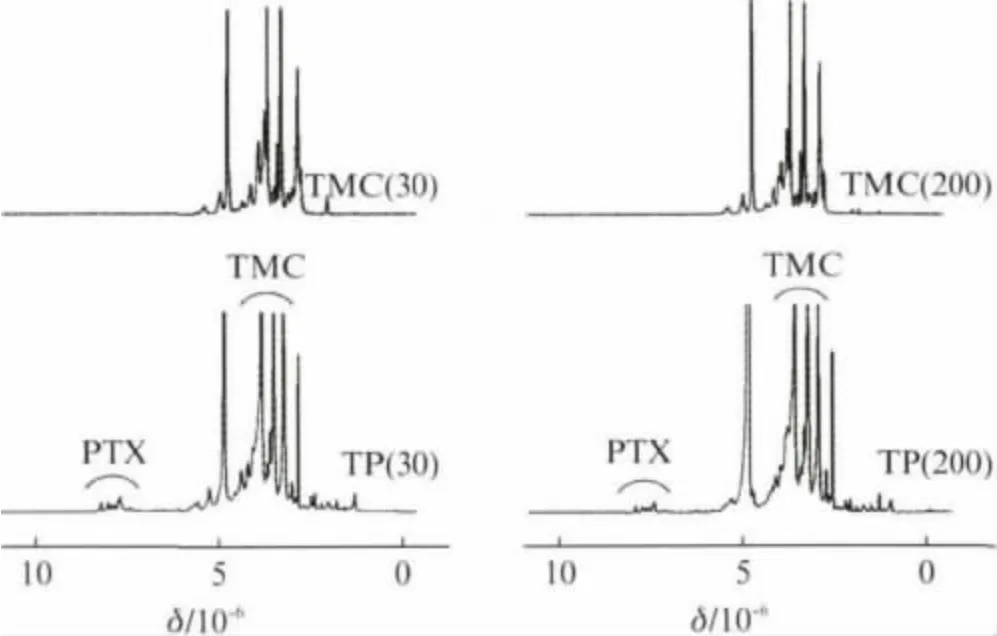
图2 TMC和TP的1 H NMR 图谱Fig.2 1 H NMR spectra of TMC and TP

图3 TP(30)NPs(a)和TP(200)NPs(b)的SEM 图;pH 1.2,5.0,6.8和7.4下TP(30)NPs(c)和TP(200)NPs(d)的粒径(n=3);TP(30)NPs(e)和TP(200)NPs(f)的I335/I333对lg[C/(mg·mL-1)]线性回归Fig.3 SEM images of TP(30)NPs(a)and TP(200)NPs(b);Particle sizes of TP(30)NPs(c)and TP(200)NPs(d)at pH 1.2,5.0,6.8,and 7.4.Indicated values were mean±SD(n=3);Variation of intensity ratio(I335/I333)versus logarithmic concentrations of TP(30)NPs(e)and TP(200)NPs(f)
2.3 载药量与体外释放
TP(30)NPs和TP(200)NPs的载药量分别为11.0%和11.1%(质量分数).图4为TP NPs在0.2mol/L pH 7.4PBS中的PTX 释放曲线.药物物理包埋于纳米粒后的释药行为一般包括初期突释和后期缓释,而自组装的聚合物-药物连接物TP NPs需将药物化学连接键水解后方可释放PTX 至介质中,故无明显突释,可持续缓慢释放药物达10d.PTX 释放速率随聚合物分子质量的增大而减小,这是由于分子链较长的TP 可使释放介质黏度增加,且形成的纳米粒缠绕较紧密[6,11].
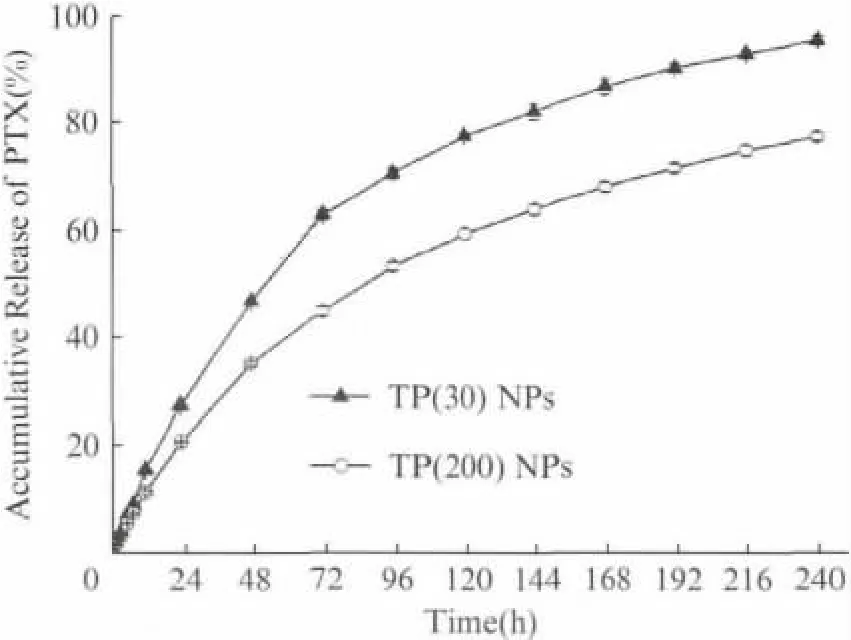
图4 TP NPs在pH 7.4PBS中的PTX 释放曲线Fig.4 In vitro PTX release profiles from TP NPs in pH 7.4PBS
2.4 在体小肠黏附与小肠离体转运
图5(a)为TP NPs的在体小肠黏附率,可见TP(30)NPs和TP(200)NPs的小肠黏附率分别为相应TMC的1.9和2.0倍.TMC 荷正电,可与小肠黏膜表面荷负电的黏蛋白静电吸附富集于黏液层;TMC与PTX 连接后,疏水性增强,可与黏膜黏蛋白和小肠上皮细胞经疏水作用结合,故小肠黏附力提高[2].图5(b)为PTX、PTX/TMC和TP NPs在离体小肠中的Papp,可见,TP(30)NPs和TP(200)NPs均可显著促进PTX 的小肠转运,Papp分别为游离PTX 的13.1 和6.1 倍.TP NPs的促渗透作用可能归因于:(1)TP NPs荷正电,可与小肠上皮细胞紧密连接处的荷负电类脂质作用,打开紧密连接,从而促进PTX经胞间途径转运[12];(2)TP NPs可同时经静电作用和疏水作用黏附至细胞膜,被小肠上皮细胞摄取后经胞内途径转运[13];(3)PTX 是P-gp的底物,PTX 连接至TMC并形成纳米粒,可避免被小肠上皮细胞Pgp药物流出泵排出,提高PTX 的转运效率[3].TP(200)NPs的促渗透作用弱于TP(30)NPs,这可能是由于TP(200)NPs分子链过长,穿透上皮细胞层的能力减弱,故小肠转运能力降低[6].分子质量为30ku和200ku的TMC溶液分别与PTX 物理混合,PTX/TMC组的Papp分别为游离PTX 的1.8和3.6倍,这是由于物理混合液中TMC可打开小肠紧密连接促进游离PTX 的小肠转运.
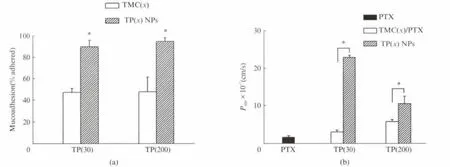
图5 (a)TMC和TP NPs的在体小肠黏附率;(b)PTX、PTX/TMC和TP NPs在离体小肠中的PappFig.5 (a)Mucoadhesion of TMC and TP NPs;(b)Pappof PTX in excised rat ileum
3 结论
设计并合成用于口服递送PTX 的聚合物-药物连接物TP,TP 在水中可自组装形成平均粒径小于200nm 且粒径均一的TP NPs,模拟胃肠道环境的不同pH 条件下粒径稳定;TP NPs在pH 7.4PBS中可持续缓慢释放药物达10d;TP NPs小肠黏膜黏附力强,可通过打开小肠上皮细胞紧密连接、促进上皮细胞摄取等发挥促渗透作用.因此,可自组装的TP NPs有望在肿瘤治疗中用于口服递送化疗药物.
[1]Mo R,Jin X,Li N,et al.The mechanism of enhancement on oral absorption of paclitaxel by N-octyl-Osulfate chitosan micelles[J].Biomaterials,2011,32(20):4609-4620.
[2]Lee E,Kim H,Lee I H,et al.In vivo antitumor effects of chitosan-conjugated docetaxel after oral administration[J].J Control Release,2009,140(2):79-85.
[3]Park K.Efficient oral delivery of paclitaxel using cyclodextrin complexes[J].J Control Release,2010,145(1):1.
[4]Roger E,Kalscheuer S,Kirtane A,et al.Folic acid functionalized nanoparticles for enhanced oral drug delivery[J].Mol Pharmaceutics,2012,9(7):2103-2110.
[5]Xin D,Wang Y,Xiang J.The use of amino acid linkers in the conjugation of paclitaxel with hyaluronic acid as drug delivery system:synthesis,self-assembled property,drug release,and in vitro efficiency[J].Pharm Res,2010,27(2):380-389.
[6]Yin L,Ding J,He C,et al.Drug permeability and mucoadhesion properties of thiolated trimethyl chitosan nanoparticles in oral insulin delivery[J].Biomaterials,2009,30(29):5691-5700.
[7]Cavallaro G,Maniscalco L,Campisi M,et al.Synthesis,characterization and in vitro cytotoxicity studies of a macromolecular conjugate of paclitaxel bearing oxytocin as targeting moiety[J].Eur J Pharm Biopharm,2007,66(2):182-192.
[8]Hu F Q,Liu LN,Du Y Z,et al.Synthesis and antitumor activity of doxorubicin conjugated stearic acidg-chitosan oligosaccharide polymeric micelles[J].Biomaterials,2009,30(36):6955-6963.
[9]Kean T,Roth S,Thanou M.Trimethylated chitosans as non-viral gene delivery vectors:Cytotoxicity and transfection efficiency[J].J Control Release,2005,103(3):643-653.
[10]Zhao Z,He M,Yin L,et al.Biodegradable nanoparticles based on linoleic acid and poly(β-malic acid)double grafted chitosan derivatives as carriers of anticancer drugs[J].Biomacromolecules,2009,10(3):565-572.
[11]Zhang J,Chen X G,Sun G Z,et al.Effect of molecular weight on the oleoyl-chitosan nanoparticles as carriers for doxorubicin[J].Colloid Surface B,2010,77(2):125-130.
[12]Artursson P,Lindmark T,Davis S S,et al.Effect of chitosan on the permeability of monolayers of intestinal epithelial-cells(Caco-2)[J].Pharm Res,1994,11(9):1358-1361.
[13]Wang B,He C,Tang C,et al.Effects of hydrophobic and hydrophilic modification on gene delivery of amphiphilic chitosan based nanocarriers[J].Biomaterials,2011,32(20):4630-4638.

