表达结核分枝杆菌融合抗原TB10.4-HspX的重组酵母免疫效果研究
张宇飞,陆 健,刘建平,王洪海
(1.复旦大学 生命科学学院 遗传学研究所,上海 200438;2.复旦大学 遗传工程国家重点实验室,上海 200438)
结核病是由结核分枝杆菌等病原体引起的传染病,自古以来一直是人类健康的重大威胁.长时间的进化使结核分枝杆菌发展出了在人体内潜伏感染的机制,导致全世界近1/3的人口是结核病病原体的潜伏感染者,并在一定的条件下发展为活动性结核病.2012年全世界共有870万例结核病病例,其中130万例死亡,是致死人数排名第二的传染病,仅次于艾滋病[1].更为可怕的是这两大传染病共同感染的几率很高,在130 万例结核病死亡病例中有32 万例是与HIV 共同感染,结核病成为艾滋病人的一大直接死因[2-4].
目前结核病的防治主要存在两大难点:(1)治疗上,异烟肼和利福平是治疗结核最有效的药物,但随着抗药性菌株的出现,依赖这两种抗生素的治疗变得愈发困难,在2012年的130万例结核死亡病例中有17万例感染的是多抗药性菌株[5];(2)预防上,卡介苗(Bacillus Calmette-Guérin,BCG)是国际上唯一批准使用的抗结核疫苗,在幼儿时期接种后具有一定保护作用,但其效果随着年龄的增长而降低,并且重复接种无法增强保护效果.而且作为一种纯预防性疫苗,卡介苗无法清除处于潜伏感染期的结核病病原体,如果为HIV 感染者接种则可能激活潜伏的结核病病原体,使其发展为活动性结核病.目前开发中的抗结核疫苗多为亚单位疫苗和减毒活疫苗等,存在保护效果低下和恢复致病性风险的问题[6].因此有必要研发效果更好的新型抗结核疫苗.
近年来一种新的疫苗类型进入了人们的视野,即重组酿酒酵母(S.cerevisiae)全菌疫苗.重组酿酒酵母全菌疫苗是以酿酒酵母作为疫苗载体,将表达抗原的重组酿酒酵母全菌免疫接种.与传统的疫苗相比,这种新型疫苗的主要特点是:(1)清晰的遗传背景;(2)较高的安全性;(3)能一次表达多个外源蛋白,而且培养方便,成本低廉;(4)具有很强的免疫佐剂作用,其细胞壁是一种天然的佐剂,其中所含的β-1,3-D-葡聚糖和甘露糖等成分能刺激免疫系统中最强的抗原递呈细胞树突状细胞(Dendritic Cells,DCs),促进其成熟并增强其抗原递呈能力,DCs递呈抗原激活杀伤性T 淋巴细胞或辅助性T 淋巴细胞介导的免疫反应,从而在整体上达到增强抗原免疫原性的效果[7-8];(5)自身的免疫原性很低,很少与机体产生免疫中和反应,不会形成记忆型免疫,这意味着可通过重复接种增强疫苗效果;(6)酿酒酵母热失活后与活菌相比具有等价的免疫效果,使用热失活的酵母进行免疫,排除了使用活菌可能带来的风险,进一步提高了安全性.
综上所述,酿酒酵母疫苗具有成为治疗性疫苗的潜力.目前,已有几个酿酒酵母全菌疫苗在前期研究中取得成功并进入了临床试验阶段,例如表达癌症相关抗原的Yeast-Ras、Yeast-CEA 以及表达丙肝抗原的Yeast-HBV[9-11].酿酒酵母疫苗能刺激机体产生抗原特异性的免疫反应,产生保护乃至治疗效果.
基于重组酿酒酵母全菌的抗结核疫苗国外尚未见到报道.本研究拟将酿酒酵母应用于抗结核疫苗研究.选取两个结核分枝杆菌抗原TB10.4(Rv0288)和HspX(Rv2031c),将其融合表达.TB10.4是一种免疫原性较强的抗原,结核分枝杆菌和BCG 菌株都有表达,在结核分枝杆菌感染宿主的整个过程中,都能检测到高数量的TB10.4特异性T 淋巴细胞[12-13].目前也已有多种结核疫苗以TB10.4抗原为靶点,进入了一期或二期临床试验阶段.HspX 是结核病病原体在潜伏感染期表达的一种抗原蛋白,接种BCG 并不能产生HspX 特异性T 细胞免疫反应[14],提示无法清除处于潜伏期内的结核病病原体.本研究以酿酒酵母Y16为宿主,构建了表达融合抗原TB10.4-HspX(TB10H)的重组酿酒酵母Y16-TB10H,将其热失活后免疫小鼠,检测小鼠的免疫应答反应,评估该重组酿酒酵母的免疫效果.
1 材料与方法
1.1 菌株和质粒
大肠杆菌E.coli DH5α;酿酒酵母S.cerevisiae S1502B本实验室保存,简称为Y16;大肠杆菌克隆载体PTEF-KcSP-RH 和酿酒酵母表达载体pHR-PTEF-A 由本实验室构建.
1.2 试剂与材料
限制性内切酶、T4DNA 连接酶购自TaKaRa 公司,Blend Tap、KOD Plus PCR 扩增酶购自ToYoBo 公司,质粒提取试剂盒、DNA 片段胶回收试剂盒购自Axygen公司.基因测序与引物合成在上海桑尼生物公司进行.主要引物序列为TB10H 正向引物TB10H-F1 5'-atagatctTCGCAAATCATGTACAACTACCCC-3';TB10H 反向引物TB10H-R1 5'-acactagtttaTCAGTTGGTGGACCGGATCTGAA-3'.
细胞因子ELISA 试剂盒、流式细胞术相关抗体购自eBioscience公司.Rabbit anti-TB10.4抗体购自Abcam 公司,Goat anti-rabbit抗体和Goat anti-mouse抗体购自ABGENT.TB10.4抗原表位肽段9AA(QIMYNYPAM)、HspX 抗原表位肽段15AA(SEFAYGSFVRTVSLP)由上海强耀生物公司合成.C57BL/6小鼠,雌性,6~8周,由复旦大学枫林动物实验中心采购和饲养.DMEM、FBS、R/MINI1640培养基购于Biowest公司.LB、SD 和YEPD 培养基配方见《分子克隆实验指南》(1996年第二版)和《酵母遗传学方法实验指南》(2000年第一版).
1.3 主要仪器
AppliedBiosystems PCR 扩增仪、Bio-Rad蛋白电泳槽、BAYGENE 蛋白电泳仪、Gene Company化学发光成像系统、BD Falcon流式细胞仪.
1.4 克隆构建
大肠杆菌转化采用42℃热激方法,酿酒酵母转化采用LiAC化学法,具体步骤参考《分子克隆实验指南》(1996年第二版)和《酵母遗传学方法实验指南》(2000年第一版).
从模板质粒:pMD18-T-TB10H 上扩增得到TB10H 融合基因片段,通过酶切连接将其克隆到大肠杆菌质粒PTEF-KcSP-RH 上,NotⅠ酶切获得含有酿酒酵母同源片段、信号肽、TB10H 基因片段的重组表达盒.该表达盒与酶切后的酿酒酵母表达载体pHR-PTEF-A 共转化酿酒酵母Y16,发生同源重组,在SDLeu平板(即无亮氨酸SD 选择性培养基)上筛选,获得重组酿酒酵母转化子Y16/pHR-PTEF-TB10H,简称为Y16-TB10H.
1.5 Western blot鉴定重组酿酒酵母表达抗原TB10H 情况
挑选菌落PCR 阳性的酿酒酵母转化子,接于液体SD-Leu培养基中,30℃220r/min振摇培养过夜作为种子液,第二天按5%的接种量转接入YEPD 培养基,继续30℃220r/min振荡培养72h,离心收集培养液上清与菌体,上清使用TCA 沉淀法收集蛋白样品,菌体使用玻璃珠法破碎,离心收集破菌上清样品,使用Rabbit anti-HspX 抗体,Western blot检测TB10H 重组蛋白表达情况.
1.6 小鼠免疫及免疫反应检测
1.6.1 小鼠免疫
重组酿酒酵母70℃水浴1h热失活.用PBS悬浮菌体至109/mL,分别用前肢皮下注射和滴鼻吸入两种方式免疫C57BL/6小鼠,皮下注射接种量100μL,滴鼻接种量10μL.每组8只小鼠,其中4只在第一次免疫的一周后取样,其余4只在第二次免疫的一周后取样,两次免疫相隔2周.设立空白对照组N/A(不对小鼠进行任何免疫处理);酵母对照组Y16-pHR-A(转入未克隆抗原序列的空表达载体pHR-PTEF-A 的酵母).具体分组情况与给药量见表1.
1.6.2 小鼠血清中抗原特异性IgG ELISA 检测
96孔板中每孔包被TB10.4和HspX 合成肽段各0.25μg,随后使用含2%BSA 的PBS溶液封闭,加入稀释一定倍数的血清样品,反应后使用PBST 清洗5~7次,二抗反应加入HRP标记的羊抗鼠IgG,反应后再次使用PBST 清洗5~7次,随后每孔加100μL TMB 底物显色,用50μL 2mol/L 硫酸终止显色反应,酶标仪检测每孔的OD450数据并分析.
1.6.3 小鼠脾细胞胞外细胞因子的ELISA 检测
1)将小鼠脾脏细胞按每孔2×106个接种至24孔板中,加入培养液补足至1mL.
2)各加入10μg TB10H 肽段(其中TB10.4、HspX 各5μg)抗原刺激,37℃培养72h.
3)将培养液以1 000g离心10min,收集培养液上清,稀释5倍,ELISA 检测其中的细胞因子IFN-γ和IL-4.
ELISA 所用试剂与流程参考IFN-γ、IL-4细胞因子ELISA 检测试剂盒说明书.
1.6.4 流式细胞术检测小鼠DCs细胞分化情况
在24孔板中各接种小鼠脾脏细胞4×106个,补加培养液至2mL,并加入IL-2,37℃培养约36h.
首先用CD11c-FITC抗体标记小鼠脾细胞,CD11c阳性的细胞即为DCs细胞,随后将每个样品的脾细胞分为4组,分别加入CD80-PE、CD86-PE、MHCI-PE、MHCII-PE 4种PE 荧光标记的抗体,使用流式细胞术的FITC通道和PE通道,分别检测小鼠脾细胞中CD80、CD86、MHCI和MHCII阳性DCs细胞.

表1 小鼠免疫实验分组表Tab.1 Group dividing of the vaccination
2 结果
2.1 重组酿酒酵母构建与鉴定
融合抗原TB10H 酵母表达质粒构建过程参考文献[15].TB10H 序列长度为729bp,挑选重组酵母转化子以引物TB10H-F1/TB10H-R1进行PCR鉴定,结果如图1所示.1、2、3、5 号 转化子为TB10H 阳性克隆(对应图1中3、4、5、7泳道),挑选5号重组酵母转化子,命名为Y16-TB10H,进行后续实验.收集培养的重组酵母Y16-TB10H,Western blot鉴定融合抗原TB10H 表达情况,结果如图2所示.融合抗原TB10H 预期大小约为27ku,Western blot结果表明,重组酿酒酵母Y16-TB10H 成功表达了融合蛋白TB10H,并且表达的TB10H 主要集中在胞内,有少部分分泌至胞外.

图1 重组酿酒酵母转化子PCR 鉴定Fig.1 PCR identification of the recombinant yeast strains
2.2 小鼠血清样品中TB10H 特异性IgG 抗体检测
分别在第一次免疫和第二次免疫后一周(即第7 天和第21 天)取小鼠血清,样品稀释250 倍后ELISA 检测TB10H 特异性抗体,结果如图3所示:Y16-TB10H 皮下注射组(E 组)IgG 显著高于对照组(A、B、C组),而Y16-TB10H 滴鼻免疫组(D 组)与对照组无差异.Y16-TB10H 皮下注射组2次免疫产生的IgG 高于1次免疫,但差异未达到显著水平.
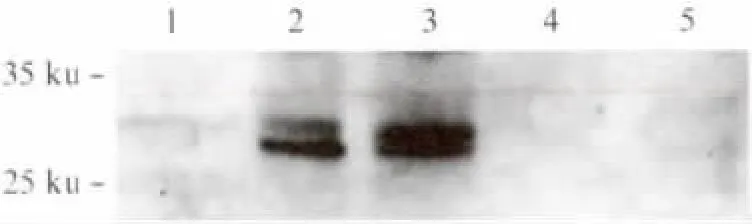
图2 Western blot检测重组酿酒酵母中TB10H 表达Fig.2 Western blot detection of TB10Hexpressed by the recombinant yeast
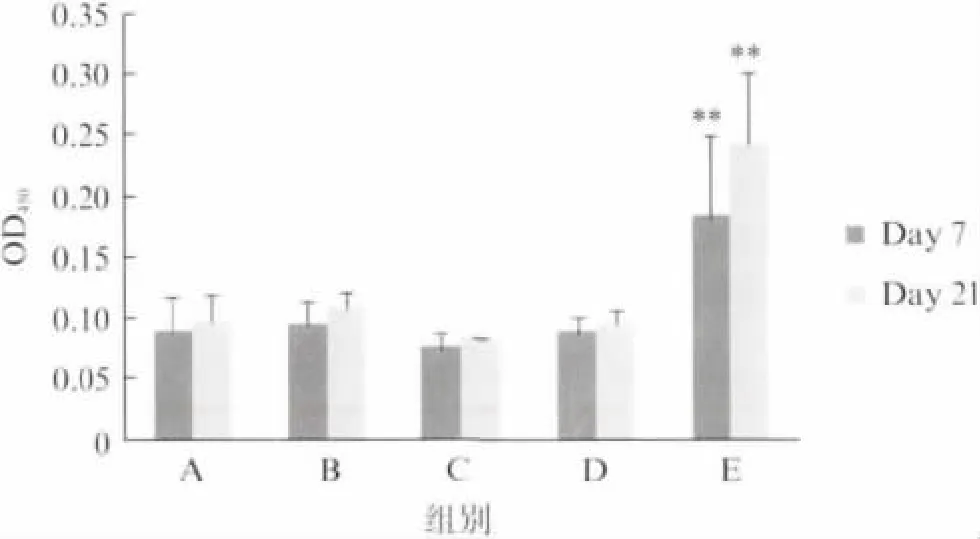
图3 ELISA 检测免疫小鼠血清中TB10H 特异性IgGFig.3 ELISA assay for anti-TB10HIgG in murine serum
2.3 小鼠脾细胞产生的细胞因子检测
通过检测IFN-γ和IL-4这两种典型的Th1型和Th2 型细胞因子,判断各组样品能否使小鼠产生Th1型和Th2型免疫反应,以及主要偏向于哪种类型,从而评估重组酿酒酵母的免疫刺激效果.各组小鼠脾细胞经抗原刺激后分泌至培养液中IFN-γ和IL-4检测结果如图4所示.

图4 ELISA 检测小鼠脾细胞经抗原刺激产生的胞外细胞因子Fig.4 ELISA assay for extracellular cytokines of antigen-stimulated mice splenocytes
Y16-TB10H 皮下注射组产生的IFN-γ 显著高于对照组,但其产生的IL-4 与对照组无差异.Y16-TB10H 滴鼻免疫组无论IFN-γ还是IL-4均与对照组无差异.说明Y16-TB10H 皮下注射免疫方式可以刺激小鼠脾细胞产生Th1型细胞因子IFN-γ,但并不能有效刺激产生Th2型细胞因子IL-4,即小鼠发生Th1型免疫应答.作为对照,伴刀豆球蛋白(ConA)能够刺激小鼠脾细胞同时产生IFN-γ和IL-4,没有偏向性。
2.4 小鼠DCs细胞分化情况检测
CD11c为DCs细胞表面的特异性分子,CD11c阳性即为DCs细胞.CD80、CD86为成熟分化的DCs细胞表面共刺激分子,MHCI和MHCII是DCs细胞表面抗原递呈分子.通过流式细胞术检测CD11c+/CD80+、CD11c+/CD86+、CD11c+/MHCI+和 CD11c+/MHCII+细胞,可以了解DCs细胞分化情况.各组小鼠脾脏细胞检测结果如图5所示:与对照组比较,重组酵母Y16-TB10H无论是滴鼻免疫(D 组)还是皮下注射免疫(E组)均显著提高CD80、CD86、MHCI和MHCII阳性的DCs细胞比例,说明重组酿酒酵母Y16-TB10H 具有促进小鼠DCs细胞分化成熟和增强其抗原递呈能力的刺激效果.

图5 流式细胞术检测免疫小鼠DCs分化变化Fig.5 Flow cytometric analysis of dendritic cells'surface markers
3 讨论
本研究使用表达结核分枝杆菌抗原的重组酿酒酵母Y16-TB10H 以不同途径免疫小鼠,皮下注射免疫后,小鼠血清中TB10H 抗原特异性IgG 抗体显著增加,说明重组酵母能够激发小鼠抗原特异性体液免疫应答;小鼠脾细胞针对TB10H 的刺激,分泌产生Th1型细胞因子IFN-γ,但不产生Th2型细胞因子IL-4,说明重组酵母能够有效激发小鼠Th1型细胞免疫应答.研究还发现重组酵母能够刺激DCs成熟分化和抗原递呈作用.黏膜免疫对于结核病这种经呼吸道途径感染疾病防护至关重要.本研究试图探讨重组酵母以滴鼻方式通过黏膜途径的免疫效果,但未检测到抗原特异的体液或细胞免疫应答.
上述研究结果初步说明重组酵母Y16-TB10H 具有通过专职抗原递呈细胞DCs途径激活小鼠免疫系统产生抗原特异性免疫应答的潜力,但不同的免疫方式产生的效果差异很大,该重组酵母作为一种新型的抗结核疫苗形式具有进一步深入研究的价值.
后续拟继续开展的研究工作有:检测包括Il-2、TNF-α等在内更多的细胞因子,全面系统地了解重组酵母免疫后小鼠免疫系统应答变化;杀伤性T 淋巴细胞(Cytotoxic T Lymphocyte,CTL)实验和攻击保护实验.DCs通过MHCI途径激活CTL.CTL实验能够反映杀伤性T 淋巴细胞的特异性细胞毒性作用,这对于清除病原体非常关键[16-17].而攻击保护实验能直观反映疫苗的总体免疫效果,考察其在实际应用中的意义.由于一定的实验条件限制,本研究中并未进行这些实验,但对于该重组酵母疫苗功效的评价是不可或缺的指标.
重组酿酒酵母作为疫苗应用需要关注一个问题,即酵母表达的抗原可能被过度糖基化,无法保证其免疫原性与原始抗原相同,有可能造成重组酿酒酵母刺激产生的抗原特异性免疫反应不一定对于原病原菌完全有效[18-19].在本研究中,用于检测的抗原为人工合成的包含抗原表位的15个氨基酸残基的小肽,因此得出的结果与野生型抗原之间具有一致性,如果使用的检测抗原为重组酵母所表达纯化的抗原,则需注意考察该一致性问题.目前,在毕赤酵母中已经实现了通过敲除一系列特定基因而消除其过度糖基化的机制.本实验室曾经构建过敲除Och1基因(酿酒酵母蛋白质糖基化过程第一步所需酶的编码基因)的酿酒酵母,如果酿酒酵母的过度糖基化被阻断,则将解决重组酿酒酵母疫苗的一个重要问题,极大提高重组酿酒酵母作为新型疫苗应用的可能性.
[1]World Health Organization.Global tuberculosis report 2013[R].Geneva:WHO,2013.
[2]Zhou Y,Shen Y Q.Research progress of the pathological mechanisms of human immunodeficiency virus(HIV)and Mycobacterium tuberculosis(MTB)dual infections[J].Chinese Journal of Virology,2013,29(4):452-456.
[3]Munawwar A,Singh S.AIDS associated tuberculosis:A catastrophic collision to evade the host immune system[J].Tuberculosis,2012,92(5):384-387.
[4]Lee S S,Meintjes G,Kamarulzaman A.Management of tuberculosis and latent tuberculosis infection in HIV-infected persons[J].Respirology,2013,18(6):912-922.
[5]Chang K C,Yew W W.Management of difficult multidrug-resistant tuberculosis and extensively drugresistant tuberculosis:Update 2012[J].Respirology,2013,18(1):8-21.
[6]Kaufmann S H,Hussey G,Lambert P H.New vaccines for tuberculosis[J].Lancet,2010,375(9731):2110-2119.
[7]Stubbs A C,Martin K S,Coeshott C,et al.Whole recombinant yeast vaccine activates dendritic cells and elicts protective cell-mediated immunity[J].Nature Medicine,2001,7(5):625-629.
[8]Barron M,Blyveis N,Pan S,et al.Human dendritic cell interactions with whole recombinant yeast:Implications for HIV-1vaccine development[J].J Clin Immunol,2006,26(3):251-264.
[9]Lu Y,Bellgrau D,Dwyer-Nield L D,et al.Mutation-selective tumor remission with Ras-targeted,whole yeast-based immunotherapy[J].Cancer Res,2004,64(15):5084-5088.
[10]Wansley E K,Chakraborty M,Hance K W.Vaccination with a recombinant Saccharomyces cerevisiae expressing a tumor antigen breaks immune tolerance and elicits therapeutic antitumor responses[J].Clin Cancer Res,2008,14(13):4316-4325.
[11]McAleer W J,Buynak E B,Maigetter R Z,et al.Human hepatitis B vaccine from recombinant yeast[J].Nature,1984,307(5947):178-180.
[12]Rolf B,Carina V L,Peter A,et al.Induction of CD8 T cells against a novel epitope in TB10.4:Correlation with mycobacterial virulence and the presence of a functional region of difference-1[J].Journal of Immunology,2007,179(6):3973-3981.
[13]Winslow G M,Cooper A M,Reiley W,et al.Early T-cell responses in tuberculosis immunity[J].Immunological Reviews,2008,225:284-299.
[14]Annemieke G,May Y L,Krista E M,et al.T-cell recognition of the HspX protein of Mycobacterium tuberculosis correlates with latent M.tuberculosis infection but not with M.bovis BCG vaccination[J].Infection and Immunity,2007,75(6):2914-2921.
[15]Yu J,Jiang J X,Ji W M,et al.Glucose-free fructose production from Jerusalem artichoke using a recombinant inulinase-secreting Saccharomyces cerevisiae strain[J].Biotechnol Lett,2011,33(1):147-152.
[16]Pagliara D,Savoldo B.Cytotoxic T lymphocytes for the treatment of viral infections and posttransplant lymphoproliferative disorders in transplant recipients[J].Curr Opin Infect Dis,2012,25(4):431-437.
[17]Oykhman P,Mody C H.Direct microbicidal activity of cytotoxic T-lymphocytes[J].J Biomed Biotechnol,2010,2010:249482.
[18]Lei D,Xu Y,He Q,et al.Glycosylation analysis of recombinant neutral protease Ⅰfrom Aspergillus oryzae expressed in Pichia pastoris[J].BiotechnolLett,2013,35(12):2121-2127.
[19]Mormeneo M,Pastor F J,Zueco J.Efficient expression of a Paenibacillus carcinonensis endoglucanase in Saccharomyces cerevisiae[J].J Ind Microbiol Biotechnol,2012,39(1):115-123.

