30例结直肠癌肺转移患者的临床特征及预后分析
陈 力 詹 成 王 琳 金玉麟 时 雨 王 群
(复旦大学附属中山医院胸外科 上海 200032)
结直肠癌(colorectal cancer,CRC)一直是被公认为严重威胁人类健康的常见恶性肿瘤之一[1]。近年来随着诊断技术和治疗方法的提高,CRC的死亡率在1990年至2007年间已经下降约35%[2]。然而,术后复发始终是CRC治疗失败的主要原因,其中大约有50%的患者在CRC切除术后会发生转移[3]。CRC最常见的转移部位是肝脏和肺,其中5%~15%的患者术后发生肺转移,且一旦发生肺转移,则生存率较低[4-5]。肺转移灶切除术可相对提高CRC肺转移患者生存率,被广泛用于CRC并发肺转移的治疗[6]。综上所述,研究探讨CRC肺转移的手术治疗经验及预后情况,具有重要的临床意义。复旦大学附属中山医院胸外科统计并分析了2008年1月至2013年12月期间以手术方法治疗CRC肺转移的患者30例,占同期手术病例的0.18%,现总结分析并报道如下。
资料和方法
2008年1月至2013年12月,复旦大学附属中山医院胸外科收治的共计30例CRC肺转移患者(表1):男23例,女7例;年龄40~83岁,中位年龄60岁;临床表现为咳嗽者2例,胸痛者2例,咯血者0例;X线胸片及CT显示肺孤立灶24例(80%),累及双肺5例(16.7%);DFI 1~102个月,平均29.7个月。30例患者均采用手术切除肺转移灶,其中8例采用外侧切口,22例采用胸腔镜手术,行肺楔形切除术19例,肺叶切除术11例。30例患者均顺利完成手术,无手术死亡病例。
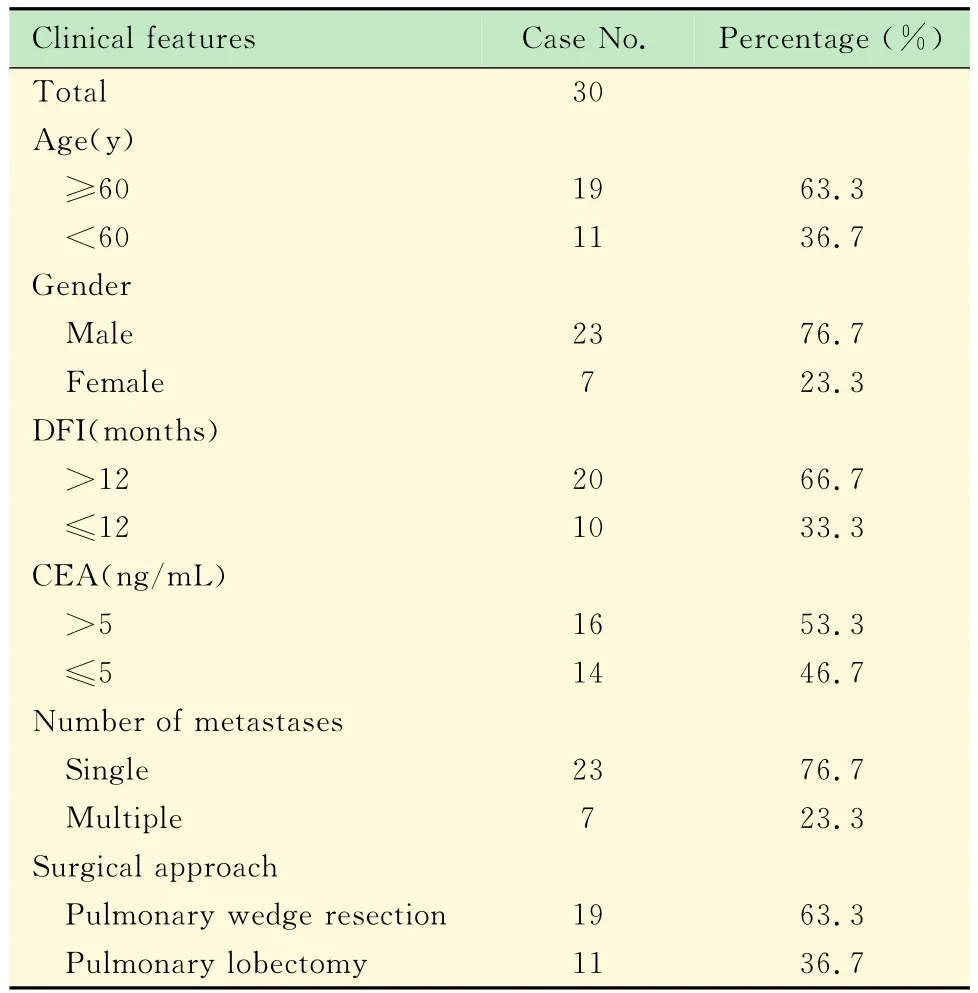
表1 患者临床资料特征Tab 1 The clinical characteristics of the patients data
结 果
在我科收集的30例CRC肺转移患者中失访5例。其中男性患者19例,女性患者6例;年龄分布为40~83岁,其中60岁以上者15例(60%)。截至随访终止日期,死亡10例,生存15例。成功随访的患者中,出现7例广泛转移,3例脑部转移。经统计分析,总体中位生存期为53个月,术后1年、3年、5年生存率分别为88%、71.1%、46.5%。60岁以上的患者术后1年、3年生存率分别为86.7%、73.3%,而60岁以下的患者术后1年、3年生存率为90.0%、68.6%,两者差别无统计学意义(P=0.593)。男性患者术后1年、3年生存率分别为78.9%、72.9%,女性患者术后1年、3年生存率分别为83.3%、66.7%,性别与患者预后的关系差异无统计学意义(P=0.834)。25例患者中,DFI小于1年的患者9例,其术后1年、3年生存率分别为88.9%、87.5%;DFI大于1年的患者共计16例,其术后1年、3年生存率分别为75%、61.9%,两类患者的生存情况无显著差异(P=0.192)。CEA浓度是否处于正常值范围,一直被视为重要的预后因素。本组获得随访的25例患者中,血清CEA>5 ng/mL患者的5年生存率为26.5%,血清CEA≤5 ng/mL患者的5年生存率为77.9%,(图1)。
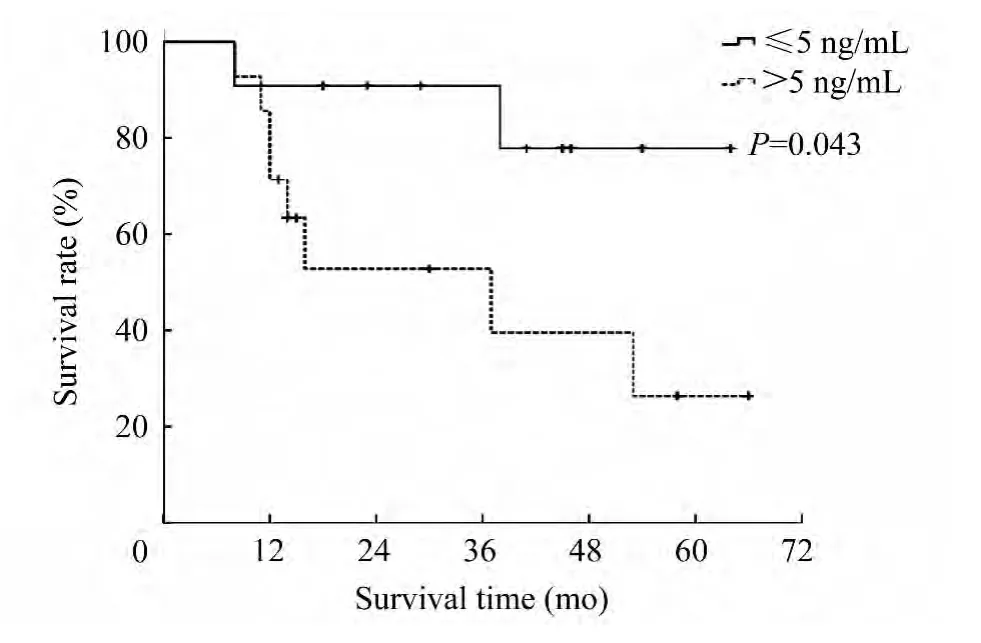
图1 患者生存状况与CEA的关系Fig 1 Relationship living conditions of patients with CEA
显然血清CEA是否处于正常值范围对于术后生存情况具有显著影响(P=0.043),CEA处于正常水平的患者预后情况更佳。本组患者中,有多发转移灶者19例,孤立转移灶者6例,经统计分析,两类患者术后生存时间差异无统计学意义(P=0.539)。患者中采用肺楔形切除术19例,肺叶切除术者11例,两类患者术后生存状况差异无统计学意义(P=0.846)。
讨 论
近年来,我国CRC发病率总体呈上升趋势,手术切除CRC原发灶后仍易发生远处转移,其中,CRC术后肺转移的发病率相对较高,且系统化疗的临床效果不理想,故手术切除肺转移灶依然是首选的治疗方法。手术前必须严格掌握适应证,目前广被采纳的手术适应证为:(1)基于解剖位置和疾病发展程度并保留足够肺功能的转移灶完整切除;(2)CRC原发灶已手术切除;(3)肺外转移灶不影响肺内转移灶切除;(4)于某些特定患者可考虑再切除;(5)于多发转移灶的患者可同步切除或分期治疗。对于手术术式的选择,我科对CRC肺单个转移灶或转移灶位于肺叶边缘的患者首选肺楔形切除术,肺楔形切除术能满足保留更多肺实质及肺功能的需求,亦便于对复发病例进行再次切除。而对于转移灶位于肺门深部或者同一肺叶里有多个转移的患者,肺叶切除术依然是最好的选择。本组获得随访的患者:男性19例,女性6例;年龄40~83岁,其中60岁以上者15例(60%)。在CRC肺转移灶切除手术之前,我们均严格参照手术指征对其进行了详细评估,如实验室检测CEA水平,CT检查胸部、脑部、骨等组织器官有无转移灶,结肠镜检查CRC原发灶周围有无新病灶及转移灶出现以及患者一般情况。本组60岁以上的患者术后1年生存率为73.3%,而60岁以下的患者术后1年生存率为90%。所有患者中位生存期为53个月,术后1年、3年、5年生存率分别为88.0%、71.1%、46.5%。与国外文献报道[7-8]的CRC肺转移患者术后5年生存率为27%~68%基本相符。经筛选患者实施转移灶根治性切除术后,相对传统的化疗方法可获得更好的预后效果[9]。
CRC肺转移的治疗预后与多种因素有关。传统观念认为DFI长,往往预示有着相对良好的治疗效果[10]。Onaitis等[11]曾经报道DFI小于1年往往预示着在肺转移灶切除手术后容易复发,从而使术后预后不佳。然而,本组25例成功随访的患者中,DFI小于1年的有9例,其术后1年、3年生存率分别为88.9%、87.5%。分析其原因,笔者认为主要是由于本组病例选择适宜,患者术前的一般状况、免疫状态、耐受能力等较好,因而术后的临床预后效果较好。近年来诸多研究资料表明,并非所有报道都指向短DFI均降低术后生存率这一结论。尽管DFI与CRC原发灶切除和肺转移灶切除有临床相关性,但是近年来只有6项研究确切地报道了短DFI是CRC肺转移不良的预后因素[11-16]。Pfannschmidt等[17]发现DFI对于CRC肺转移患者并非是一个重要的预后因素,由本组患者得出的研究结果也与此结论相似。基于以上研究结果,并结合本组患者的研究分析可发现:短DFI可能是CRC肺转移灶切除术一项不良的预后因素,但绝不是CRC肺转移患者手术治疗的禁忌证。
CEA属于肿瘤细胞表面的结构抗原,在细胞质中形成,通过细胞膜到细胞外,进入周围体液中,可以在多种液体中检出。血清CEA水平可以反映体内癌细胞的数量以及癌细胞表达CEA的能力,被广泛用于各种消化道肿瘤的诊断和监测[18]。据相关文献报道,血清高水平CEA的CRC肺转移患者术后5年生存率为0~53%,而血清CEA正常的患者5年生存率为23%~80%[19]。本组获得随访的25例患者中,血清高水平CEA患者的5年生存率为26.5%,血清CEA正常患者的5年生存率为77.9%,提示高水平CEA患者预后相对不佳,该结论与文献报道相似。因此,对于高水平CEA患者,我们尚需探索更加行之有效的治疗方法。
目前手术治疗CRC肺转移患者依然是首选的治疗方式,而手术治疗成功与否的关键在于是否对转移灶进行了完全切除[20]。由于过去影像及手术技术的不完善,肺内多发转移灶不能被完全诊断及切除,许多学者认为这是CRC肺内多发转移患者术后明显不良的原因[21-22]。随着近年来诊断及手术技术的提高,特别是CT诊断技术的发展,肺内多发转移灶已不再认为是影响CRC肺转移患者的主要原因[6]。本组患者中有6例患者出现了肺内多发转移灶,术前我们对其进行了严格的影像学检查及评估,以确保手术能完全切除转移病灶。术后经统计学研究发现这6例患者生存时间与孤立灶转移患者生存时间差异无统计学意义(P=0.539),与当前的国外文献报道结论相符。
综上所述,对于CRC肺转移患者,转移灶切除是目前最好的治疗方法。术前对于转移灶切除术适应证应予以界定,即患者是否适用于肺转移灶切除,根据标准严格筛选手术患者。术中应对转移灶进行完全切除。经过严格筛选的患者,肺转移灶完全切除后可获得较长期生存,但手术指征不能无限扩大。以手术为核心的综合治疗是提高切除率、降低复发率的关键,也是延长生存期和提高生存率的必然趋势。
[1] Center MM,Jemal A,Smith RA,et al.Worldwide variations in colorectal cancer[J].CA Cancer J Clin,2009,59(6):366-378.
[2] Siegel R,Naishadham D,Jemal A.Cancer statistics,2012[J].CA Cancer J Clin,2012,62(1):10-29.
[3] McCormack PM,Burt ME,Bains MS,et al.Lung resection for colorectal metastases.10-year results[J].Arch Surg,1992,127(12):1403-1406.
[4] Kievit J.Follow-up of patients with colorectal cancer:numbers needed to test and treat[J].Eur J Cancer,2002,38(7):986-999.
[5] Desch CE,Benson AR,Somerfield MR,et al.Colorectal cancer surveillance:2005 update of an American Society of Clinical Oncology practice guideline[J].J Clin Oncol,2005,23(33):8512-8519.
[6] Gonzalez M,Ris HB,Krueger T,et al.Colorectal cancer and thoracic surgeons:close encounters of the third kind[J].Expert Rev Anticancer Ther,2012,12(4):495-503.
[7] Fiorentino F,Hunt I,Teoh K,et al.Pulmonary metastasectomy in colorectal cancer:a systematic review and quantitative synthesis[J].J R Soc Med,2010,103(2):60-66.
[8] Salah S,Watanabe K,Welter S,et al.Colorectal cancer pulmonary oligometastases:pooled analysis and construction of a clinical lung metastasectomy prognostic model[J].Ann Oncol,2012,23(10):2649-2655.
[9] Sanoff HK,Sargent DJ,Campbell ME,et al.Five-year data and prognostic factor analysis of oxaliplatin and irinotecan combinations for advanced colorectal cancer:N9741[J].J Clin Oncol,2008,26(35):5721-5727.
[10] Gonzalez M,Poncet A,Combescure C,et al.Risk factors for survival after lung metastasectomy in colorectal cancer patients:a systematic review and meta-analysis[J].Ann Surg Oncol,2013,20(2):572-579.
[11] Onaitis MW,Petersen RP,Haney JC,et al.Prognostic factors for recurrence after pulmonary resection of colorectal cancer metastases[J].Ann Thorac Surg,2009,87(6):1684-1688.
[12] Yedibela S,Klein P,Feuchter K,et al.Surgical management of pulmonary metastases from colorectal cancer in 153 patients[J].Ann Surg Oncol,2006,13(11):1538-1544.
[13] Lin BR,Chang TC,Lee YC,et al.Pulmonary resection for colorectal cancer metastases:duration between cancer onset and lung metastasis as an important prognostic factor[J].Ann Surg Oncol,2009,16(4):1026-1032.
[14] Rena O,Casadio C,Viano F,et al.Pulmonary resection for metastases from colorectal cancer:factors influencing prognosis.Twenty-year experience [J].Eur J Cardiothorac Surg,2002,21(5):906-912.
[15] Takakura Y,Miyata Y,Okajima M,et al.Short diseasefree interval is a significant risk factor for intrapulmonary recurrence after resection of pulmonary metastases in colorectal cancer[J].Colorectal Dis,2010,12(7 Online):e68-e75.
[16] Borasio P,Gisabella M,Bille A,et al.Role of surgical resection in colorectal lung metastases:analysis of 137 patients[J].Int J Colorectal Dis,2011,26(2):183-190.
[17] Pfannschmidt J,Dienemann H,Hoffmann H.Surgical resection of pulmonary metastases from colorectal cancer:a systematic review of published series[J].Ann Thorac Surg,2007,84(1):324-338.
[18] 李烜,胡守友.胃癌患者血清CEA、CA724、CA242、VEGF联合测定的临床意义[J].中国血液流变学杂志,2007,17(3):453-455.
[19] Gonzalez M,Ris HB,Krueger T,et al.Colorectal cancer and thoracic surgeons:close encounters of the third kind[J].Expert Rev Anticancer Ther,2012,12(4):495-503.
[20] Rusch VW.Pulmonary metastasectomy.Current indications[J].Chest,1995,107(6 Suppl):322S-331S.
[21] Pfannschmidt J,Muley T,Hoffmann H,et al.Prognostic factors and survival after complete resection of pulmonary metastases from colorectal carcinoma:experiences in 167 patients[J].J Thorac Cardiovasc Surg,2003,126(3):732-739.
[22] Zink S,Kayser G,Gabius HJ,et al.Survival,disease-free interval,and associated tumor features in patients with colon/rectal carcinomas and their resected intrapulmonary metastases[J].Eur J Cardiothorac Surg,2001,19(6):908-913.

