19例卵巢表面浆液性交界性乳头状瘤患者的临床特征和预后分析
肖喜荣 陈秀英 李 斌 符忠蓬 孙 莉
(1复旦大学附属妇产科医院妇科,2超声科 上海 200011)
卵巢交界性肿瘤是组织学特征和生物学行为介于良性和恶性的一类肿瘤亚型,包括浆液性交界性肿瘤、黏液性交界性肿瘤、子宫内膜样交界性肿瘤等多种类型,以浆液性交界性肿瘤最为常见[1]。卵巢上皮性浆液性肿瘤可以表现为囊性、表面增生性改变和间质增生性改变,相应的称之为浆液性囊性瘤、浆液性表面乳头状瘤和浆液性囊性腺纤维瘤[2]。卵巢表面浆液性交界性乳头状瘤(serous surface papillary borderline tumor,SSPBT)是一类特殊的卵巢交界性浆液性肿瘤,以实性肿块常见,因而术前容易诊断为恶性肿瘤[3]。SSPBT生物学行为及临床特征仅见个例报道[4]或小样本的影像学描述[3],国内尚未见文献报道。本研究就复旦大学附属妇产科医院收治的19例经病理学确诊为卵巢SSPBT患者的临床资料进行回顾性分析,总结卵巢SSPBT的临床特征。
资料和方法
临床资料 选取2010年1月至2012年6月期间在复旦大学附属妇产科医院妇科住院手术,术后病理证实为卵巢SSPBT患者共19例。总结其年龄分布、临床症状、临床分期、治疗方案等临床特征。
病理资料 调阅卵巢SSPBT患者的病理切片,由妇科病理学副主任以上医师采用单盲法重新读片。SSPBT定义为[5]:(1)肿瘤位于卵巢表面;(2)通常是实质性肿瘤;(3)肿瘤具有向内分支的乳头状结构(图1);(4)伴或不伴腹膜转移。
超声图像分析 调阅患者病史及术前超声图像,常规了解子宫和卵巢大小,测量卵巢肿物径线、内部回声、血流信号等,分析其超声学改变特点。
血清肿瘤标志物分析 调阅患者病史及术前血清肿瘤标志物报告,分析血清CA125、CA19-9和CEA水平与肿瘤的相关性。

图1 SSPBT病理改变Fig 1 Pathologic changes of SSPBT
随访 电话或门诊随访患者或家属,了解患者当前盆腔彩色多普勒超声和血清肿瘤标志物情况。如行保留生育功能手术,了解术后生育情况。
统计学处理 对数据进行描述性分析,包括平均数、最大最小值、率比等。
结 果
年龄分布 发病年龄最低25岁,最高55岁,平均(36.3±10.8)岁。如图2所示,年龄20~30岁组的患者最多(42.11%),其次为(31~40)岁组(31.58%),41~50岁组(10.53%)和51~60岁组(15.79%)最少。

图2 SSPBT患者的年龄分布Fig 2 Age distribution of SSPBT patients
临床特征 本组19例患者中,有10例无明显临床症状,均在体检或不孕检查时发现“盆腔包块”而就诊,有6例患者表现为腹胀腹痛不适,1例表现为阴道流血伴下腹隐痛,2例患者因“输卵管积水”手术时意外发现。19例患者中,绝经患者2例,其中有生育史患者9例,平均产次为(1.22±0.44)次,有生育要求患者11例,能够行保留生育功能手术的患者7例。
超声表现 19例SSPBT患者超声诊断结果见表1。19例SSPBT患者中,17例患者术前B超提示单侧或双侧肿块,其中6例在肿块内见卵巢或卵巢样组织,1例误诊为输卵管来源肿瘤,另有2例诊断为输卵管积水或输卵管卵巢囊肿,3例提示单侧或双侧卵巢包膜不清晰,1例提示单侧卵巢偏大,术中探查均见卵巢表面组织增生,活检确诊为SSPBT。肿瘤最大径线平均值为(87±27.16)mm,多表现为中低、中等或混合回声(图3),9例提示星点状或条索状血流信号,5例提示存在腹水。超声诊断卵巢肿瘤的检出率为94.73%(18/19),其中I期卵巢SSPBT的检出率为81.82%(9/11)。
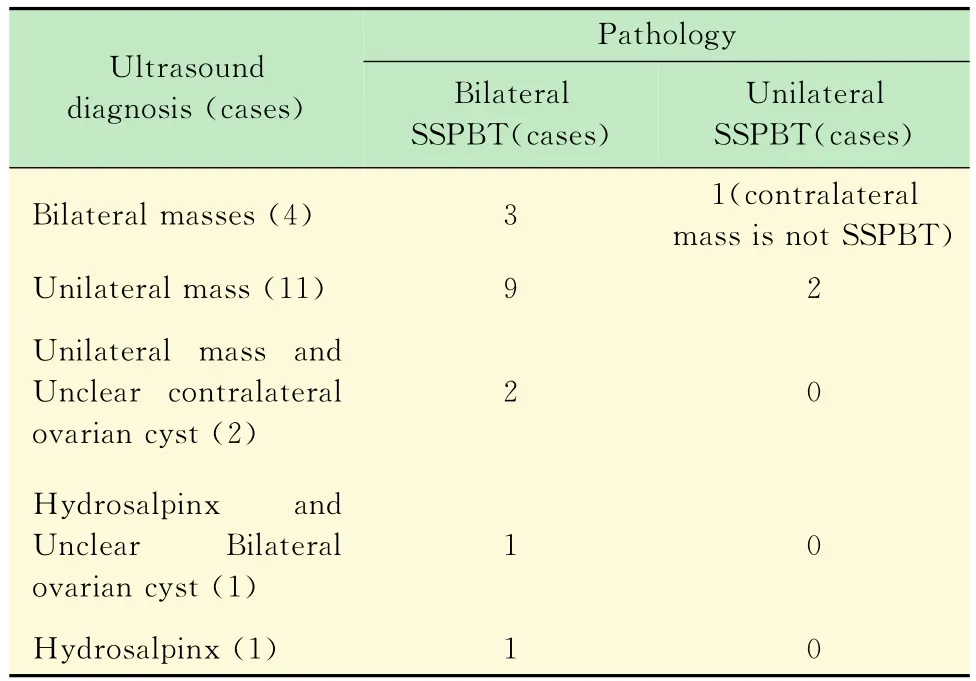
表1 19例SSPBT患者超声和病理诊断结果Tab 1 Ultrasound and pathology results of 19cases of SSPBT
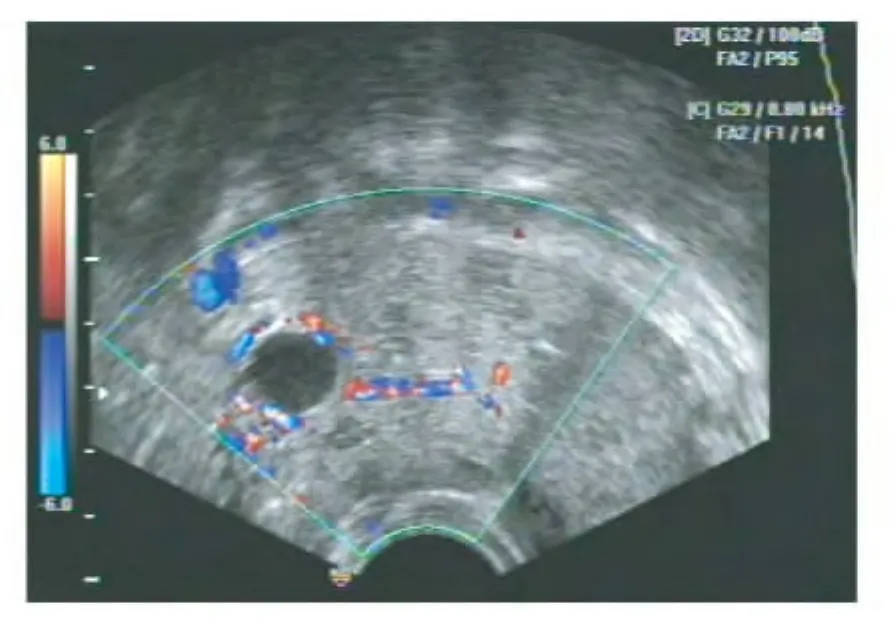
图3 SSPBT超声学改变Fig 3 Ultrasound findings of SSPBT
血清肿瘤标记物 本组19例患者中,17例术前检测血清肿瘤标记物CA125(表2)和CEA水平,16例患者行CA19-9检测。7例(43.75%)患者血清CA19-9水平升高,其中仅1例>200 U/mL(与CA125>700 U/mL为同一个患者),9例(56.25%)患者正常;所有患者血清CEA水平均在正常参考区间内。

表2 17例SSPBT患者CA125水平Tab 2 The CA125levels in 17cases of SSPBT
术中所见及术后病理 术中探查发现11例患者双侧卵巢表面赘生物,多呈菜花样、乳头状、粟粒样等表现;有5例术中发现单侧卵巢表面明显赘生物,另一侧卵巢表现为囊性增大或表面组织增生,而活检病理证实其中4例为双侧卵巢SSPBT。此外,有1例患者表现为双侧卵巢组织增生,术后病理证实为双侧SSPBT;1例表现为单侧卵巢囊性增大,术后病理证实为SSPBT;1例表现为患侧卵巢菜花样赘生物,对侧卵巢多房性囊肿,术后病理证实患侧为卵巢SSPBT,对侧卵巢浆液性囊腺瘤。因此,通过术中及术后病理总结,19例患者中双侧卵巢SSPBT占84.21%(16/19)。19例患者中,只有1例术后病理提示卵巢SSPBT伴局灶微浸润,余转移灶病理均提示SSPBT非浸润性种植。
治疗方案 8例患者经腹腔镜手术,11例患者经腹手术。7例行保留生育功能手术(2例Ⅲb期患者,1例Ⅲc期患者因强烈要求保留生育功能,充分知情同意后行保留生育功能手术),其中3例行双侧卵巢肿块剥离术,2例行一侧附件切除术,2例行一侧附件切除术+对侧肿块剥离术;5例行全子宫加双附件切除术(含肿瘤局灶微浸润患者),7例行全面的肿瘤分期手术。有8例患者术后辅助化疗,其中铂类+紫杉醇类3例,铂类+多西他赛5例。
随访 根据FIGO分期,19例患者中11例为Ⅰc期,3例为Ⅲb期,5例为Ⅲc期。5例失访均为外地患者,14例患者随访至2014年11月。有生育要求患者11例,其中行保留生育功能手术患者7例,这7例患者中有1例失访,有2例复发(其中1例为Ⅲc期患者术后行体外受精-胚胎移植后复发,1例为Ic期患者反复2次行患侧卵巢肿瘤切除术后复发,遂再次行患侧附件切除术后无复发),有3例未复发未生育,有2例患者成功生育,而4例未能行保留生育功能手术患者,2例失访,2例无复发。另外8例行全子宫双附件切除术或者全面的肿瘤分期手术患者中2例失访,6例无复发(含肿瘤局灶微浸润患者)。
讨 论
卵巢交界性肿瘤是一种低度恶性潜能的卵巢肿瘤,约占卵巢恶性肿瘤的10%~20%[6],与卵巢癌相比,其发病年龄有年轻化趋势。卵巢交界性肿瘤生长缓慢,患者生存率高,且复发一般仍为交界性肿瘤。根据卵巢上皮性肿瘤不同的增生特点,可分为囊肿形成、表面增生和间质增生几种类型,而表面增生仅存在于浆液性肿瘤[3]。SSPBT是一类较为特殊的卵巢交界性浆液性肿瘤,这类肿瘤于卵巢表面增生,双侧多见,容易脱落和种植,而卵巢具有正常形态和功能[7]。一旦诊断SSPBT,其分期至少为Ic期,故早期诊断具有重要临床意义。
SSPBT发病年龄轻,好发于育龄期妇女,本资料中患者发表年龄平均36.3岁,且20~40岁年龄段发病较多。SSPBT缺乏特异性的临床表现,术前诊断较困难,目前主要依靠术中所见、快速冰冻切片以及术后病理确诊。冰冻切片目前是肿瘤患者最终确定手术方式的重要参考[8],其对早期肿瘤患者的敏感度为81%[9],但是其对浆液性交界性肿瘤诊断灵敏度只有64.3%。超声是目前检查发现卵巢肿瘤较为方便、准确的方式,较高频率的探头能清晰显示盆腔脏器及病变,根据声像图特征及肿瘤血流信号、阻力指数等综合指标去判断肿瘤的赘生性和良恶性[10-12]。在这19例SSPBT患者中,超声诊断卵巢肿瘤的检出率达94.73%,以发现实性、囊实性、囊性肿块为依据,结合血流信号,从而协助卵巢肿瘤的诊断。尚未在卵巢表面形成肿块时,由于卵巢形态及功能基本正常,易诊断“双卵巢边界不清”,对提示“卵巢边界不清”的患者,要注意术中对卵巢的探查及卵巢活检;对尚无手术指征的患者,应缩短随访周期,严密监测卵巢变化。现有研究提示,对于B超提示可能存在恶性肿瘤的患者,MRI对于评估肿瘤的性质、累及范围等有重要参考价值,通过T1、T2成像可较好地区分肿瘤和正常的卵巢组织,且对于乳头的发现敏感性高[3,7],MRI在SSPBT的特征改变是本课题组接下来的研究方向。
CA125、CA19-9和CEA是妇科肿瘤最常用的肿瘤标志物,有研究表明CA125主要在浆液性卵巢肿瘤患者中表达,CEA主要在黏液性卵巢肿瘤中表达[13-14]。在本组病例中,有94.11%患者血清CA125水平升高,43.75% 患者血清CA19-9水平升高,所有患者血清CEA水平均在正常参考区间内,这基本与既往的研究结果一致。CA125及CA19-9对SSPBT的术前诊断有较大的参考价值,也是随访过程中的重要参考指标。但CA125的分泌与众多因素有关,如子宫内膜异位症、盆腔炎症等均可使CA125呈不同程度地升高[15]。HE4人附睾蛋白等卵巢肿瘤指标在SSPBT的表达尚未见文献报道,也是今后研究的方向之一。
针对SSPBT,目前尚无统一的治疗方案,主要根据肿瘤特点、FIGO分期以及患者的生育要求制定治疗方案。鉴于交界性肿瘤生长缓慢,患者生存率高,且复发一般仍为交界性肿瘤,年轻有生育要求的患者多选择保留生育功能的手术治疗,但有复发风险。本研究中7例行保留生育功能手术的患者中有2例复发,而行全子宫双附件切除术和全面肿瘤分期手术的患者至随访期限内无复发。由于病例数较少,对手术方式选择和远期复发率的相关性目前仍缺乏明确证据,故仅能建议若患者无生育需求,可考虑行根治性手术,以减少肿瘤复发可能。2例复发患者中,1例行腹腔镜手术和术后化疗,1例行开腹手术未化疗,因此,手术方式选择以及是否需要术后化疗仍然需要进一步的研究。
SSPBT虽然少见,但由于其特殊性,往往确诊时已经分期较高,而处于生育年龄的患者多有生育需求,因此早期诊断和合适的治疗方案尤其重要。目前主要是以手术为主综合治疗,而由于病例数缺乏,对于手术方式和途径的选择、化疗的必要性等问题还需要进一步的研究分析。对于行保留生育功能手术的患者,必须严密随访,以及时发现肿瘤复发和转移。
[1] Ren J,Peng Z,Yang K.A clinicopathologic multivariate analysis affecting recurrence of borderline ovarian tumors[J].Gynecol Oncol,2008,110(2):162-167.
[2] Bocker W.WHO classification of breast tumors and tumors of the female genital organs:pathology and genetics[J].Verh Dtsch Ges Pathol,2002,86:116-119.
[3] Tanaka YO,Okada S,Satoh T,et al.Ovarian serous surface papillary borderline tumors form sea anemonelike masses[J].J Magn Reson Imaging,2011,33(3):633-640.
[4] Kwon Y,Park SB,Lee JB,et al.Sonographic findings of an ovarian serous surface papillary borderline tumor[J].Clin Imaging,2013,37(6):1128-1130.
[5] Buy JN,Ghossain M.Gynecological imaging:a reference guide to diagnosis[M].Berlin:Springer-Verlag,2013:140.
[6] Gungor T,Cetinkaya N,Yalcin H,et al.Retrospective evaluation of borderline ovarian tumors:single center experience of 183 cases[J].Arch Gynecol Obstet,2014,291(1):123-130.
[7] Kim SH,Yang DM,Kim SH.Borderline serous surface papillary tumor of the ovary:MRI characteristics[J].AJR Am J Roentgenol,2005,184(6):1898-1900.
[8] Toneva F,Wright H,Razvi K.Accuracy of frozen section in the diagnosis of ovarian tumours[J].J Obstet Gynaecol,2012,32(5):479-482.
[9] Rose PG,Rubin RB,Nelson BE,et al.Accuracy of frozen-section (intraoperative consultation)diagnosis of ovarian tumors[J].Am J Obstet Gynecol,1994,171(3):823-826.
[10] 唐军,赖娟,耿京,等.术前诊断卵巢交界性肿瘤的超声特征[J].中国妇产科临床杂志,2007,8(3):172-174,184.
[11] Chu LC,Coquia SF,Hamper UM.Ultrasonography evaluation of pelvic masses[J].Radiol Clin North Am,2014,52(6):1237-1252.
[12] van Nagell JJ,Hoff JT.Transvaginal ultrasonography in ovarian cancer screening:current perspectives[J].Int J Womens Health,2013,6:25-33.
[13] Shih KK,Zhou Q,Huh J,et al.Risk factors for recurrence of ovarian borderline tumors[J].Gynecol Oncol,2011,120(3):480-484.
[14] Allison KH,Swisher EM,Kerkering KM,et al.Defining an appropriate threshold for the diagnosis of serous borderline tumor of the ovary:when is a full staging procedure unnecessary?[J].Int J Gynecol Pathol,2008,27(1):10-17.
[15] Ozhan E,Kokcu A,Yanik K,et al.Investigation of diagnostic potentials of nine different biomarkers in endometriosis[J].Eur J Obstet Gynecol Reprod Biol,2014,178:128-133.

