反胶束体系中漆酶催化愈创木酚的研究
刘 欢,袁兴中,彭 馨,包 姗,马玉杰,吴秀莲,曾光明
(湖南大学环境科学与工程学院,湖南 长沙 410082)
反胶束体系中漆酶催化愈创木酚的研究
刘 欢,袁兴中*,彭 馨,包 姗,马玉杰,吴秀莲,曾光明
(湖南大学环境科学与工程学院,湖南 长沙 410082)
采用4种不同属性类型的表面活性剂(CTAB,Tween-80, AOT以及鼠李糖脂)构建反胶束体系,以木质素模式物愈创木酚为底物,研究了漆酶在反胶束环境中催化愈创木酚的特性,通过对不同反胶束环境中漆酶酶活的对比,确定在4种反胶束体系中,适合酶解反应的最佳表面活性剂浓度和对应的最佳含水率w0.分别为:CTAB浓度20mmol/L,w0=20;Tween 80浓度50mmol/L,w0=25;AOT浓度30mmol/L,w0=10;鼠李糖脂浓度10mmol/L,w0=30.并考察了表面活性剂类型属性对愈创木酚在反胶束体系中酶解行为的影响和底物动力学.结果表明,最佳表面活性剂浓度以及对应的最适含水率条件下,阴离子表面活性剂AOT和鼠李糖脂的反胶束体系中愈创木酚底物的催化效果较好,鼠李糖脂反胶束体系中底物的催化率最高,反应6h后分别比 CTAB、Tween-80以及AOT反胶束体系中的转化率高44.12%、34.6%、29.43%.
反胶束;漆酶;愈创木酚;表面活性剂;鼠李糖脂
木质素是一种大量存在于植物秸秆、木材中的第二大天然有机物质,是一种由愈创木基结构、紫丁香基结构和对羟苯基结构通过醚键和碳碳键连接而成的聚酚类三维网状不溶性聚合物[1].木质素的这种复杂结构使木质素在自然界中的降解困难且缓慢,制约了水稻秸秆等农业固体废物的减量化、资源化和再利用.国内外的研究发现,白腐真菌产生的漆酶(Laccase)、木质素过氧化物酶(Lip)和锰过氧化物酶(Mnp)具有高效降解木质素和其他多种有机污染物的能力[2-4].其中漆酶是单电子多酚氧化还原酶,具有在没有H2O2和其他次级代谢产物存在下,直接催化木质素等有机污染物氧化的优势[5].
反胶束酶反应系统是表面活性剂超过其临界胶束浓度时自组装形成纳米尺寸的聚集体,能够模拟生物细胞内的微环境,由于表面活性剂胶团的屏蔽作用,反胶束中包裹的酶不会接触有机溶剂,从而能够有效保持酶的活性[6].因此,反胶束在酶催化反应中的应用越发广泛[7].相比化学表面活性剂,生物表面活性剂是一种环境友好型的天然表面活性剂,具有低毒、可降解、生态相容和高效等优势.近年来,关于木质素在反胶束体系中降解的研究在国内外逐渐展开,然而对于在生物表面活性剂所构建反胶束体系中木质素降解机制的研究,国内鲜有报道[6-8].
木质素在自然界中存在方式特殊,不能把整个木质素分子以其完整状态分离出来,因此本研究选择木质素分子愈创木基结构的模式物质——愈创木酚进行漆酶催化木质素的研究.本研究采用不同浓度的阳离子表面活性剂CTAB、非离子表面活性剂Tween 80、以及阴表面活性剂鼠李糖脂和AOT分别构建反胶束体系.考察含水率w0、表面活性剂浓度及属性、愈创木酚浓度对白腐菌漆酶催化木质素反应行为的影响.同时,评估各类反胶束体系中漆酶催化愈创木酚的动力学机制,以期为了解木质素在反胶束体系中的降解和进一步探讨酶在反胶束体系中的应用提供更多依据,明确反胶束体系中木质素的酶解机制提供理论依据,也为生物表面活性剂在反胶束体系中的应用提供参考.
1 材料和方法
1.1 仪器和试剂
紫外分光光度计(Shimadzu UV-2552,Japan);高效液相色谱仪(Agilent Technologies, California,USA);气质联用仪(Thermo Finnigam-TRACE GC, Polaris Q, USA);电热恒温水浴锅(DSY-1-4孔);水浴恒温振荡器(WHY-2);超声波清洗仪;pH计(PHS-2F,上海雷磁仪器厂).
十六烷基三甲基溴化铵(CTAB,天津市博迪化工有限公司)、吐温80(Tween 80,天津市博迪化工有限公司)、双(2-乙基己基)琥珀酸酯磺酸钠(AOT,Sigma试剂);鼠李糖脂(RL,湖州紫金生物科技有限公司);白腐菌漆酶(Sigma试剂);愈创木酚(天津科密欧化学试剂有限公司); ABTS (Sigma试剂);0.1mol/L柠檬酸-柠檬酸钠缓冲溶液(pH4.5),异辛烷、正己醇及实验过程中所用的其他试剂均为分析纯,使用过程中无需进一步纯化,水为超纯水.
1.2 实验方法
1.2.1 最适含水率w0的测量 采用ABT法测定漆酶在反胶束体系中的酶活性[7].首先将一定量表面活性剂加入体积比为1:1的正己醇/异辛烷混合液制成CTAB、Tween 80、AOT和鼠李糖脂浓度为10,20,30,40,50mmol/L的有机溶液,再加入1mol/L的ABTS的缓冲溶液超声震荡混合均匀,配制成含ABTS反胶束溶液.采取同样方法配制含1mg/L漆酶缓冲液的反胶束溶液.取2mL漆酶混合液与一定量的缓冲液(最适w0设置一系列值)混合均匀后,加入2mL ABTS混合液,超声振荡数秒后于UV420nm下测定120s内的吸光度的变化,定义单位时间里单位mol愈创木酚吸光度变化0.001所需的酶量为一个酶活力单位(U),计算其酶活,得到酶活随含水率w0变化的关系,以确定酶活最高点所对应的表面活性剂浓度和相应的含水率w0.
1.2.2 反胶束体系漆愈创木酚的酶降解 将一定量的愈创木酚溶解于上述表面活性剂/异辛烷/正己醇混合液制成不同愈创木酚浓度的有机溶液,超声振荡至澄清透明;取漆酶缓冲液(根据最适w0)加入有机溶液混合,于30℃, 120r/min的振荡培养箱中反应6h,每小时取样1次,用高效液相色谱测定愈创木酚含量变化.根据前1h的反应计算反应的初始速率,用每秒钟消耗的愈创木酚量mol/(L·s)表示.
1.2.3 愈创木酚浓度测定(液相色谱分析) 取离心后有机相过0.45μm滤膜,用色谱纯乙腈稀释10倍,采用HPLC测定.色谱条件:色谱柱C18(250mm× 4.6mm,5μm,Agilent);流动相,V(甲醇):V(水)=1:1;流速0.8mL/min;紫外检测器,波长285nm.
1.2.4 气相色谱-质谱联用分析(GC-MS) GC测试条件:HP-5MS石英毛细管柱(30mm× 0.25mm×0.25mm).柱温45℃下停留4min,以3℃/min升温至280℃ ,停留15min.进样口温度250℃,检测器温度为280℃ .He柱流量1.0L/min;进样量1.0μL;载气为氦气.MS测试条件:电离方式EI,电离源的电子能量为70eV,离子源温度230℃,扫描范围(m/z)为15~500.
2 结果和讨论
2.1 反胶束体系最适佳含水率
在反胶束酶催化反应中,适量水的存在是维持酶的催化活性及稳定性的关键因素.反胶束中的水通常以自由水和结合水两种形式存在[9].反胶束体系中水的含量,通常用含水率w0来表示:
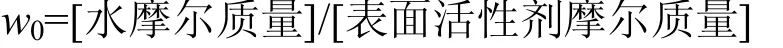
w0与反胶束形成胶团的大小间存在着线性关系,反胶束的半径随w0增加而增大,是评价反胶束的重要指标之一[10-11].如图1所示,酶活最大时的w0即为反胶束酶催化反应的最佳含水率.漆酶酶活最大值分别在CTAB浓度为20mmol/L,w0=20时;鼠李糖脂浓度为10mmol/L, w0=30时;AOT浓度为30mmol/L, w0=10时;Tween 80浓度为50mmol/L,w0=25时.对水的增溶能力,鼠李糖脂>Tween80>CTAB> AOT,在4种反胶束体系中含水率较低时, 反胶束体系中胶团数量较少且尺寸较小,纳米水核中自由水含量少,不能有效增溶酶分子,从而使漆酶大量暴露于有机环境之中而逐渐失活.而且此时反胶束中的大部分水都是与表面活性剂相结合的结合水,自由水含量少,反胶束水核的粒径较小,限制了酶转化为具有催化活性的构象.
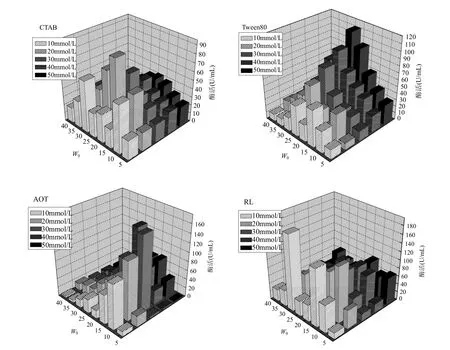
图1 w0对漆酶酶活的影响Fig.1 Effect of w0 on enzyme activities
随着w0的增加至超过其最佳含水率,反胶团的胶团粘度明显降低,胶束稳定性降低,酶分子构象受到扰动,酶的活性部位也难以有效指向胶束界面,导致漆酶活性显著下降[11-12].同时容纳蛋白质的有效空间一定程度上会影响到胶束内部的构型,通常认为只有当酶蛋白分子的大小与反胶束内核的大小匹配时,体系中的酶才能表现出较高的活性[13-14].此外,反胶束中油水界面上表面活性剂单分子层的厚度以及表面活性剂的亲水基类型和构形都对酶的催化性能具有一定的调控作用[6].在最佳w0时,蛋白质结构的动力学刚性和热力学稳定性之间可以达到最佳平衡,酶能以最活跃的状态参与反应,从而使底物的降解率得到提高[7].图1中也可以看出,在4种表面活性剂浓度较低时酶活随w0变化出现多个极值的情况,Gazaryan等[13,15]指出,可能与单体、二聚体、四聚体等的胶束尺寸有关,在检测反胶束中漆酶催化双酚A的反应时也出现了类似的现象.随着表面活性剂浓度升高,体系中胶团数量增加,形成的胶束水核体积减少,不利于漆酶多聚体的形成,酶活随之降低.
2.2 反胶束体系最适表面活性剂浓度
在反胶束酶催化反应中,表面活性剂浓度是影响酶活性的重要因素[6].可能是由于漆酶中存在具有疏水性作用的不同类型的锚定基团,表面活性剂分子可以和酶分子的疏水性锚定基团结合,当表面活性剂浓度改变时,酶的活性也发生变化[16].如图1所示,在w0值恒定时,总体上酶活随着表面活性剂浓度的升高呈钟罩型变化,其原因可能是在恒定w0条件下表面活性剂浓度增大,反胶束体系中胶团内的静电排斥力随之增大,使得胶团数量不断增加,胶团之间和酶分子与底物之间的接触和碰撞机率也更频繁,同时反胶束中刚性的表面活性剂外壳包围并限制着酶分子,使其与外界隔离,保护漆酶免受周围有机溶剂的影响,为酶提供了一个天然、稳定的环境,使得漆酶可以在长时间内保持活性,并保持较高的热稳定性,因此反胶束酶系统中酶活随着表面活性剂浓度的增加出现增大的趋势[17].当浓度继续增加,相界面上的表面活性剂分子达到饱和, 部分底物通过与表面活性剂发生静电吸引或疏水性亲合而分布于微胶层中,从而与反胶束系统中的表面活性剂“膜”紧密结合[6].表面活性剂浓度的增加,抑制了底物在有机相及反胶束中心水核间的扩散,减少了底物与酶的接触,单位时间内酶和底物的接触机率变小引起酶活的下降,同时高浓度的表面活性剂可能导致酶的变性[6,18].
对比可知,4种表面活性剂构建的反胶束中,在鼠李糖脂反胶束体系中较低的表面活性剂浓度下漆酶表现出较高的催化活性.
2.3 反胶束体系催化反应行为

图2 不同反胶束体系对底物降解的影响Fig.2 Effect of different systems on substract degradation
图2中,初始浓度为1mmol/L愈创木酚,在CTAB、Tween 80、AOT和鼠李糖脂和4种表面活性剂构建的反胶束体系中, 6h后愈创木酚的转化率,分别达到21.33%、30.85%、36.02%、 65.45%.降解效果生物表面活性剂鼠李糖脂>阴离子表面活性剂AOT>非离子表面活性剂Tween80>阳离子表面活性剂CTAB.由此说明,表面活性剂的类型也是影响反胶束体系中漆酶活性的一个重要因素,不同属性的表面活性剂对漆酶的稳定性和活性都有着不同的影响.阴离子表面活性剂(AOT和鼠李糖脂)构建的反胶束体系中底物的降解效果优于阳离子表面活性剂和非离子表面活性剂.漆酶的等电点(pI)值为约≤3.5[19],反应体系的水相pH值为4.5,因此,漆酶表面带负电荷.在CTAB体系中,可能由于漆酶所带的负电荷与阳离子表面活性剂所带正电荷之间的强大静电引力作用,致使漆酶的催化活性发生变化,甚至导致了部分酶的变性,因此木素模式物的降解率较低;而在阴离子表面活性剂AOT和鼠李糖脂中胶束的负电势促使酶-底物复合物形成几率增加,有利于漆酶催化底物,相比鼠李糖脂构建的反胶束, AOT分子极性头的静电作用以及酶分子与反胶束之间的疏水相互作用对酶活性产生的不利影响,另外,在非离子表面活性剂体系中,漆酶并没有表现出很高的活性,可以推断,表面活性剂分子与漆酶分子间的静电斥力有助于提高漆酶的催化效率,而静电引力作用对漆酶的催化降解反应有着一定的抑制作用[6].
2.4 反胶束中酶催化动力学研究
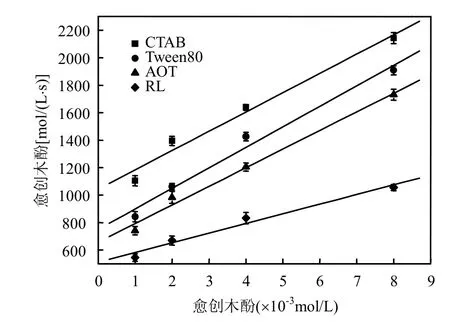
图3 不同底物浓度下反应初始速率的Hanes-Woolf曲线Fig.3 Hanes-Woolf plot of initial velocity at different substrate concentrations

表1 酶反应的动力学参数表Table 1 Summary of experimental kinetic parameters of the enzymatic reactions in RMs
由图3计算出动力学常数如表1所示,漆酶在生物表面活性剂鼠李糖脂构建的反胶束中的催化效率分别是阳离子表面活性剂CTAB、阴离子表面活性剂AOT、非离子表面活性剂Tween 80的2.04、1.28、1.46倍.
2.5 产物分析
漆酶主要催化愈创木酚碳碳键和碳氧键的断裂,参与愈创木酚的解聚和聚合反应.首先底物结合于酶活性中心一型铜原子位点,通过Cys-His途径将电子传递给三核位点,该位点又把电子传递给氧分子,使其还原成水.同时底物形成自由基,它们可以自身结合或相互偶联,形成聚合物或偶联产物[20].漆酶催化愈创木酚的底物主要为水溶性的4-邻甲基苯酚(图4).

图4 漆酶催化愈创木酚的过程Fig.4 Oxidative pathway of laccase catalysis guaiacol
此外,生物表面活性剂构建的反胶束体系与化学表面活性剂构建的反胶束体系相比,达到最佳酶活所需的表面活性剂浓度较低,增溶水的能力比化学表面活性剂构建的反胶束强,漆酶催化效率高.这是由于生物表面活性剂产生于微生物、动物或植物的代谢过程中,不仅除具有低毒、选择性好、环境友好、易被微生物降解等优点,还能够增强酶与底物的吸附作用[6-7],使其构建的反胶束体系具有较强的稳定性.另外,生物表面活性剂具有复杂的分子结构,其中一些特殊的官能团,使其表现出较强的专一性[21],从而避免了其他其它因素的干扰.这即体现了生物表面活性剂的优势所在,说明生物表面活性剂其在构建反胶束体系及增强反胶束稳定性能上具有着特殊的潜力[22-23].
3 结论
3.1 不同种类表面活性剂反胶束体系中,含水率w0对酶活的影响差别较大,CTAB、Tween 80、 AOT和鼠李糖脂4种表面活性剂构建的反胶束体系最佳表面活性剂浓度和对应的最佳含水率分别为为CTAB浓度20mmol/L,w0=20; Tween 80浓度50mmol/L,w0=25;AOT浓度30mmol/L, w0=10;鼠李糖脂浓度10mmol/L, w0=30.
3.2 在最适佳含水率条件下制备构建的反胶束体系中,各表面活性剂在底物浓度为1mmol/L时,CTAB、Tween80、AOT和鼠李糖脂4种反胶束体系中木质素模式物的漆酶降解效率分别为21.33%、30.85%、36.02%、65.45%.
3.3 在阳离子、阴离子和非离子几种类型的表面活性剂中,同属于阴离子表面活性剂的AOT和鼠李糖脂构建的反胶束体系的底物降解率均高于CTAB和Tween 80体系,说明阴离子表面活性剂更适宜漆酶的反应,且鼠李糖脂反胶束中漆酶的活性和稳定性均高于AOT反胶束,说明使用生物表面活性剂代替化学表面活性剂有利于提高反胶束体系中酶的催化性能.
[1]Tejado A, Pena C, Labidi J, et al. Physico-chemical characterization of lignins from different sources for use in phenol-formaldehyde resin synthesis [J]. Bioresource Technology, 2007,98(8):1655-1663.
[2]Chen Z, Liang L, Zeng G M, et al. Utilization of nano-gold tracing technique: Study the adsorption and transmission of laccase in mediator-involved enzymatic degradation of lignin during solid-state fermentation [J]. Biochemical Engineering Journal, 2014,91:149-156.
[3]Hwanhwi L, Yeongseon J, Yong-Seok C, et al. Biotechnological procedures to select white rot fungi for the degradation of PAHs[J]. Journal of Microbiological Methods, 2014,97:56-62.
[4]Josep A M, Mario M M, Cayo C, et al. Degradation of selected agrochemicals by the white rot fungus Trametes versicolor [J]. Science of The Total Environment, 2014,500-501:235-242.
[5]Thurston C F. The structure and function of fungal laccases [J]. Microbiology, 1994,140(1):19-26.
[6]Liang Y S, Yuan X Z, Zeng G M, et al. Effects of surfactants on enzyme-containing reversed micellar system [J]. Science China Chemistry, 2011,54(5):715-723.
[7]王伟伟,袁兴中,曾光明,等.逆胶束体系中纤维素酶解特性研究[J]. 环境科学, 2010,31(10):2202-2207.
[8]方振敏,袁兴中,曾光明,等.不同反胶束体系萃取纤维素酶的条件优化对比研究 [J]. 中国环境科学, 2013,33(4):734-740.
[9]Venables D S, Huang K, Schmuttenmaer C A, et al. Effect of reverse micelle size on the librational band of confined water and methanol [J]. The Journal of Physical Chemistry B, 2001,105(38):9132-9138.
[10]Junji M, Hirofumi I, Noriho K, et al. Biodegradation of phenolic environmental pollutants by a surfactant-laccase complex in organic media [J]. Journal of Bioscience and Bioengineering,2005,99(6):642-647.
[11]崔凯龙,袁兴中,曾光明,等.生物表面活性剂用于逆胶束体系的构建及微水相条件优化 [J]. 中国环境科学, 2011,31(9):1444-1450.
[12]Khmelnitsky Y L, Kabanov A V, Klyachko N L, et al. Structure and reactivity in reverse micelles [M]. New York: PileniM P,Elsevier Co, 1989:237.
[13]Shin-ya O, Junji M, Masahiro G, et al. Oxidation of bisphenol A catalyzed by laccase hosted in reversed micelles in organic media [J]. Enzyme and Microbial Technology, 2002,31:227-232.
[14]Urvish C, Akshaya G. Possible role of laccase from Fusarium incarnatum UC-14in bioremediation of Bisphenol A using reverse micelles system [J]. Journal of Hazardous Materials,2013,254-255:149-156.
[15]Gazaryan I G, Klyachko N L, Dulkis Y K, et al. Formation and property of dimeric recombinant horseradish peroxidase in a system of reversed micelles [J]. Biochem. J, 1997,328:643-647.
[16]Kabanov A V, Levashov A V, Klyachko N L, et al. Enzymes entrapped in reversed micelles of surfactants in organic solvents:A theoretical treatment of the catalytic activity regulation [J]. Journal of Theoretical Biology, 1988,133:327-343.
[17]Konstantza T, Zdravka L. Reversed micelle solvents as tools of enzyme purification and enzyme-catalyzed conversion [J]. Biochimica et Biophysica Acta, 2008,26(6):516-532.
[18]Franquevile E, Loutrari H, Mellou F, et al. Reverse micelles, a system for antibody-catalysed reaction [J]. Journal of Molecular Catalysis B: Enzymatic, 2003,21(1/2):15-17.
[19]康从宝,刘 巧,李清心,等.白腐菌产漆酶的纯化及部分酶学性质 [J]. 中国生物化学与分子生物学报, 2002,18(5):638-642.
[20]Messerschmidt A1, Ladenstein R, Huber R, et al. Refined crystal structure of ascorbate oxidase at 1.9A resolution [J]. Journal of Molecular Biology, 1992,5,224(1):179-205.
[21]张胜天,等.生物表面活性剂及其应用 [M]. 北京:化学工业出版社, 2005.
[22]Mohd-Setapar S H, Mohamad-Aziz S N, Harun N H, et al. Review on the extraction of biomolecules by biosurfactant reverse micelles [J]. Apcbee Procedia, 2012,3:78-83.
[23]彭子原,袁兴中,彭 馨,等.生物表面活性剂逆胶束中漆酶催化性能的研究 [J]. 中国环境科学, 2013,33(6):1091-1096.
Guaiacol catalysis by laccase in the reverse micellar systems.
LIU Huan, YUAN Xing-zhong*, PENG Xin, BAO Shan,MA Yu-jie, WU Xiu-lian, ZENG Guang-ming
(College of Environmental Science and Engineering, Hunan University,Changsha 410082, China).
China Environmental Science, 2015,35(2):493~498
In order to investigate the characteristics of the catalytic activity of laccase, several types of surfactants were adopted to construct reverse micelles, using guaiacol as substrate. The activity of laccase activity was measured to determine the optimum surfactant concentration and corresponding water solubilization w0of CTAB, Tween-80, AOT and rhamnolipid reverse micelle systems. The optimum surfactant concentrations were 20, 50, 30, 10mmol/L with corresponding water content of 20, 25, 10, 30mmol/L for CTAB, Tween-80, AOT and rhamnolipid reverse micellar systems, respectively. Under this condition the effects of surfactant type on the catalytic activity of reverse micellar systems were studied. The transforming rate of substrate in the micellar system constructed by anionic surfactant was higher than these of the others, and the rhamnolipid micelle system performed best. After 6h, the conversion rate of rhamnolipid reverse micellar systems compared with CTAB,Tween-80and AOT reverse micelle systems were 44.12%,34.6% and 29.43% higher, respectively.
reverse micelle;laccase;guaiacol;surfactant;rhamnolipid
X712
A
1000-6923(2015)02-0493-06
刘 欢(1990-),女,湖南宁乡人,湖南大学硕士研究生,
2014-06-20
国家自然科学基金资助项目(50978087)
* 责任作者, 教授, yxz@hnu.edu.com
主要从事固废资源化方面的研究.

