肝动脉灌注化疗栓塞术联合射频消融术治疗肝癌的疗效与安全性分析
温建生 李成业 吴智群 岳 琨 路红娟
原发性肝癌(hepatocellular carcinoma,HCC)为临床常见恶性肿瘤,其发病率居恶性肿瘤的第5位,病死率居第3位,且近年来其发病率和病死率均有上升趋势[1]。HCC早期确诊难度较大,多数患者确诊时即已发展为中晚期,失去了手术治疗的最佳时机。介入治疗是目前学者们普遍认可的用于晚期HCC临床治疗的方案,其中,以肝动脉灌注化疗栓塞术(transcatheter arterial chemoembolization,TACE)和射频消融术(radiofrequency ablation,RFA)为主的介入治疗方法在HCC临床治疗中的应用最为广泛[2-3]。我院自2009年开始采用TACE联合RFA术对晚期HCC患者进行治疗,取得了较好的疗效,现总结报告如下。
1 资料与方法
1.1 一般资料
选取我院2009年1月-2011年11月收治的不能行手术治疗的HCC患者114例的临床资料。病例纳入标准[2-3]:①均经超声诊断和(或)CT定位肝脏穿刺病理活检证实为HCC;②均不能行手术治疗,未接受其他治疗;③CT或MRI检查未见癌细胞远处转移;④均知情同意。病例排除标准[2-3]:①合并严重心、脑血管及内分泌疾病者;②合并精神疾病者;③合并其他肿瘤者及治疗依从性较差者。按照随机分组的方法将114例患者分为2组。观察组57例,男性32例,女性25例,年龄26~74岁,平均年龄(51.3 ±12.2)岁;肿瘤大小 1.3 ~5.6 cm,平均(3.3 ±2.2)cm;肝功能Child-Pugh分级:A级 33例,B级 24例;Karnofsky(KPS)功能状态评分70~80分;甲胎蛋白(Alpha fetoprotein,AFP)> 400 μg/L 者 44 例,AFP < 400 μg/L者13例。对照组57例,男性33例,女性24例,年龄25~75岁,平均年龄(51.6 ±11.5)岁;肿瘤大小 1.4~5.8 cm,平均(3.5 ±2.3)cm;肝功能 Child-Pugh 分级:A级35例,B级22例;KPS评分70~80分;AFP>400 μg/L者 45例,AFP<400 μg/L者12例。2组患者一般资料(年龄、性别、肿瘤直径、AFP值、肝功能Child-Pugh分级及KPS评分等)经比较,差异无统计学意义(P >0.05),具有可比性。
1.2 方法
1.2.1 设备 射频系统:美国RITA 1500X多极射频消融仪,射频电极针型号为Starbust TM XL;数字减影血管照影仪:日本东芝数字减影血管照影(digital subtraction angiography,DSA)仪,Yashrio及 RH 导管型号为Terumo 5F,原装Progreat微导丝及微导丝系统;CT:德国Emotion-16 CT机。
1.2.2 治疗方法 对照组接受TACE治疗。经股动脉穿刺插管,常规行肝动脉及肠系膜上动脉造影以确定肿瘤病灶大小、部位及其供血情况,并观察肿瘤细胞是否侵犯门静脉及其侵犯程度。超选择至肿瘤供血动脉,经导管注入奥沙利铂(用量为130 mg/m2,江苏奥赛康药业股份有限公司生产)并注意控制注射时间大于15 min。再将栓塞剂碘化油及吡柔比星(用量为25~40 mg/m2,万乐药业有限公司生产)混合液缓缓注入导管,进行栓塞治疗。碘化油用量一般为10~15 ml,对于超过20 ml仍未能栓塞的肿瘤动脉血管应另加注入胶海绵颗粒(直径1 000 μm),直至血流瘀滞。
观察组于TACE治疗后2~3周经DSA引导下行RFA治疗。治疗前经DSA正位及侧位透视,观察碘化油沉积以明确肿瘤部位、大小,确定进针方向和角度,再行穿刺治疗。调整多极射频消融仪工作频率为400 kHz,控制射频针尖温度为90~110℃。患者常规静脉麻醉后,于穿刺点处行0.2~0.3 cm进针切口,经DSA引导下穿刺,根据肿瘤大小,分别采用多针、多点及多层面重叠的方法进行治疗,治疗范围应覆盖全部病灶并超出病灶边界1.0 cm处。一个位点射频消融治疗完成后应行针道射频止血,并应密切观察有无气胸发生。
1.3 观察指标
(1)比较2组治疗前及治疗后12个月的AFP值、肿瘤体积及肿瘤完全坏死率等指标的变化,比较2组治疗后肿瘤血供消失率及肿瘤完全坏死率[4-5]。(2)疗效评价:治疗后12个月,根据WHO有关实体肿瘤疗效评价标准统计分析治疗效果,疗效评价分为完全缓解(CR)、部分缓解(PR)、稳定(SD)及进展(PD)。治疗总有效率计算公式为:(CR+PR)/总病例数×100%。(3)随访1年、2年及3年生存率。(4)统计分析2组治疗中的不良反应发生情况。
1.4 统计学分析
所有研究数据输入Excel表格进行统计分析。应用SPSS 17.0统计学软件进行数据处理。计量资料采用(均数±标准差)(s)的形式表示,采用t检验;计数资料采用百分比(%)的形式表示,行χ2检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 治疗前及治疗后主要指标比较
2组治疗后AFP值及肿瘤体积变化与治疗前比较均有改善,治疗前后比较差异均有统计学意义(P<0.05)。治疗后12个月观察组AFP值及肿瘤体积变化均优于同时段的对照组,2组比较差异有统计学意义(P <0.05)。见表1。
2.2 2组肿瘤完全坏死率比较
观察组肿瘤血供消失率及肿瘤完全坏死率均优于对照组,2组比较差异有统计学意义(P<0.05)。见表2。
2.3 治疗总有效率比较
治疗后12个月,观察组治疗总有效率为84.21%,高于对照组的64.91%,2组比较差异有统计学意义(χ2=8.663,P <0.05)。见表3。
表1 2组治疗前及治疗后主要指标比较(n=57,s)
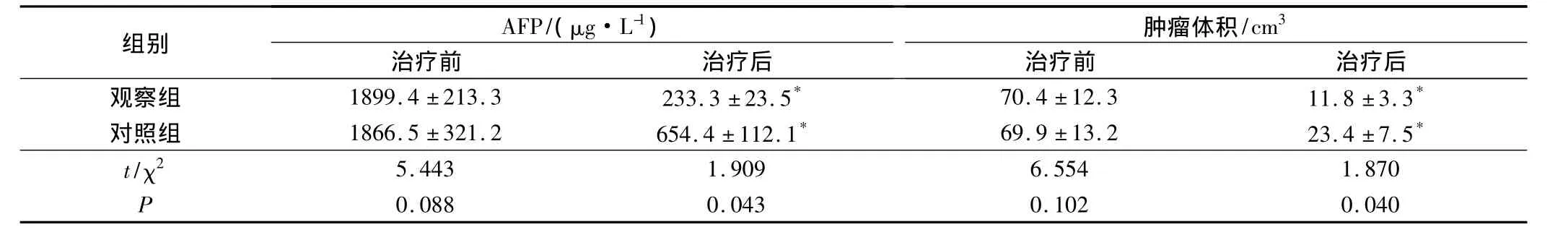
表1 2组治疗前及治疗后主要指标比较(n=57,s)
注:*为与治疗前比较,P<0.05。
组别 AFP/(μg·L-1)肿瘤体积/cm3治疗前 治疗后观察组 1899.4 ±213.3 233.3 ±23.5* 70.4 ±12.3 11.8 ±3.3治疗前 治疗后*对照组 1866.5 ±321.2 654.4 ±112.1* 69.9 ±13.2 23.4 ±7.5*t/χ2 0.088 0.043 0.102 0.040 5.443 1.909 6.554 1.870 P
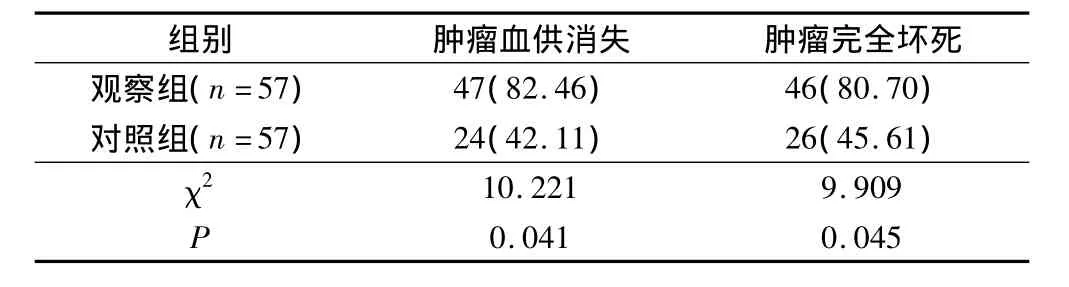
表2 2组肿瘤完全坏死率比较(例,%)

表3 2组近期疗效评价比较(例,%)
2.4 随访生存率
观察组1、2、3年随访生存率均高于对照组,2组比较差异均有统计学意义(P<0.05),见表4。
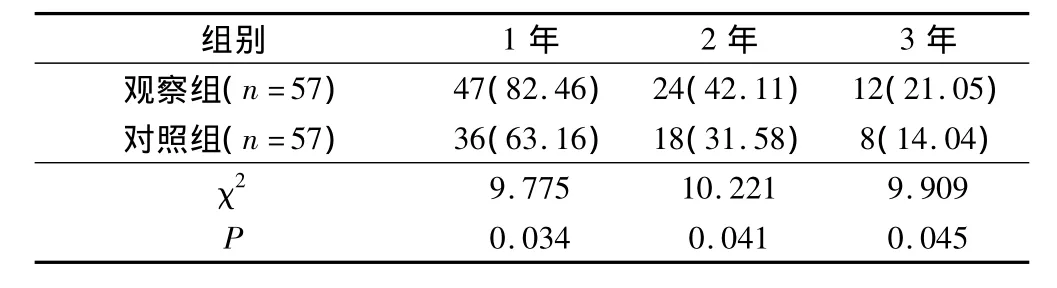
表4 2组患者1年、2年及3年随访生存率(例,%)
2.5 不良反应发生情况
TACE治疗后常见不良反应为恶心、呕吐、发热等栓塞后综合征,RAF治疗后常见并发症为低热、肝区疼痛及血清转氨酶升高等,经止吐、抑酸及镇痛、保肝药物对症治疗后恢复。2组患者均能耐受治疗。
3 讨论
TACE为目前治疗中晚期HCC的首选介入治疗方案,其相对于全身化疗而言,具有集中治疗病灶区域的优势,还可以对血管进行栓塞以阻止癌病灶的血液供应,从而最大限度地杀死癌细胞、保存肝脏功能并减少治疗中的毒副作用[6]。但有学者[7]研究表明,TACE对中晚期HCC的治疗仅可达到不超过40%的肿瘤完全坏死率,这可能与癌组织由多支动脉供血有关。当病灶区域的血管栓塞后,其他侧支循环又会出现,导致了肿瘤继续生长。此外,TACE对于混合型肝癌的疗效较差,可能与混合型肝癌的血供缺乏,化疗药物及栓塞材料难以有效地灌注在血管中有关[8]。赵增富等[9]在一项研究中表明,采用TACE对晚期HCC患者治疗后,肿瘤血供消失22.5%,肿瘤完全坏死率为25.0%,表明单纯TACE治疗后肿瘤仍有可能复发或转移,必须给予高度重视。
RFA是利用射频热效应将组织中的极性分子加热振荡的原理,促使靶区凝固和灭活,从而达到治疗目的。通过射频针可将局部温度提高到100℃~120℃,热能可导致局部细胞组织坏死、变性,还可使肿瘤吸收血管组织凝固、破坏细胞器,抑制肿瘤细胞远处转移;同时,射频效应还具有增强免疫力的作用。Min等[10]的研究表明,RFA可对直径在5 cm以内的HCC具有较好的治疗作用,但对于直径大于9 cm的HCC,其仍不能达到较好的肿瘤完全坏死率。因此,越来越多的学者们将TACE联合RFA对HCC进行治疗,其目的是为了提高肿瘤完全坏死率和抑制局部复发,改善患者的生存状态。Ron等[11]对比分析了TACE联合RFA对HCC的临床治疗效果,该研究发现,联合治疗可将直径≤3.0 cm的肿瘤完全坏死率提高至94.8%,对于直径>5.1 cm的肿瘤,其完全坏死率也可达到56.0%,表明了联合治疗具有较高的应用价值。
本文中,我们对57例HCC患者采用TACE联合DSA引导下RFA术治疗。DSA透视下,可更加清晰地观察膈顶及结肠部位的病灶,为射频治疗提供更加准确的视野,以便对肿瘤进行多位点射频治疗,从而提高治疗效果。本文研究表明,观察组治疗后12个月AFP值、肿瘤体积及、肿瘤血供消失率及肿瘤完全坏死率变化均优于对照组,观察组治疗总有效率高于对照组(84.21%vs 64.91%),2组比较差异均有统计学意义(P <0.05)。与宋杰等[12]的研究和报道结果基本相近,表明了联合治疗方案可提高肿瘤完全坏死率和治疗有效率,改善患者的临床症状。此外,本研究还表明联合治疗组1年、2年及3年随访生存率均高于对照组(P <0.05),与任勇军等[13]的研究结果基本相近,进一步说明了联合治疗可控制肿瘤病灶,延长患者的生存期。不良反应方面,联合治疗组患者均能耐受治疗,也表明了联合治疗的安全性较好。
综合全文,TACE联合RFA术治疗HCC可提高患者的治疗有效率、肿瘤完全坏死率,控制肿瘤病灶,延长患者的生存期,具有较高的临床应用价值。
[1]Lao XM,Luo G,Ye LT,et al.Effects of antiviral therapy on hepatitis B virus reactivation and liver function after resection or chemoembolization for hepatocellular carcinoma〔J〕.Liver Int,2013,33(4):595-604.
[2]钱 亭,尹化斌.功能MRI评价肝癌经肝动脉灌注化疗栓塞术疗效的研究进展〔J〕.中华放射学杂志,2013,47(7):669-670.
[3]耿建利,李秀军,高若辉,等.CT引导下射频消融术治疗肝癌效果观察〔J〕.山东医药,2011,51(34):49-50.
[4]陈宝定,薛 玉,陈德玉,等.经皮射频消融术对肝癌患者围术期肝功能的影响及相关因素分析〔J〕.山东医药,2012,52(3):81-82.
[5]Shi XJ,Jin X,Wang MQ,et al.Effect of resection following downstaging of unresectable hepatocelluar carcinoma by transcatheter arterial chemoembolization〔J〕.Chin Med J(Engl),2012,125(2):197-202.
[6]韩成龙,马亦龙.洛铂在肝动脉化疗栓塞术中治疗原发性肝癌的近期疗效观察〔J〕.实用医学杂志,2014,9(13):2160-2162.
[7]Peng ZW,Guo RP,Zhang YJ,et al.Hepatic resection versus transcatheter arterial chemoembolization for the treatment of hepatocellular carcinoma with portal vein tumor thrombus〔J〕.Cancer,2012,118(19):4725-4736.
[8]裴志东,倪明立.肝动脉栓塞化疗联合氩氦刀冷冻消融治疗不能手术的中晚期肝癌35例〔J〕.肿瘤研究与临床,2012,24(7):466-468.
[9]赵增富,王如芳,赵付宪,等.肝动脉栓塞联合射频消融治疗肝癌40例疗效分析〔J〕.山西医学杂志,2014,43(5):587-589.
[10]Min YW,Kim J,Kim S,et al.Risk factors and a predictive model for acute hepatic failure after transcatheter arterial chemoembolization in patients with hepatocellular carcinoma〔J〕.Liver Int,2013,33(2):197-202.
[11]Gaba RC,Brodsky TR,Knuttinen MG,et al.Hepatic arterial changes following iodized oil chemoembolization of hepatocellular carcinoma:Incidence and technical consequence〔J〕.Artery Res,2012,6(1):21-27.
[12]宋 杰,王黎洲,李 兴,等.肝动脉灌注化疗栓塞联合DSA引导下射频消融术治疗肝癌100例疗效评估〔J〕.介入放射学杂志,2013,22(10):810-813.
[13]任勇军,赵彩霞,杨 林,等.射频消融术联合肝动脉灌注化疗栓塞术治疗中晚期原发性干细胞肝癌的疗效分析〔J〕.中华临床医师杂志(电子版),2013,7(11):4727-4729.

