开腹与腹腔镜下手术治疗胃肠肿瘤对于患者营养状况的影响
吕永祥 郑 伟
胃肠肿瘤是临床上比较常见的危重恶性肿瘤,不过早期进行手术治疗的预后效果比较好。不过多数肿瘤患者多伴随有营养不良,其主要是通过多种途径发生或加剧营养不良的发展,最后形成营养不良发生和肿瘤发展的恶性循环[1]。同时胃肠肿瘤患者由于存在机械性梗阻,当食物通过时,常引起疼痛、恶心、呕吐等,影响脂肪代谢和蛋白质合成,并进一步加重消化道症状[2]。在治疗中,当前开腹手术与腹腔镜手术都能很好对胃肠肿瘤进行治疗,但是对于患者多有一定的创伤,影响胃肠道的运动和排空功能,影响患者术后的常规进食[3]。随着腹腔镜设备的不断改进,操作技术的不断熟练,腹腔镜手术具有创伤小、恢复快、腹腔干扰小等优点,但是当前对于患者营养状况的研究报道还比较少[4]。本文具体对比了开腹与腹腔镜下手术治疗胃肠肿瘤对于患者营养状况的影响,现报告如下。
1 资料与方法
1.1 一般资料
2005年8月到2013年12月选择在我院进行诊治的胃肠肿瘤患者120例,纳入标准:病理诊断为胃肠肿瘤;预计生存期大约3个月;年龄40~90岁;体重45~80 kg;CT、胸部x线、B超、骨ECT扫描等检查证实无远处转移;知情同意。排除标准:合并内分泌及代谢性疾病;合并心、肺功能障碍。根据随机抽签原则分为治疗组与对照组,各60例。2组的性别、疾病类型、年龄、体重指数、肿瘤直径、病程等基础资料对比差异无统计学意义(P>0.05)。见表1。
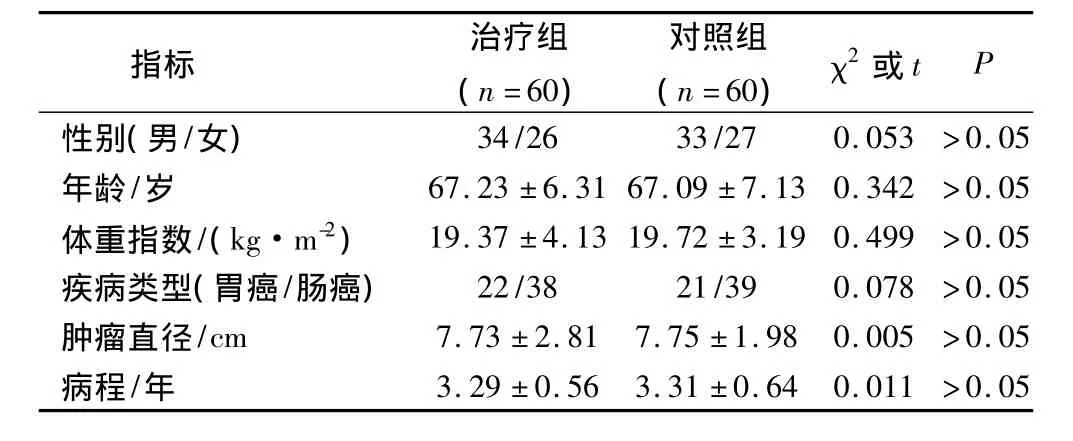
表1 2组基础资料对比
1.2 治疗方法
对照组:给予开腹手术治疗。治疗组:给予腹腔镜下手术治疗,采用气管插管静脉复合麻醉,术中积极监测生命体征,患者取平卧位,充分暴露盆腔手术野,常规消毒腹部,铺无菌巾单,常规建立四孔气腹,置入腹腔镜,于穿刺孔分别置入操作钳,探查肿瘤状况,然后进行切除治疗。所有患者术后给予积极地营养支持,提供膳食指导,设计合理的易消化吸收的饮食方案;进行适当的有氧运动,以改善食欲及睡眠,促进康复;同时积极预防感染。
1.3 观察指标
营养状况评价:所有患者在手术前后选择欧洲营养风险筛查法(nutritionalriskscreening 2002,NRS2002)进行评分,MNA量表得分最低分为17分、最高分为28.5分,分数>21分为营养合格。
生化检验指标:所有患者在手术前后空腹抽取静脉血5 ml,放入抗凝试管中混匀,4℃离心10 min,3 000 r/min分离血清,采用生化分析法测定血清白蛋白(ALB)和血清前白蛋白(PA)含量。
生活质量评定:所有患者术后选择生活质量(quality of life,QOL)标准进行评定,记录患者在食欲、精神状态、睡眠、疲乏程度、日常生活等方面的得分情况,分数越高,生活质量越好。
并发症对比:观察2组术后出现的并发症情况,包括感染、腹痛、腹泻、恶心呕吐等。
本文的术后都是在术后14天进行判定。
1.4 统计学方法
2 结果
2.1 营养不良状况对比
经过观察,2组术后的营养合格率分别为90.0%和75.0%,都明显高于术前(P<0.05);同时术后治疗组的营养合格率明显高于对照组(P<0.05)。见表2。
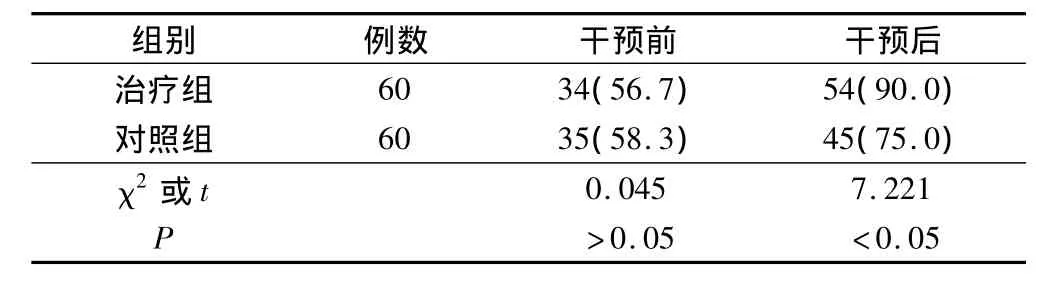
表2 2组营养合格状况对比(例,%)
2.2 生化指标对比
术后2组的血清白蛋白与前白蛋白值都呈现明显上升的趋势(P<0.05),同时术后治疗组的血清白蛋白与前白蛋白值明显高于对照组(P<0.05)。见表3。
表3 2组手术前后的血清白蛋白与前白蛋白值对比(s)
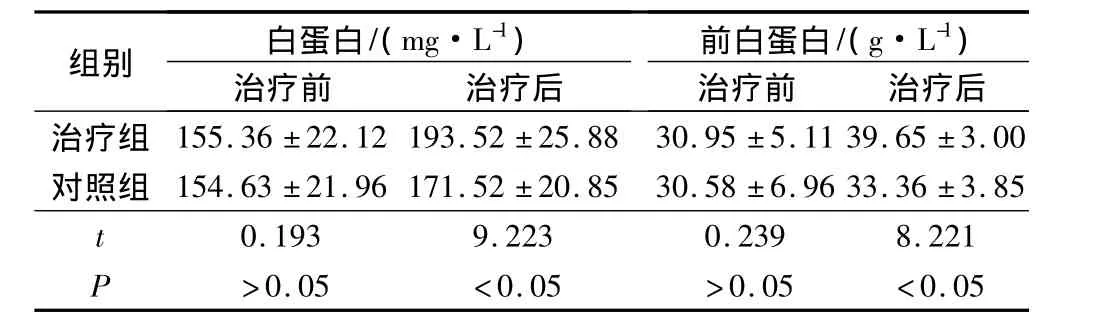
表3 2组手术前后的血清白蛋白与前白蛋白值对比(s)
)前白蛋白/(g·L-1组别 白蛋白/(mg·L-1)治疗前 治疗后治疗组 155.36 ±22.12 193.52 ±25.88 30.95 ±5.11 39.65治疗前 治疗后±3.00对照组 154.63 ±21.96 171.52 ±20.85 30.58 ±6.96 33.36 ±3.85 t 0.193 9.223 0.239 8.221 P >0.05 <0.05 >0.05 <0.05
2.3 并发症情况对比
经过观察,治疗组术后感染、腹痛、腹泻、恶心呕吐等并发症发生情况明显低于对照组(Uc=6.302,P<0.05)。见表4。
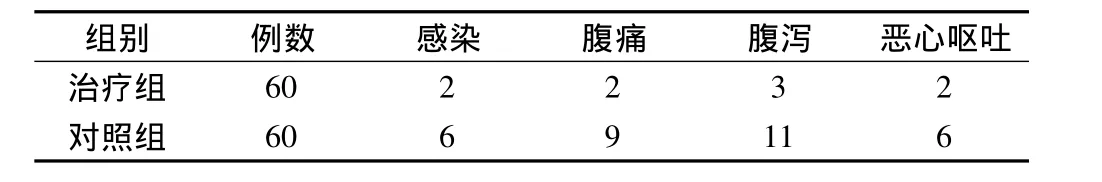
表4 2组术后并发症发生情况对比/例
2.4 生活质量对比
经过调查,治疗组术后精神状态、睡眠、疲乏程度、日常生活评分明显高于对照组(P<0.05)。见表5。
表5 2组术后生活质量评分对比(分,s)
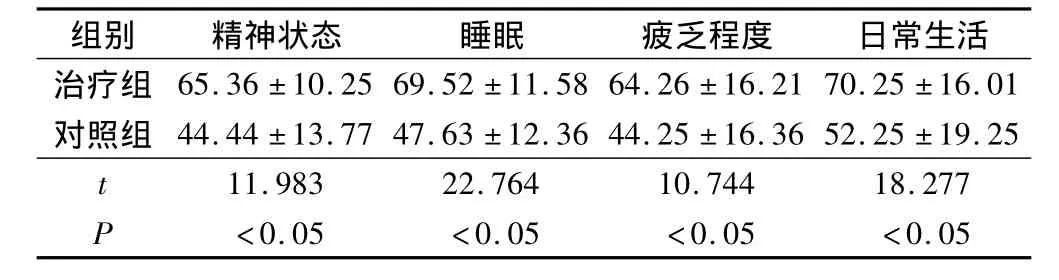
表5 2组术后生活质量评分对比(分,s)
组别 精神状态 睡眠 疲乏程度 日常生活治疗组 65.36 ±10.25 69.52 ±11.58 64.26 ±16.21 70.25 ±16.01对照组 44.44 ±13.77 47.63 ±12.36 44.25 ±16.36 52.25 ±19.25 t 11.983 22.764 10.744 18.277 P <0.05 <0.05 <0.05 <0.05
3 讨论
胃肠肿瘤是我国常见恶性肿瘤之一,由于其早期发病症状不典型,很多患者发现胃肠肿瘤时多处于晚期,自身营养状况不良,死亡率高[5]。而疾病和营养状态相互影响,疾病可能导致营养不良的发生,营养不良也可能加剧肿瘤的发展,其中营养物质摄入减少、炎症反应、能量需求增加导致分解代谢增加在营养不良的发展过程中起关键作用[6]。
除了病理性因素外,社会因素和医源性因素也能导致营养不良的发生,开腹手术对于患者的创伤比较大,可使机体的免疫功能有所影响[7]。随着医学技术的发展,腹腔镜手术凭借创伤小、恢复快等优点开始介入到恶性肿瘤的治疗[8],其对于患者的机体影响比较少,能够有效恢复患者的营养状况和免疫功能,减轻炎性反应,缩短住院时间,促进患者的康复[9]。同时,很多肿瘤患者在腹腔镜手术中可早期进行饮水与饮食,并不会增加患者的并发症,可为患者节约医疗费用。本文2组手术后的营养合格率分别为 90.0%和75.0%,都明显高于术前(P<0.05);同时术后治疗组的营养合格率明显高于对照组(P<0.05)。血清蛋白的测定能有效反映机体营养状况,但白蛋白和的半衰期较长,很难反映患者急性期的营养变化;而前白蛋白的半衰期相对较短,能够反映急性期体内蛋白质的变化水平,常被作为评价营养不良的化验指标[10]。本文术后2组的血清白蛋白与前白蛋白值都呈现明显上升的趋势(P<0.05),同时术后治疗组的血清白蛋白与前白蛋白值明显高于对照组(P<0.05)。表明腹腔镜手术的应用能够促进患者的康复,减少营养不良的发生。
胃肠肿瘤患者常有贫血、低蛋白血症、免疫力下降等,这使疗效降低、并发症增加。而手术的应用会进一步导致免疫功能下降,感染发生率增加,营养不良会逐渐加重且不易恢复[11]。本文治疗组术后感染、腹痛、腹泻、恶心呕吐等并发症发生情况明显低于对照组(P<0.05)。原因主要在于腹腔镜手术能够对病灶各组织结构进行细致分离,可在切割的同时止血;气腹形成使腹腔内具有较高的压力,减少小血管的出血;腹腔镜的放大作用使盆、腹腔的解剖更加清晰,从而减少并发症的发生[12]。本文治疗组术后精神状态、睡眠、疲乏程度、日常生活评分明显高于对照组(P<0.05),生活质量较对照组有明显改善。
总之,相对于开腹手术,腹腔镜下手术治疗胃肠肿瘤能有效改善机体内营养状况,减少术后并发症的发生,从而提高患者生活质量。
[1]关 玮,蔡 骏.消化道肿瘤住院患者的营养状态及其与中医客观化舌象的相关性分析〔D〕.上海中医药大学,2013.
[2]Inokuchi M,Sugita H,Otsuki S,et al.Long-Term effectiveness of preserved celiac branch of vagal nerve after roux-en-Y reconstruction in laparoscopy-assisted distal gastrectomy〔J〕.Dig Surg,2014,31(4-5):341-346.
[3]吴晓燕,鲁 铭,田 辉.食管癌患者术后经空肠造瘘管肠内营养的疗效观察〔J〕.中国肿瘤临床,2014,23(12):1510-1511.
[4]王争鸣.胃穿孔腹腔镜修补术与开腹修补术术后胃肠动力恢复的对比研究〔J〕.中国实用医刊,2014,41(4):63-64.
[5]孙鹏达,段立伟,孙 冬.腹腔镜治疗胃间质瘤的临床研究〔J〕.肿瘤研究与临床,2014,26(8):547-549.
[6]陈思增,刘 新,林永垄,等.术后早期肠内营养对结直肠癌患者营养状态、免疫功能及应激反应的影响〔J〕.福建医科大学学报,2007,41(3):264-267.
[7]Friedel D,Modayil R,Stavropoulos SN.Per-oral endoscopic myotomy:Major advance in achalasia treatment and in endoscopic surgery〔J〕.World J Gastroentero,2014,20(47):17746-17755.
[8]杨增辉,鲍传庆,许炳华,等.腹腔镜根治性全胃切除术后早期肠内营养临床研究〔J〕.中华腔镜外科杂志(电子版),2014,13(2):144-146.
[9]段长春,蒋尊忠.腹腔镜下根治手术配合空肠间置代胃术治疗胃癌的临床观察〔J〕.中国医药导刊,2014,9(13):1191-1192.
[10]高志光,秦环龙.大肠癌患者肠道微生态变化的研究进展〔J〕.中华临床营养杂志,2013,21(4):235-240.
[11]陈 余,李 鹏.腹腔镜胃癌切除术后并发症发生的相关危险因素分析〔J〕.中国现代普通外科进展,2014,17(1):17-19.
[12]徐 露,周晓俊,殷 骏,等.腹腔镜下胃旁路手术并发症的预防及处理〔J〕.中华胃肠外科杂志,2014,17(7):663-666.

