取向性丝素蛋白仿生软骨支架的制备及其生物相容性评估
杨强,丁晓明,徐宝山,赵艳红,刘越,张扬,马信龙△
取向性丝素蛋白仿生软骨支架的制备及其生物相容性评估
杨强1,2,丁晓明1,徐宝山2,赵艳红1,刘越2,张扬3,马信龙2△
目的利用定向结晶技术制备具有仿生取向微孔结构的丝素蛋白支架,探讨其作为软骨支架的可行性。方法以丝素蛋白为原料,采用定向结晶技术制成具有仿生取向微孔结构的支架,扫描电镜观察支架结构,测量支架的孔径、孔隙率和力学性能。从兔颈背部分离出脂肪干细胞,培养后获取第3代细胞,接种到支架上。CCK8检测支架上细胞增殖情况;HE染色和扫描电镜观察细胞在支架上的黏附能力;LIVE/DEAD染色观察支架上的细胞活性。结果扫描电镜显示,支架纵切面可见平行排列的微管样结构,具有较为统一的方向性,横切面可见椭圆或圆形孔隙结构,横截面微孔结构的平均孔径为(112.43±12.65)μm,孔隙率高达(90.25±2.05)%,支架压缩弹性模量为(52.48±5.78)kPa;复合脂肪干细胞培养,HE染色和扫描电镜可见细胞均匀黏附在支架表面及孔隙内,分泌大量沿微孔结构取向分布的细胞外基质;CCK8检测结果显示细胞在支架上增殖良好;LIVE/DEAD染色显示细胞保持良好的活性,未见死细胞。结论取向性丝素蛋白支架具有均匀的仿生取向微孔结构,具有合适的孔径、孔隙率和生物相容性,力学强度良好,可作为软骨组织工程的支架载体。
组织工程;软骨;丝素蛋白;取向微孔;脂肪干细胞
由于创伤、退行性变、肿瘤切除等原因造成的关节软骨受损在临床上较为常见,关节软骨存在较低的体内自我修复能力,其损伤的修复是外科领域的一大挑战[1-2]。常用的对症保守治疗、自体或异体骨软骨移植等治疗方法存在着纤维化、退化等问题,晚期的关节置换治疗同样难以取得理想的效果[3]。组织工程,尤其是体外软骨再生技术,能够完全再生软骨组织,并且有望实现工业化和临床应用,是软骨修复的理想方法[4]。目前的研究重点集中在支架材料的选择,支架的材料和结构特征直接影响着种子细胞的生物学功能和组织的形成[5]。本实验以天然材料蚕丝蛋白为原料,采用定向结晶相分离技术制备具有仿生取向微孔结构的软骨支架,检测其结构和生物相容性,为其作为软骨支架提供实验依据。
1 材料与方法
1.1组织来源、主要试剂及仪器新西兰大白兔,雌雄不限,2.5 kg(天津市天津医院动物房提供),Ⅰ型胶原酶、胰蛋白酶、乙二胺乙酸二钠、CCK8、LIVE/DEAD染色剂(Sigma公司,美国);CO2培养箱(Hera-cell公司,德国),恒温摇床(Hei⁃dolph公司,德国),倒置显微镜、荧光显微镜(Leica公司,德国),S-4800扫描电子显微镜(Hitachi公司,日本)。
1.2丝素蛋白溶液的提取按质量比1∶200将天然蚕丝加入0.02 mol/L的Na2CO3溶液中,煮沸,反复水洗,更换Na2CO3溶液后重复煮沸、水洗,通风晾干,得丝素丝;按质量比1∶4将丝素丝加入0.8 g/mL溴化锂溶液中,60℃水浴中磁力搅拌4 h;将丝素丝溶解液倒入截留相对分子质量为12 000~14 000的透析袋中,透析3 d,每天换水,离心,取上清,转入截留相对分子质量为3 500的透析袋中,经质量分数15%的聚乙二醇溶液中透析,离心取上清,检测浓度,并调整质量分数为6%(w/w)。
1.3取向性软骨支架的制备将质量分数为6%的丝素蛋白溶液加入Teflon模具(孔径15 mm,深度10 mm)中,以填满孔为宜,操作仔细,不要留有气泡,将已经-80℃冷却的金属块放在模具上,水平放置于-80℃冰箱中过夜,取出后再经冻干48 h,浸泡于无水乙醇中2 h,晾干。
1.4支架结构的评估
1.4.1结构观察大体观察支架的色泽、形状,将支架横、纵截面切成1 mm厚的组织片,体视显微镜和扫描电镜下观察支架结构。
1.4.2支架平均孔径的测量在100倍扫描电镜下观察6个样本,每个样本随机取3个视野,每个视野测量10个孔径值,取其平均值,计算纤维环支架的平均孔径。
1.4.3支架孔隙率的测定参考Zhang等[6]液体置换法计算支架孔隙率。具体方法如下:选取一带有刻度的试管,装入一定体积的无水乙醇,记为V1,放入支架,浸泡5 min,并反复挤压,直至支架材料内无气泡溢出为止,记录此时的总体积为V2,V2-V1为支架骨架结构的体积。取出浸满乙醇的支架,剩余乙醇体积记为V3,V1-V3为支架中包容的乙醇体积,即为支架材料中孔隙的体积。支架的总体积等于骨架结构的体积加上支架孔隙的体积,即:V总=(V2-V1)+(V1-V3)= V2-V3。支架的孔隙率等于支架孔隙体积与支架总体积之比,即:(V1-V3)/(V2-V3)×100%。测试6个样本,每个样本测定4次,取其平均值。
1.4.4支架压缩模量的检测支架放入PBS缓冲液中覆水后,置于力学加载装置加力平台上,以0.5 mm/min的压速进行压缩测试,根据检测初始阶段,按公式E=(F/S)/(dL/L)计算支架的弹性模量,其中F代表截面的载荷,S代表截面面积,dL代表支架高度的变化,L代表支架原始高度。
1.5支架生物相容性评估
1.5.1兔脂肪干细胞(ADSCs)的分离、培养及接种取4月龄新西兰大白兔,分离颈背部皮下脂肪组织,用含抗生素的D-Hank′s液浸泡3~5 min,再用D-Hank′s液冲洗2遍。分离肉眼可见的筋膜、血管,用剪刀将脂肪组织剪成1 mm3大小,加入3~5倍脂肪体积的0.1%Ⅰ型胶原酶,37℃,1 h,200目钢网过滤,将滤得的液体移入离心管,1 500 r/min离心10 min,弃上清,D-Hank′s液清洗1遍,重悬、计数后接种。24 h后半量换液,此后3 d换液1次,待细胞达80%~90%融合时消化传代。将第3代ADSCs以1×107/mL的密度接种到支架上。
1.5.2支架上细胞增殖检测细胞支架复合体即为支架细胞组,分别于培养1、3、5和7 d行CCK8法检测脂肪干细胞的增殖,以标准单纯细胞组为对照(DMEM培养液培养)。支架大小一致,接种细胞量相同,每个时间点各取3个样品(对照组为24孔板3个孔),经PBS缓冲液清洗,放入500 μL含10%CCK8的无血清DMEM培养基中,37℃孵育3 h后,取100 μL加到96孔板中,酶标仪检测液体在波长为450 nm时的光密度(OD)值,以含10%CCK8的无血清DMEM培养基作为空白对照。
1.5.3支架复合细胞组织学染色取培养1周的支架细胞复合体,经D-Hank′s漂洗2遍,4%多聚甲醛固定12 h后,梯度乙醇脱水、二甲苯透明后,石蜡包埋切片7 μm,切片脱蜡至水,取切片进行HE常规染色(苏木素5 min,伊红30 s),水洗,镜检。
1.5.4支架复合细胞扫描电镜观察将培养3 d的细胞支架复合体经2.5%戊二醛4℃固定24 h,用PBS(pH=7.4)冲洗3遍,1%锇酸4℃固定4 h,经梯度乙醇脱水,每个浓度脱水20 min以上,空气干燥,用刀片切成沿纵切面1 mm厚薄片,喷金、抽真空,扫描电镜观察。
1.5.5LIVE/DEAD细胞活性染色细胞支架复合物培养48 h后,切成100 μm厚薄片,按照说明书在配制的LIVE/ DEAD染液中孵育约30 min,共聚焦显微镜下观察细胞在支架上的活性。
1.6统计学方法采用SPSS 19.0软件包进行统计学处理。计量资料以均数±标准差,2组间比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1支架理化特性检测支架外观呈乳白色,纵切面可见平行排列的微管样结构,具有较为统一的方向性,微管直径较一致并有微孔相互贯通;横切面可见椭圆或圆形孔隙结构,呈多孔蜂窝状,孔隙分布均匀,见图1。横截面微孔结构的平均孔径为(112.43± 12.65)μm,孔隙率高达(90.25±2.05)%,支架压缩弹性模量为(52.48±5.78)kPa。
2.2细胞在支架上的活性和增殖能力检测第3代ADSCs形态典型,以长梭形为主,呈束状或漩涡状排列,接种到支架上并培养48 h后,尚未完全伸展铺开,见图2A。LIVE/DEAD染色细胞多呈绿色球形荧光,细胞活性良好,未见代表死细胞的红色荧光,见图2B。CCK8检测结果显示ADSCs在支架上基本呈对数生长趋势,其各时间点OD值与标准单纯细胞比较差异无统计学意义(P>0.05),见表1。
Tab.1Comparison of the proliferations at different time points between two groups表1 2组细胞不同时间增殖能力比较(n=5,)
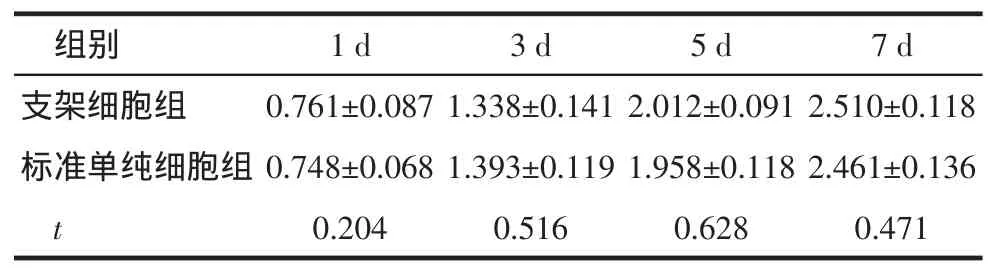
Tab.1Comparison of the proliferations at different time points between two groups表1 2组细胞不同时间增殖能力比较(n=5,)
均P>0.05
组别支架细胞组标准单纯细胞组t 1 d 0.761±0.087 0.748±0.068 0.204 3 d 1.338±0.141 1.393±0.119 0.516 5 d 2.012±0.091 1.958±0.118 0.628 7 d 2.510±0.118 2.461±0.136 0.471
2.3支架上细胞的黏附状态HE染色和扫描电镜可见细胞均匀黏附在支架的表面及孔隙内,并沿支架结构取向分布,分泌大量的细胞外基质,见图3。
3 讨论
3.1关节软骨组织成熟的关节软骨是一种无血管的组织[7],由1%的软骨细胞和99%的软骨外基质组成,关节软骨按胶原纤维分布排列方式共分为4层[8]:浅表层位于软骨表层,胶原纤维与关节表面平行,过渡层的纤维与表面呈一定角度交错分布,辐射层的胶原纤维直径更粗,与关节表面垂直排列,前三层又称透明软骨层;透明软骨通过约20~250 μm厚的软骨钙化层与软骨下骨相连,其中辐射层的软骨细胞以及基质呈垂直取向分布,是软骨组织发挥力学作用的关键环节。骨性关节炎是软骨缺损最主要的原因。随着社会老龄化的加剧,以软骨退变为特征的骨性关节炎患者与日俱增[9]。当关节软骨全层损伤后,由于软骨缺乏直接的血液供应、淋巴循环和神经支配,代谢能力低,自身修复能力有限,软骨下骨髓产生纤维软骨样修复,但这种修复产生的软骨细胞无论是形态还是功能特性与正常软骨均相差甚远[7]。而目前临床常用的修复方法均有一定局限性,因此寻找安全有效的软骨修复方法成为目前的研究热点。
3.2软骨组织工程研究现状近年来,以组织工程学的方法构建关节软骨取得了较好的效果。组织工程学是运用生命科学和工程学原理研究生物替代品,以维持、重建或改善组织功能的一门跨专业学科,能够在生化组成和结构特性上重塑软骨组织[2]。其中,支架材料是组织工程构建的关键环节[10]。理想的支架材料除了具备良好的生物相容性,良好的孔隙结构,以及适当的降解性能等共性以外还应该在成分、形状、结构、力学性能上与软骨组织相似。现今的支架材料多种多样,常用的合成高分子材料如聚乙交酯、聚乳酸聚羟基乙酸共聚物(PLGA)等[11],降解产物呈酸性,植入体内可引起不同程度的炎症反应,且其亲水性较差;而天然材料很好地解决了这一问题,胶原[12]、透明质酸[13]、壳聚糖[14]等天然材料具有优秀的生物相容性,降解产物可被人体吸收利用,胶原蛋白力学性能、可塑性较差,不能与体内软骨生物力学微环境相匹配[12]。在支架结构设计方面,主要有三维多孔、取向微孔等结构。大量研究显示,模仿天然组织结构的取向性支架能够提高支架本身的力学性能,促进细胞的黏附和增殖[7,11,15]。在软骨组织工程中,具有取向排列结构的软骨支架相比非取向结构具有更好的力学强度,能够更好地调整细胞的分布、排列和迁移[11,15]。
3.3取向性丝素蛋白软骨支架本实验以蚕丝提取的天然材料丝素蛋白为原料,采用定向结晶TIPS技术成功制备具有仿生取向微孔结构的软骨支架。丝素蛋白纤维是一种无生理活性的天然大分子,具有良好的生物相容性和可控的生物降解速率,来源充足,提取工艺简单,含有较多的β折叠结构,该结构稳定,不溶于水[16],力学性能优良,符合软骨支架对机械强度的要求[17]。该支架纵切面可见平行排列的微管样结构,具有较为统一的方向性,微管直径较一致并有微孔相互贯通,横切面为可见椭圆或圆形孔隙结构,模仿了天然软骨组织的柱状结构,接种细胞培养1周后,可见大量基质沿微孔结构取向分布,说明支架取向微孔结构可以引导细胞黏附并分泌细胞外基质,从而为形成天然结构的软骨组织提供保障。此外,采用定向结晶技术制备的支架不含有毒物质,CCK8检测可见细胞在支架上具有良好的黏附、增殖能力,活性良好。
综上所述,以天然材料丝素蛋白为原料,采用定向结晶制备的仿生软骨支架,具有与天然软骨组织相似的取向微孔结构,具有良好的孔径、孔隙率以及生物相容性,能够支持和引导细胞取向生长,可作为软骨组织工程的理想支架载体,但是支架能否支撑干细胞的成软骨分化有待于进一步研究。
(图1~3见插页)
[1]Li YC,Zhang WG.Advances in treatment of articular cartilage inju⁃ries[J].Med J Chin PLA,2013,38(5):423-427.[李元城,张卫国.关节软骨损伤治疗进展[J].解放军医学杂志,2013,38(5):423-427].
[2]Brenner JM,Ventura NM,Tse MY,et al.Implantation of scaffoldfree engineered cartilage constructs in a rabbit model for chondral resurfacing[J].Artif Organs,2014,38(2):E21-32.doi:10.1111/ aor.12199.
[3]Ding X,Zhu M,Xu B,et al.Integrated trilayeredsilkfibroin scaffold for osteochondral differentiation of adipose derived stem cells[J]. ACS Appl Mater Interfaces,2014,6(19):16696-16705.doi:0.1021/ am5036708.
[4]Haaparanta AM,Järvinen E,Cengiz IF,et al.Preparation and char⁃acterization of collagen/PLA,chitosan/PLA,and collagen/chitosan/ PLA hybrid scaffolds for cartilage tissue engineering[J].J Mater Sci Mater Med,2014,25(4):1129-1136.doi:10.1007/s10856-013-5129-5.
[5]El-Ayoubi R,DeGrandpre C,DiRaddo R,et al.Design and dynamic culture of 3D-scaffolds for cartilage tissue engineering[J].J Biomater Appl,2011,25(5):429-444.doi:10.1177/0885328209355332.
[6]Zhang R,Ma PX.Biomimetic polymer/apatite composite scaffolds for mineralized tissue engineering[J].Macromol Biosci,2004,4(2): 100-111.doi:10.1002/mabi.200300017.
[7]Moreira-Teixeira LS,Georgi N,Leijten J,et al.Cartilage tissue en⁃gineering[J].Endocr Dev,2011,21:102-115.doi:10.1159/000328140.
[8]Kock L,van Donkelaar CC,Ito K.Tissue engineering of functional articular cartilage:the current status[J].Cell Tissue Res,2012,347(3):613-627.doi:10.1007/s00441-011-1243-1.
[9]Musumeci G,Castrogiovanni P,Leonardi R,et al.New perspectives for articular cartilage repair treatment through tissue engineering:A contemporary review[J].World J Orthop,2014,5(2):80-88.doi: 10.5312/wjo.v5.i2.80.
[10]Tran SC,Cooley AJ,Elder SH.Effect of a mechanical stimulation bioreactor on tissue engineered,scaffold-free cartilage[J].Biotech⁃nol Bioeng,2011,108(6):1421-1429.doi:10.1002/bit.23061.
[11]Zhang Y,Yang F,Liu K,et al.The impact of PLGA scaffold orienta⁃tion on in vitro cartilage regeneration[J].Biomaterials,2012,33(10): 2926-2935.doi:10.1016/j.biomaterials.2012.01.006.
[12]Yuan T,Zhang L,Li K,et al.Collagen hydrogel as an immunomodu⁃latory scaffold in cartilage tissue engineering[J].J Biomed Mater Res B Appl Biomater,2014,102(2):337-344.doi:10.1002/jbm. b.33011.
[13]Patrascu JM,Kruger JP,Boss HG,et al.Polyglycolic acid-hyaluro⁃nan scaffolds loaded with bone marrow-derived mesenchymal stem cells show chondrogenic differentiation in vitro and cartilage repair in the rabbit model[J].J Biomed Mater Res B Appl Biomater,2013,101(7):1310-1320.doi:10.1002/jbm.b.32944.
[14]Hao T,Liu T,Lyu SH,et al.Reconstruction of tissue engineered car⁃tilage using temperature-responsive chitosan hydrogel[J].Med J Chin PLA,2007,32(5):500-502.[郝彤,刘暾,吕双红,等.采用温敏性壳聚糖水凝胶体外构建组织工程化软骨的实验研究[J].解放军医学杂志,2007,32(5):500-502].
[15]Jia S,Liu L,Pan W,et al.Oriented cartilage extracellular matrixderived scaffold for cartilage tissue engineering[J].J Biosci Bioeng,2012,113(5):647-653.doi:10.1016/j.jbiosc.2011.12.009.
[16]Mirahmadi F,Tafazzoli-Shadpour M,Shokrgozar MA,et al.Enhanced mechanical properties of thermosensitive chitosan hydrogel by silk fibers for cartilage tissue engineering[J].Mater Sci Eng C Mater Biol Appl,2013,33(8):4786-4794.doi:10.1016/j.msec.2013.07.043.
[17]Yan LP,Oliveira JM,Oliveira AL,et al.Macro/microporous silk fi⁃broin scaffolds with potential for articular cartilage and meniscus tissue engineering applications[J].Acta Biomater,2012,8(1):289-301.doi:10.1016/j.actbio.2011.09.037.
(2014-11-27收稿 2015-01-18修回)
(本文编辑 李鹏)
Fabrication and biocompatibility assessment of a silk fibroin scaffold with biomimetic oriented microstructure for cartilage tissue engineering
YANG Qiang1,2,DING Xiaoming1,XU Baoshan2,ZHAO Yanhong1,LIU Yue2,ZHANG Yang3,MA Xinlong2△
1 Tianjin Medical University,Tianjin 300070,China;2 Department of Minimally Invasive Spine Surgery,Tianjin Hospital;3 Tianjin Orthopaedic Institute of Integrative Medicine△
ObjectiveTo fabricate a silk fibroin scaffold with biomimetic oriented microstructure using the directional crystallization technology,and to evaluate the possibility of application to the cartilage tissue engineering.MethodsThe silk fibroin scaffold with biomimetic oriented microstructure was made by the directional crystallization technology.The structure of scaffold was observed by the scanning electron microscope,and the pore size,porosity and mechanical properties were calculated. Adipose-derived stem cells were isolated from rabbit,and the passage 3 was seeded into the scaffold.The cell proliferation was detected by CCK8 method.The cell adhesion ability was observed by HE staining and scanning electron microscope.The cell viability was observed by LIVE/DEAD staining.ResultsThe scanning electron microscopy showed that the parallel microtubulelike structure can be seen arranged in longitudinal section of the scaffold,which had a uniform directivity,and also the ellipticalor circular pore structure in cross-section.The scaffold had a good pore interconnectivity with(112.43±12.65)µm pore diameter of the cross-section,(90.25±2.05)%porosity and(52.48±5.78)kPa the compression modulus.HE staining and scanning electron microscopy demonstrated that the cells uniformly adhered to the surface and inner pore,and which secreted lots extracellular matrix distributed in the oriented microstructure.Results of CCK8 showed that the good cell proliferation on the scaffold,and the LIVE/ DEAD staining indicated that the cells were maintained good viability.ConclusionThe silk fibroin scaffolds have a biomimetic oriented microstructure,and show good pore diameter,porosity,biocompatibility and biomechanical properties,which made it a suitable candidate as an alternative scaffold for cartilage tissue engineering.
tissue engineering;cartilage;silk;orientedmicrostructure;adipose-derived stem cell
R329-33,R318.1
A
10.11958/j.issn.0253-9896.2015.07.002
国家自然科学基金项目(31470937,31300798,81272046);天津市卫生局科技基金项目(2013KR16,2012KY24)
1天津医科大学(邮编300070);2天津市天津医院微创脊柱外科;3天津市中西医结合骨科研究所
杨强(1980),男,副主任医师,博士后,主要从事椎间盘、骨软骨、组织工程方面研究
△通讯作者E-mail:maxinlong8686@sina.com

