Kaposi肉瘤相关疱疹病毒8型相关微小RNA k12-1和k12-12在Kaposi肉瘤组织中的表达及意义
吴秀娟 赵宗峰 普雄明
Kaposi肉瘤相关疱疹病毒8型相关微小RNA k12-1和k12-12在Kaposi肉瘤组织中的表达及意义
吴秀娟 赵宗峰 普雄明
目的检测Kaposi肉瘤肿瘤组织中Kaposi肉瘤相关疱疹病毒8型相关微小RNA k12-1(kshvmiR-k12-1)和k12-12(kshv-miR-k12-12)的表达,并探讨其与Kaposi肉瘤病理分期、HIV感染、人疱疹病毒8型(HHV-8)感染、皮损面积之间的关系。方法选取液氮保存的Kaposi肉瘤肿瘤组织和瘤旁正常组织18对,采用Trizol法提取标本组织中的总RNA并反转录成cDNA,采用SYBR Green实时荧光定量PCR法定量检测kshv-miR-k12-1和kshv-miR-k12-12,比较Kaposi肉瘤肿瘤组织及其瘤旁组织中kshv-miR-k12-1和kshv-miR-k12-12表达的差异,并分析其与Kaposi肉瘤病理分期、HIV和HHV-8感染、皮损面积之间的关系。结果kshv-miR-k12-1和kshv-miR-k12-12在Kaposi肉瘤肿瘤组织中的2-△△Ct值分别为(1.016±1.645)和(2.104± 1.973),明显高于瘤旁正常组织,分别为 0.029± 0.019(t=2.542,P=0.016)和 0.102± 0.093(t=4.301,P=0.000)。不同HIV和HHV-8感染状态、病理分期、皮损面积患者的kshv-miR-k12-1和kshv-miR-k12-12表达差异均无统计学意义(均P>0.05)。结论kshv-miR-k12-1和kshv-miR-k12-12在Kaposi肉瘤肿瘤组织中呈明显高表达,但与HIV感染、HHV-8感染、病理分期及皮损面积无明显相关。
肉瘤,卡波西;疱疹病毒8型,人;kshv-miR-k12-1;kshv-miR-k12-12
研究显示,在Kaposi肉瘤中共有17条Kaposi肉瘤相关疱疹病毒8型(Kaposi′s sarcoma-associated herpesvirus,KSHV)相关微小 RNAs,由 12 个基因编码,易在潜伏感染细胞中被检测出来,并参与细胞基因的转录后调节[1-2]。K12基因是一个潜伏基因,在 KSHV 裂解复制期激活[3],研究表明[4],kshvmiR-k12-3和kshv-miR-k12-7诱导巨噬细胞和单核细胞分泌白细胞介素6(IL-6)和IL-10,表明这两个miRNA参与免疫反应,从而影响KSHV相关肿瘤的进展,但kshv-miR-k12-1和kshv-miR-k12-12在Kaposi肉瘤中的表达及意义尚不明确。本研究采用实时荧光定量PCR方法检测18对Kaposi肉瘤肿瘤组织和瘤旁正常组织中kshv-miR-k12-1和kshv-miR-k12-12的表达,探讨kshv-miR-k12-1和kshv-miR-k12-12与Kaposi肉瘤临床分型、病理类型、人疱疹病毒 8 型(human herpesvirus 8,HHV-8)感染、皮损面积之间的关系。
作者单位:830001乌鲁木齐,新疆维吾尔自治区人民医院皮肤性病科(吴秀娟、普雄明),临床医学研究中心(赵宗峰)
资料与方法
1.样本来源及资料收集:组织样本来自2012年1月至2013年9月在我院就诊的Kaposi肉瘤患者肿瘤和瘤旁组织,手术切除后立即于液氮中储存。所有标本均经组织病理检查,由两名高年资病理医生确诊为Kaposi肉瘤。对入选的所有病例完善其临床资料及相关检查结果,包括性别、年龄、HIV及HHV-8感染情况、病理分期、皮损面积。本研究已通过新疆维吾尔自治区人民医院伦理委员会审批,患者均已签署知情同意书。
2.主要试剂与仪器:cDNA逆转录试剂盒(美国Epicentre公司),miScript SYBR荧光定量PCR试剂盒(德国Qiagen公司),一抗为鼠抗人HHV-8单克隆抗体(英国Abcam公司),二抗(丹麦Dako公司)。所有引物均由上海英骏生物技术有限公司合成。NanoDrop® ND-1000(美国 NanoDrop公司),SYBR Green实时荧光定量PCR(美国Applied Biosystems公司)。
3.提取组织中的总RNA:取-80℃冻存的Kaposi肉瘤肿瘤组织和瘤旁正常组织约20 mg,加入Trizol 1 ml,冰浴中用电动匀浆器进行匀浆,然后按总RNA抽提试剂盒说明书提取总RNA。取1 μl RNA进行1.2%琼脂糖凝胶电泳鉴定RNA完整性,同时取 1 μl RNA用 NanoDrop® ND-1000测定RNA浓度和纯度,本次实验所有标本A260/A280均为1.7~2.0,说明RNA纯度高。
4.实时荧光定量PCR:根据cDNA逆转录试剂盒说明书将RNA逆转录成cDNA,反应体系(20 μl)包括缓冲液 2 μl、MMLV 反转录酶 0.2 μl、总 RNA 700 ng、RNA 酶抑制剂 0.3 μl、dNTP 2μl、茎环引物0.3 μl,加入去 RNA 酶水至 20 μl。反应条件:16 ℃30 min,42℃ 30 min,85℃ 5 min,完成后 cDNA 贮存于-20℃备用。kshv-miR-k12-1茎环引物序列:5′-GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTG CACTGGATACGACGCTTAC-3′;kshv-miR-k12-12茎环引物序列:5′-GTCGTATCCAGTGCGTGTCGTGG AGTCGGCAATTGCACTGGATACGACTCAACCA-3′;内参U6茎环引物序列:5′-CGCTTCACGAATTTGCG TGTCAT-3′。实时荧光定量 PCR 反应体系(10 μl)包括:荧光染料反应液5 μl,上、下游引物各1 μl,cDNA 2 μl,加水至总体积为 10 μl。反应条件:95 ℃10 min;40 个 PCR 循环 (95 ℃ 10 s,60 ℃ 60 s)。kshv-miR-k12-1实时荧光定量PCR引物(上游:5′-GGGGATTACAGGAAACTGGGT,下游 5′-GTGCGTG TCGTGGAGTCG-3′),扩增产物大小为 65 bp。kshvmiR-k12-12实时荧光定量PCR引物(上游:5′-AATGGGGGAGGGTGCC-3′,下游 5′-GTGCGTGTCG TGGAGTCG-3′),扩增产物大小为 62 bp。U6 实时荧光定量PCR引物(上游:5′-GCTTCGGCAGCACATA TACTAAAAT-3′,下游 5′-CGCTTCACGAATTTGCG TGTCAT-3′),扩增产物大小为89 bp。本实验采用2-△△Ct法分析表达量大小,用 2-△△Ct值计算 kshvmiR-k12-1和kshv-miR-k12-12的相对表达量。
5.HHV-8免疫组化染色:采用Envision二步法,一抗工作液稀释浓度为1∶50,选择PCR扩增HHV-8基因阳性的组织切片作为阳性对照,用PBS缓冲液代替一抗作为空白对照。
6.统计学分析:采用SPSS17.0统计软件,计量资料以±s表示,数据比较采用方差分析,独立样本t检验和配对t检验,P≤0.05为差异有统计学意义。
结 果
1.临床资料:Kaposi肉瘤患者18例,男17例,女1例,维吾尔族;病理分期:斑片期6例,斑块期3例,结节期9例;皮损面积≤1%6例,>1%~5%5例,>5%~10%5例,>10%~30%2例。分型:经典型 11例,发病年龄(64.9±11.0)岁,病程(36.3±39.1)个月,HHV-8感染(HHV-8免疫组化阳性)9例;艾滋病(AIDS)相关型7例,发病年龄(47.6±11.9)岁,病程(5.3±2.8)个月,HHV-8感染(HHV-8免疫组化阳性)6例。
2.Kaposi肉瘤肿瘤组织和瘤旁正常组织中kshv-miR-k12-1和kshv-miR-k12-12的表达:kshv-miR-k12-1、kshv-miR-k12-12和内参 U6的熔解曲线均呈单峰状,说明荧光分别由目标产物kshv-miR-k12-1、kshv-miR-k12-12和内参 U6发出,特异性好。18例Kaposi肉瘤肿瘤组织中kshvmiR-k12-1表达量(2-△△Ct)为1.016±1.645,瘤旁正常组织为0.029±0.019,其表达倍数(肿瘤/瘤旁)为35.03,经配对t检验,两组差异有统计学意义(t=2.542,P=0.016)。kshv-miR-k12-12 的平均表达量(2.104±1.973)明显高于瘤旁正常组织(0.102±0.093),其表达倍数(肿瘤/瘤旁)为 20.62。经配对t检验,差异有统计学意义(t=4.301,P=0.000)。
3.Kaposi肉瘤中 kshv-miR-k12-1和 kshvmiR-k12-12的表达与临床表现的关系:经单因素方差分析或独立样本t检验分析,不同HIV和HHV-8感染状态、病理分期、皮损面积患者的kshv-miR-k12-1表达差异均无统计学意义(表1)。
讨 论
miRNA作为转录后水平调控基因表达的关键因子,对肿瘤发生发展有重要作用[5]。Kaposi肉瘤的病因一直未能确定,目前HHV-8被公认为是其致病因子[6-7]。Kaposi肉瘤相关疱疹病毒分为裂解期和潜伏期两个周期,潜伏期时一小部分病毒基因表达,包括kaposin基因、病毒Fas相关死亡结构域样白介素1β转换酶抑制蛋白(vFLIP)、病毒细胞周期蛋白(vCYC)、潜伏相关核抗原(LANA)和12个miR-k12-1到miR-k12-12的前体miRNA,这些前体miRNA可以产生24个成熟 miRNA[8-9]。成熟miRNA均来自KSHV潜伏期位点,共有一个启动子,基本上表达所有KSHV感染的细胞[10-13]。miR-k12-12 完全保守,miR-k12-1、3、8、10 和 11 高度保守,miR-k12-2、4、5、6、7 和 9 具有相对明显的多态性。
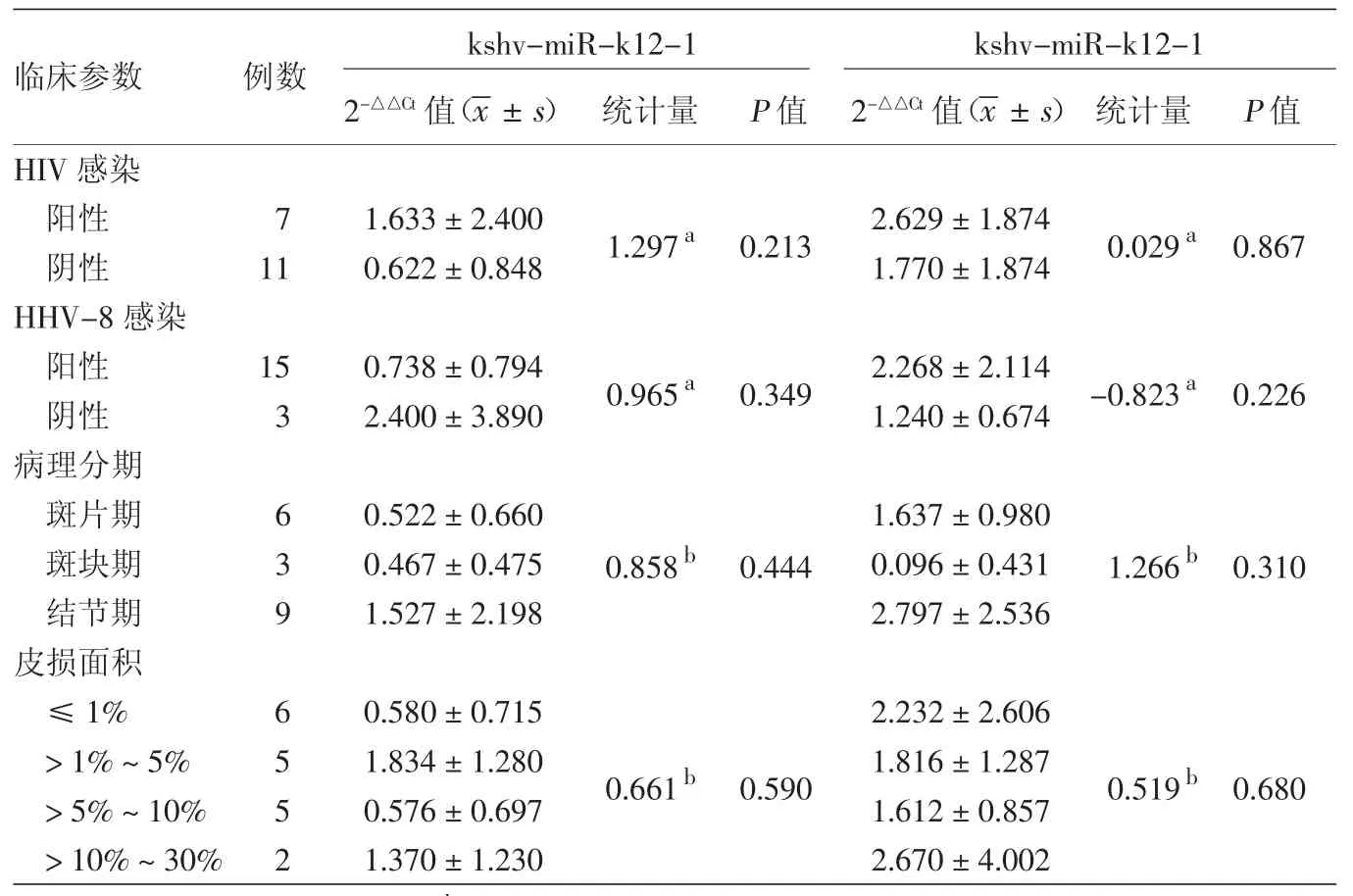
表1 18例Kaposi肉瘤肿瘤组织中kshv-miR-K12-1、kshv-miR-k12-1表达量与临床参数的关系
本研究采用实时荧光定量PCR方法检测18对维吾尔族Kaposi肉瘤患者肿瘤和瘤旁正常组织中kshv-miR-k12-1和kshv-miR-k12-12的表达情况,结果显示,这两条miRNA在Kaposi肉瘤肿瘤组织中的表达明显高于瘤旁正常组织,提示kshv-miR-k12-1和kshv-miR-k12-12可能与Kaposi肉瘤的发生发展有关。Catrina Ene等[14]检测17个4%甲醛包埋的Kaposi肉瘤标本和3个KSHV阴性正常石蜡包埋组织标本kshv-miR-k12-1,结果显示,kshvmiR-K12-1在Kaposi肉瘤中表达明显上调。Hansen等[15]研究结果显示,kshv-miR-k12-1 在 Kaposi肉瘤中明显高表达。本研究与上述研究结果一致,更加肯定了kshv-miR-k12-1参与了Kaposi肉瘤的发生发展。采用多个生物信息学软件预测骨桥蛋白(SPP1)、塑性相关基因1(PRG1)、整膜蛋白2A(ITM2A)、S100 钙结合蛋白 A2(S100A2)和血小板反应蛋白1(THBS1)结合在KSHV miRNA3′UTR区,是kshv-miR-k12-1调控的靶基因。尤其是THBS1受多个KSHV miRNA调控,如kshv-miR-k12-1、kshv-miR-k12-3-3p、kshv-miR-k12-6-3p和 kshv-miR-k12-11。Samols等[16]研究证实,KSHV miRNA 抑制 SPP1、PRG1和 THBS1的3′UTR区,表明这些基因受KSHV miRNA表达的影响而发生改变。Suffert等[17]研究显示,KSHV miRNA 下调内源性Casp3 水平,表明 Casp3 3′UTR 受 kshv-miR-k12-1,kshv-miR-k12-3和kshv-miR-k12-4-3p的调控。
本研究还分析了kshv-miR-k12-1和kshvmiR-k12-12的表达与Kaposi肉瘤HHV-8感染、HIV感染、病理分期及皮损面积之间的关系,结果未见差异有统计学意义,提示kshv-miR-k12-1和kshv-miR-k12-12表达量可能与HHV-8感染、HIV感染、病理分期及皮损面积无关,也可能与本研究Kaposi肉瘤标本数量较少有关,此结果在国内外相关研究中尚未见报道。
本研究证实,kshv-miR-k12-1和kshv-miR-k12-12与Kaposi肉瘤发生发展密切相关,但其功能和调控的靶基因尚未明确,有待进一步研究。
[1]Qin Z,Freitas E,Sullivan R,et al.Upregulation of xCT by KSHV-encoded microRNAs facilitates KSHV dissemination and persistence in an environment of oxidative stress[J].PLoS Pathog,2010,6(1):e1000742.
[2]Boss IW,Renne R.Viral miRNAs:tools for immune evasion[J].Curr Opin Microbiol,2010,13(4):540-545.
[3]Cai X,Lu S,Zhang Z,et al.Kaposi′s sarcoma-associated herpesvirus expresses an array of viral microRNAs in latently infected cells[J].Proc Natl Acad Sci U S A,2005,102(15):5570-5575.
[4]Qin Z,Kearney P,Plaisance K,et al.Pivotal advance:Kaposi′s sarcoma-associated herpesvirus (KSHV)-encoded microRNA specifically induce IL-6 and IL-10 secretion by macrophages and monocytes[J].J Leukoc Biol,2010,87(1):25-34.
[5]Volinia S,Calin GA,Liu CG,et al.A microRNA expression signature of human solid tumors defines cancer gene targets[J].Proc Natl Acad Sci U S A,2006,103(7):2257-2261.
[6]普雄明,吴卫东,居哈尔.Kaposi肉瘤患者血清人类疱疹病毒8型的检测[J].临床皮肤科杂志,2004,33(2):87-88.
[7]王慧,吕国栋,王晓东,等.基因芯片表达谱筛选Kaposi肉瘤相关基因[J].中华皮肤科杂志,2011,44(6):403-406.
[8]Gottwein E,Corcoran DL,Mukherjee N,et al.Viral microRNA targetome of KSHV-infected primary effusion lymphoma cell lines[J].Cell Host Microbe,2011,10(5):515-526.
[9]Haecker I,Gay LA,Yang Y,et al.Ago HITS-CLIP expands understanding of Kaposi′s sarcoma-associated herpesvirus miRNA function in primary effusion lymphomas[J].PLoS Pathog,2012,8(8):e1002884.
[10]Dittmer D,Lagunoff M,Renne R,et al.A cluster of latently expressed genes in Kaposi′s sarcoma-associated herpesvirus[J].J Virol,1998,72(10):8309-8315.
[11] Fakhari FD,Dittmer DP.Charting latency transcripts in Kaposi′s sarcoma-associated herpesvirus by whole-genome real-time quantitative PCR[J].J Virol,2002,76(12):6213-6223.
[12]O′Hara AJ,Vahrson W,Dittmer DP.Gene alteration and precursor and mature microRNA transcription changes contribute to the miRNA signature of primary effusion lymphoma[J].Blood,2008,111(4):2347-2353.
[13] O′Hara AJ,Wang L,Dezube BJ,et al.Tumor suppressor microRNAs are underrepresented in primary effusion lymphoma and Kaposi sarcoma[J].Blood,2009,113(23):5938-5941.
[14]Catrina Ene AM,Borze I,Guled M,et al.MicroRNA expression profiles in Kaposi′s sarcoma[J].Pathol Oncol Res,2014,20(1):153-159.
[15]Hansen A,Henderson S,Lagos D,et al.KSHV-encoded miRNAs target MAF to induce endothelial cell reprogramming[J].Genes Dev,2010,24(2):195-205.
[16]Samols MA,Skalsky RL,Maldonado AM,et al.Identification of cellular genes targeted by KSHV-encoded microRNAs[J].PLoS Pathog,2007,3(5):e65.
[17] Suffert G,Malterer G,Hausser J,et al.Kaposi′s sarcoma herpesvirus microRNAs target caspase 3 and regulate apoptosis [J].PLoS Pathog,2011,7(12):e1002405.
Expressions of Kaposi′s sarcoma-associated herpesvirus type 8-associated microRNAs k12-1 and k12-12 in Kaposi′s sarcoma and their significance
Wu Xiujuan*,Zhao Zongfeng,Pu Xiongming.*Department of Dermatovenereology,People′s Hospital of Xinjiang Uygur Autonomous Region,Urumqi 830001,China
ObjectiveTo measure the expressions of Kaposi′s sarcoma-associated herpesvirus type 8 associatedmicroRNAs k12-1 (kshv-miR-k12-1)and k12-12 (kshv-miR-k12-12)in Kaposi′s sarcoma tissue,and to assess their relationship with pathological stage and lesion area of Kaposi′s sarcoma,HIV infection,and human herpesvirus type 8(HPV-8) infection.MethodsTotally,18 paired tissue specimens stored in liquid nitrogen from Kaposi′s sarcoma lesions and paralesional skin were collected.Total RNAs were extracted from these specimens by using Trizol reagent,and reversely transcribed into cDNA.SYBR Green real-time fluorescence-based quantitative PCR was performed to measure the expressions of kshv-miR-k12-1 and kshv-miR-k12-12 in these specimens.The relationship of kshv-miR-k12-1 and kshv-miR-k12-12 expressions with the pathological stage and lesion area of Kaposi′s sarcoma,HIV and HPV-8 infections was analyzed.ResultsCompared with paralesional normal skin,Kaposi′s sarcoma lesions showed significantly increased expressions of kshv-miR-k12-1 (2-△△Ct:1.016 ± 1.645 vs.0.029 ± 0.019,t=2.542,P=0.016)and kshv-miR-k12-12(2-△△Ct:2.104 ± 1.973 vs.0.102 ± 0.093,t=4.301,P=0.000).There were no significant differences in the expressions of kshv-miR-k12-1 or kshv-miR-k12-12 between patients with HIV or HPV-8 infection and those without,among patients with different pathological stages of Kaposi′s sarcoma,or among patients with different lesion areas (allP> 0.05).ConclusionBoth kshv-miR-k12-1 and kshv-miR-k12-12 are highly expressed in Kaposi′s sarcoma,but neither of their expressions is related to HIV or HPV-8 infection,pathological stage or lesion area of Kaposi′s sarcoma.
Sarcoma,Kaposi;Herpesvirus 8,human;kshv-miR-k12-1;kshv-miR-k12-12
Pu Xiongming,Email:puxiongming@126.com
10.3760/cma.j.issn.0412-4030.2015.12.008
国家自然科学基金(81260311);新疆维吾尔自治区自然科学基金(2014211A059)
普雄明,Email:puxiongming@126.com
2015-01-12)
(本文编辑:周良佳 颜艳)

