隆突性皮肤纤维肉瘤50例临床病理分析
温斯健 胡彬 杨励 宋昊 熊竞舒 张韡 徐秀莲 姜祎群 陈浩 曾学思 孙建方
隆突性皮肤纤维肉瘤50例临床病理分析
温斯健 胡彬 杨励 宋昊 熊竞舒 张韡 徐秀莲 姜祎群 陈浩 曾学思 孙建方
目的探讨隆突性皮肤纤维肉瘤(DFSP)的诊断及鉴别诊断要点。方法回顾性分析中国医学科学院皮肤病研究所1998—2014年诊治的50例DFSP患者的临床表现、组织病理学、免疫组化特点及治疗和预后。结果50例患者发病年龄(29.5±15.9)岁,平均病程9.6年。皮损位于躯干部33例,占66.0%;其次为四肢和头颈部。典型皮损表现为,萎缩性斑片/斑块13例,占26.0%;在此基础上多发性大小不一结节30例,占60.0%;正常皮肤上单发或多发结节7例,占14.0%。组织病理学特征由单一编席样或车辐状排列的梭形细胞组成,呈浸润性生长,肿瘤细胞表达CD34和波形蛋白。20例患者皮损切除后原位复发,复发率43.5%,未见远处转移和死亡患者。结论DFSP皮损形态变化多样,容易误诊,组织病理及免疫组化检查可确诊。DFSP切除后局部复发率高,可多次复发,但罕见淋巴结和远处转移。
皮肤肿瘤;皮肤纤维肉瘤;回顾性研究;神经纤维瘤;纤维肉瘤;组织细胞瘤;脂肪肉瘤,黏液样
隆突性皮肤纤维肉瘤(dermatofibrosarcoma protuberans,DFSP)是一种交界恶性/潜在低度恶性肿瘤,临床中较为少见,容易误诊,为进一步认识本病的临床特征及组织病理学特点,回顾性分析50例DFSP患者的临床资料和组织病理学结果,并结合相关文献探讨其临床病理学特点、诊断及鉴别诊断要点。
对象与方法
一、对象
50例患者为1998—2014年中国医学科学院皮肤病医院门诊及住院DFSP患者,具有完整、详细的病情记录。所有患者均经临床表现、皮损组织病理及免疫组化结果及复核确诊。
二、方法
1.临床病史及组织病理切片复核:收集病变的解剖位置和大小,表皮是否伴有萎缩,肿瘤的边缘和基底,肿瘤的硬度等。光镜下观察所有HE切片,观察瘤细胞的丰富程度,瘤细胞的排列和浸润方式,核的异形性及病理性核分裂象等。
作者单位:210042南京,中国医学科学院北京协和医学院皮肤病研究所病理科(温斯健、宋昊、熊竞舒、张韡、徐秀莲、姜祎群、陈浩、曾学思、孙建方);武汉市第一医院皮肤科(胡彬);陕西省人民医院皮肤科(杨励)
2.免疫组化标记:所有标本经4%甲醛固定,常规石蜡包埋,4 μm厚切片。所有抗体均采用EnVision两步法进行标记。选用的抗体:CD34、波形蛋白、SMA、S100、结蛋白、CD68 和 Ki67,所有抗体均为即用型抗体(北京中杉金桥技术有限公司)。对50例DFSP皮损标本进行上述免疫指标检测,均设阳性及阴性对照。
结 果
一、临床资料
1.性别和年龄:50例DFSP患者中,男27例,女23例,男女比例为1.17∶1。就诊时年龄(39.0±15.1)岁,发病年龄(29.5± 15.9)岁,就诊时病程 5个月至60年,平均病程9.57年。
2.部位:皮损位于躯干部33例占66%,其中胸部13例、腰背部9例、肩部5例、腹部4例、腹股沟2例;其余17例为下肢7例、颈项部5例、上肢3例、面部1例、头部1例。
3.临床表现:萎缩性斑片或斑块13例占26%(图1A),在斑块或斑片的基础上多发性大小不一结节30例占60.0%(图1B、1C);皮损为正常皮肤上单发或多发结节7例(图1D)。无明显自觉症状者45例,自觉轻度疼痛者5例。就诊时皮疹(1~10)cm×(1~8)cm,平均4.0 cm×2.9 cm。在早期诊疗过程中,曾误诊为硬斑病、瘢痕、硬斑病样基底细胞癌、脂膜炎、斑状萎缩、固定型药疹、皮下脂肪萎缩、血管瘤、皮肤纤维瘤、脂肪瘤等。
4.治疗和随访:50例患者均行皮损切除或扩大切除术,在我院扩大切除29例,切缘距肿瘤2 cm,深至皮下脂肪全层;21例患者在我院活检明确诊断后回当地医院手术,切缘无法估计。50例患者中4例失访,20例复发,其中1例3次复发,2例2次复发,17例1次复发,均无淋巴结转移。1例患者行X线胸片检查,发现右下肺野多个散在、大小不一的结节状、块状密度影,边界清楚,不能除外转移瘤,后转院治疗失访。剔除失访者,复发率为43.5%。29例在我院手术治疗的患者,失访1例,复发12例,复发率42.8%;21例回当地医院行手术治疗的患者,失访3例,复发8例,复发率44.4%。术后复发时间2个月至9年不等。术后1年内复发者14例,超过1年复发者6例。
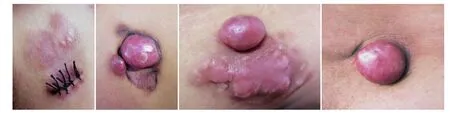
图1 患者临床表现 1A:左锁骨上方萎缩性斑块,3 cm×4cm;1B:左肩部5 cm×4 cm萎缩性暗红斑,其上可见两个大小不一红色结节,表面光滑,质硬;1C:左下腹8 cm×8 cm萎缩性暗红斑,表面可见瘢痕样不规则淡红色斑块及一约3 cm×4 cm淡红色结节;1D:腰部单发结节,未见萎缩性皮损
二、组织学改变
50例DFSP以经典型(图2A)为主:显微镜下观察,肿瘤位于真皮层,肿瘤上方表皮常萎缩,少数可见轻中度棘层肥厚,表真皮之间有少量正常纤维间隔(境界带)。病变无界限,在真皮内呈席纹状排列,累及皮下脂肪时,分割单个脂肪细胞,形成特征性的蜂窝状排列(图2B),有些病变可侵及筋膜甚至肌肉,远超临床上表现出来的边界;肿瘤细胞形态单一,短胖梭形,细胞浓染,异形性低,几乎无核分裂象。
除典型/普通型外,本组有2例黏液型DFSP,瘤细胞间间隙增大,出现黏液样区域(图2C)。13例萎缩性DFSP(图2D),表皮萎缩或正常,肿瘤细胞在真皮浅层数目较少,排列稍稀疏,呈波浪状排列,平行于表皮,在真皮下部呈席纹状、车幅状、编织状排列,并可见肿瘤细胞侵犯皮下脂肪,分割脂肪细胞。3例为色素型DFSP,黑素细胞不规则分布于瘤细胞之间(图2E),黑素细胞有树突状胞质,大于周围瘤细胞。2例伴有纤维肉瘤变区域(DFSP-FS),不超过肿瘤的10%,表现为瘤细胞丰富,异形明显,瘤细胞排列成鱼骨状或人字形(图2F),核分裂象易见,图像与周围DFSP明显不同,两者逐渐过渡,或分界清楚。肌样/肌成纤维细胞性分化的DFSP 1例(图2G),伴有脑膜上皮样漩涡的DFSP 1例(图2H),还有1例局部出现类似巨细胞成纤维细胞瘤改变。
三、免疫组化

图2 患者皮损组织病理表现(HE×200) 2A:瘤细胞排列成车辐状或席纹状结构;2B:肿瘤累及皮下脂肪时,分割单个脂肪细胞,形成特征性的蜂窝状排列(箭头示被分割的脂肪);2C:黏液样区(左上角可见黏液性区域,箭头所示;右下角见肿瘤呈典型席纹状排列;2D:萎缩型肿瘤细胞在真皮浅层数目较少,排列稍稀疏,呈波浪状排列,平行于表皮,箭头所示;2E:色素型,箭头示不规则分布于瘤细胞间的黑素细胞;2F:纤维肉瘤变瘤细胞排列成鱼骨状或人字形,伴细胞异形(箭头);2G:肌样/肌成纤维细胞性分化区域(箭头);2H:伴有脑膜上皮样漩涡的区域(箭头)
50例DFSP患者免疫组化表达情况:肿瘤细胞CD34全部阳性表达,CD34定位于细胞膜上,部分在细胞质内,黏液变性区表达弱或不表达;波形蛋白全部强阳性表达;S100和SMA个别散在阳性表达,结蛋白、CD68和Ki67均阴性表达。色素性DFSP肿瘤内黑素细胞表达S100和HMB45;伴有纤维肉瘤变的DFSP在纤维肉瘤变的区域CD34阴性表达;肌样/肌成纤维细胞性分化的DFSP在分化区域SMA和结蛋白阳性表达。
讨 论
DFSP临床少见,发生率约占所有恶性肿瘤的0.1%,占所有软组织肉瘤的1%[1]。DFSP可发生于任何年龄,但常发生于20~50岁成年人,男性稍多见。本组50例患者男女比例为1.17∶1,有2例为先天性DFSP患者;发生于躯干部位33例占66.0%,集中于胸、肩、腰背、腹等处;四肢10例,头颈部7例,与文献报道类似[2-3]。有报道指出,DFSP 位于四肢末端者少见[3-4],本组病例发生于上肢3例,上臂2例,左前臂靠肘关节处1例;下肢7例,大腿3例,膝关节周围3例,小腿1例,分布于四肢的近端多见,四肢末端少见,无1例发生于手足部位。
DFSP最初表现为无症状的萎缩性、硬化的紫色、蓝红色或褐色的斑片或斑块;随着病程进展(时间长短不一,短则数月,长则数十年),在斑片或斑块基础上出现直径大小不一(一般为2~5 cm,少数可达20 cm)的多发硬性结节。少数情况下,DFSP发病即表现为单发的结节。本组患者表现为萎缩性斑片或斑块者13例,在斑块或斑片的基础上多发性大小不一结节者30例;正常皮肤上单发或多发结节者7例,符合DFSP皮损的发生发展规律。此病临床少见,临床医生经验不足,特别是皮损表现为萎缩性皮损的或者单发结节的时候,临床极易误诊[5],临床医生应加强对此病的认识,及时行病理检查,减少不必要的误诊。
DFSP主要依靠典型的组织学形态和免疫组化等确诊。显微镜下观察,肿瘤位于真皮层,肿瘤上方表皮常萎缩,表真皮之间有少量正常纤维间隔。早期斑块或斑片状病变的特点是细胞密度少,增生的细长梭形细胞排列成长束状,与皮面平行,细胞分散于细的胶原纤维束之间,浸润至皮下组织,常呈多层状。随着肿瘤发展至结节期,细胞成分增多,细胞排列呈编席样或车辐状,细胞浓染,异形性低,几乎无核分裂象,病变无界限,在真皮和皮下组织内呈蟹爪样浸润性生长,累及皮下形成特征性的蜂窝状模式。免疫组化上,CD34和波形蛋白阳性表达[6]。DFSP的临床和组织学亚型主要有6种,即色素型、黏液型、萎缩型、纤维肉瘤型、颗粒细胞型和伴有巨细胞成纤维细胞瘤样区域的DFSP[7]。本组病例中除了颗粒细胞亚型以外,其他几种亚型均可见到,此外尚有个别少见亚型,如肌样/肌成纤维细胞性分化的DFSP和伴有脑膜上皮样漩涡的DFSP等。DFSP主要需和以下病变相区别:①皮肤纤维组织细胞瘤:通常肿块体积<1 cm,病变局限,表皮突常增生伴有基底层色素增加,肿瘤范围常局限于浅部真皮,没有DFSP的浸润性生长方式,细胞成分多样,常有大量泡沫细胞、炎症细胞及多核巨细胞的出现,可伴有出血或假血窦样改变,且阳性表达CD68和Ⅷa,阴性表达CD34可与DFSP鉴别;②神经纤维瘤:萎缩型DFSP浅层细胞平行于表皮,呈波浪状稀疏排列,需要与神经纤维瘤相鉴别,后者临床常表现为多发的质软结节,组织学瘤细胞核呈波浪状,背景较疏松,无核分裂象,还可见到较多肥大细胞,肿瘤细胞阳性表达S100,与DFSP明显不同;③黏液样脂肪肉瘤:应与黏液型DFSP鉴别,前者位于深部软组织,瘤细胞成星形或梭型,不形成席纹状结构,并见脂母细胞,间质内见丰富的丛状(枝芽状)毛细血管;而黏液型DFSP病变表浅,仔细观察可见特征性的席纹状结构,无脂母细胞;④纤维肉瘤,多位于肢体深部组织,瘤细胞异形性明显,核分裂象易见,瘤细胞呈特征性的“人字型”或“鱼骨型”排列,没有或少见典型席纹状或车辐状结构,肿瘤细胞不表达CD34,有助于和本病鉴别。此外还需与结节性筋膜炎、恶性纤维组织细胞瘤、恶性外周神经鞘瘤等鉴别。最佳的活检标本应包括足够的皮下脂肪组织,根据普通病理和免疫组化可以作出最终诊断。
DFSP的标准治疗方式是局部扩大切除,外科切缘通常要求为2~3 cm[8]。Mohs外科手术以及改良Mohs手术具有高治愈率和手术创面较小两大优势[9]。DFSP对放疗敏感,对于手术切除范围不够的、显微镜下有残留且再次手术有困难的、具有较高局部复发率的、显微镜下无残留但皮损太大的DFSP患者推荐进行放疗[10]。导致DFSP发生的关键是染色体17和22重排,形成超数环状染色体[r(17;22)]或转位染色体[t(17;22)],从而导致染色体PDGFB和Col1A1基因融合。这种特征性的染色体重排引起PDGFB基因转录上调,功能性的PDGFB异常表达并激活其受体,引起细胞恶性转化,导致肿瘤发生[11]。PDGFB受体可以被酪氨酸激酶抑制剂伊马替尼阻滞。因此,生物制剂方面目前已批准伊马替尼用于治疗存在染色体17和22重排的不可切除和(或)转移和(或)复发性 DFSP患者[12]。本组所有患者均行皮损切除或扩大切除术,部分患者在我院活检明确诊断后回当地医院手术,切缘无法估计。随访50例患者,有4例失访,复发者20例,复发率为43.5%,术后复发时间2个月至9年不等,有14例术后1年内复发,建议密切随访,早期发现复发灶,及时扩大切除。
综上所述,DFSP是一种交界恶性/潜在低度恶性纤维组织细胞肿瘤,通常生长较慢,局部复发率较高,而远处转移率较低。DFSP临床少见,形态变化多样,容易误诊,及时行组织病理及免疫组化检查可确诊。DFSP切除后局部复发率高,可多次复发,但罕见淋巴结和远处转移。
[1]Llombart B,Serra-Guillen C,Monteagudo C,et al.Dermatofibrosarcomaprotuberans:acomprehensivereviewandupdateondiagnosis and management[J].Semin Diagn Pathol,2013,30(1):13-28.
[2]Chang CK,Jacobs IA,Salti GI.Outcomes of surgery for dermatofibrosarcomaprotuberans[J].EurJSurgOncol,2004,30(3):341-345.
[3]Paradisi A,Abeni D,Rusciani A,et al.Dermatofibrosarcoma protuberans:wide local excision vs.Mohs micrographic surgery[J].Cancer Treat Rev,2008,34(8):728-736.
[4] Llombart B,Sanmartín O,López-Guerrero JA.Dermatofibrosarcomaprotuberanteenlainfancia[J].Piel,2006,21(9):435-441.
[5]Tsai YJ,Lin PY,Chew KY,et al.Dermatofibrosarcoma protuberans in children and adolescents:Clinical presentation,histology,treatment,and review of the literature[J].J Plast Reconstr Aesthet Surg,2014,67(9):1222-1229.
[6]Aiba S,Tabata N,Ishii H,et al.Dermatofibrosarcoma protuberans is a unique fibrohistiocytic tumour expressing CD34 [J].Br J Dermatol,1992,127(2):79-84.
[7]陈浩,薛燕宁,王焱,等.萎缩型隆突性皮肤纤维肉瘤二例[J].中华皮肤科杂志,2011,44(7):465-467.
[8]Kimmel Z,Ratner D,Kim JY,et al.Peripheral excision margins for dermatofibrosarcoma protuberans:a meta-analysis of spatial data[J].Ann Surg Oncol,2007,14(7):2113-2120.
[9]Kallini JR,Khachemoune A.Dermatofibrosarcoma protuberans:is mohs surgery truly superior?And the success of tyrosine kinase inhibitors[J].J Drugs Dermatol,2014,13(12):1474-1477.
[10]Mendenhall WM,Zlotecki RA,Scarborough MT.Dermatofibrosarcoma protuberans[J].Cancer,2004,101(11):2503-2508.
[11]Rutkowski P,Debiec-Rychter M,Nowecki Z,et al.Treatment of advanced dermatofibrosarcoma protuberans with imatinib mesylate with or without surgical resection [J].J Eur Acad Dermatol Venereol,2011,25(3):264-270.
[12]Malhotra B,Schuetze SM.Dermatofibrosarcoma protruberans treatment with platelet-derived growth factor receptor inhibitor:a review of clinical trial results[J].Curr Opin Oncol,2012,24(4):419-424.
Clinical and pathological analysis of 50 patients with dermatofibrosarcoma protuberans
Wen Sijian*,Hu Bin,Yang Li,Song Hao,Xiong Jingshu,Zhang Wei,Xu Xiulian,Jiang Yiqun,Chen Hao,Zeng Xuesi,Sun Jianfang.*Department of Pathology,Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China
ObjectiveTo investigate the diagnosis and differential diagnosis of dermatofibrosarcoma protuberans(DFSP).MethodsTotally,50 patients with DFSP visiting the Institute of Dermatology,Chinese Academy of Medical Sciences from 1998 to 2014 were enrolled.The clinical manifestations,histopathological and immunohistochemical features,treatment and prognosis of DFSP were retrospectively reviewed.ResultsThe average age at onset of DFSP was(29.5±15.9)years in the 50 patients,with a mean disease duration of 9.57 years.Skin lesions most frequently occurred on the trunk(n=33,66.0%),followed by the extremities,head and neck.DFSP was characterized by atrophic patches or plaques in 13 cases(26.0%),multiple nodules varying in size and arising on atrophic plaques or patches in 30 cases(60.0%),single or multiple nodules arising on normal skin in 7 cases(14.0%).Histologically,the tumor consisted of uniform infiltrative spindle cells arranged in a storiform or cartwheel pattern.In addition,the tumor cells expressed CD34 and vimentin.Twenty patients experienced recurrence at the primary site after resection of skin lesions with a recurrence rate of 43.5%.No distant metastasis or death occurred in these patients.Conclusions DFSP usually has various skin manifestations,is easily misdiagnosed,and can be confirmed based on histopathological and immunohistochemical findings.Local recurrence of DFSP is common,and may occur for many times after surgical excision,but lymphatic and distant metastases are rare.
Skin neoplasms;Dermatofibrosarcoma;Retrospective studies;Neurofibroma;Fibrosarcoma;Histiocytoma;Liposarcoma,myxoid
s:Chen Hao,Email:ch76ch@163.com;Sun Jianfang,Email:Sunjf57@163.com
10.3760/cma.j.issn.0412-4030.2015.12.003
江苏省临床医学科技专项(BL2012003)
陈 浩 ,Email:ch76ch@163.com; 孙 建 方 ,Email:Sunjf57@163.com
2015-03-11)
(本文编辑:吴晓初)

