RNA干扰趋化因子受体CXCR7基因对黑素瘤M14细胞侵袭和迁移的影响
刘排 田蔚蔚 李小静 李志锋 燕霞 孙建方
RNA干扰趋化因子受体CXCR7基因对黑素瘤M14细胞侵袭和迁移的影响
刘排 田蔚蔚 李小静 李志锋 燕霞 孙建方
目的探讨靶向沉默趋化因子受体CXCR7基因对黑素瘤细胞株M14侵袭和迁移能力的影响。方法采用Western印迹实验检测黑素瘤M14和A375细胞CXCR7蛋白的表达,选取高表达CXCR7蛋白的M14细胞作为研究对象。将M14细胞分为实验组、阴性对照组和空白对照组:实验组转染CXCR7-siRNA,阴性对照组转染阴性对照siRNA,空白对照组不做任何处理。采用实时定量PCR和蛋白质印迹法分别检测CXCR7 mRNA和蛋白在M14细胞中的表达水平,Transwell小室法及细胞划痕法检测干扰前后细胞侵袭及迁移能力的变化。结果实验组M14细胞CXCR7 mRNA及蛋白相对表达量分别为0.412±0.023、0.144±0.005,明显低于阴性对照组(1.211±0.117、1)以及空白对照组(1.000±0.102、1.016±0.004),差异均有统计学意义(F值分别为30.068、11 485.5,P值分别为0.001、0.000)。实验组M14细胞穿过聚碳酸酯膜的细胞数为(20.617±1.503)个,明显少于阴性转染对照组[(42.000±6.018)个]和空白对照组[(43.627±2.152)个],3组间比较差异有统计学意义(F=32.416,P=0.001)。划痕实验中,实验组每高倍视野(×200)下细胞迁移数为15.00±1.10,明显少于阴性对照组(44.90±2.20)和空白对照组(45.30±2.30),3组间比较差异有统计学意义(F=2 411.945,P=0.000)。结论靶向沉默CXCR7能显著抑制黑素瘤M14细胞的侵袭和迁移,有望为皮肤黑素瘤提供潜在的治疗靶点。
黑色素瘤,实验性;受体,CXCR7;RNA干扰;肿瘤侵润;细胞迁移分析
我们前期研究表明[1],皮肤黑素瘤组织及细胞系中趋化因子受体 7(chemokine receptor 7,CXCR7)表达升高,可能参与其恶性侵袭与转移过程。为进一步探讨CXCR7在皮肤黑素瘤侵袭转移中的作用,我们通过RNA干扰技术,观察CXCR7对黑素瘤细胞侵袭、迁移等生物学行为的影响。
作者单位:330001南昌,江西省皮肤病专科医院皮肤内科(刘排、田蔚蔚);河北工程大学附属医院皮肤科(李小静、李志锋、燕霞);中国医学科学院北京协和医学院皮肤病研究所病理科(孙建方)
材料与方法
一、主要试剂和仪器
Trizol、G418产自美国Invitrogen公司,实时荧光定量PCR试剂盒产自美国Promega公司,黑素瘤细胞系A375、M14细胞产自美国标准生物品收藏中心(ATCC),兔抗人CXCR7多克隆抗体为美国Santa Cruz公司产品,CytoSelect24孔细胞移行试验试剂盒为美国Cell Biolabs公司产品,细胞计数CCK-8(cell counting kit-8)试剂盒为日本同仁株式会社化学研究所产品;Transwell小室为美国Corning公司产品。
二、细胞培养和实验方法
1.细胞培养:细胞系A375、M14细胞用含10%胎牛血清的高糖Dulbecco极限必需培养基(Dulbecco′s minimum essential medium,DMEM)培养,培养条件为37℃、5%CO2。
2.Western印迹实验检测黑素瘤M14和A375细胞CXCR7蛋白表达:采用免疫印迹法检测黑素瘤M14和A375细胞CXCR7蛋白表达,选择高表达CXCR7蛋白的细胞作为研究对象。具体检测步骤如下:提取两组细胞总蛋白,磷酸盐缓冲液(PBS)洗涤细胞后,加入预冷的蛋白裂解液裂解细胞,收集上清,提取细胞总蛋白,Brodford法测定蛋白含量。取70 μg蛋白上样,进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)垂直电泳、聚亚乙烯双氧化物(PVDF)转膜,加入一抗(1 ∶400)、二抗(1 ∶5 000),X线曝光、显影及定影,用CXCR7灰度值与3-磷酸甘油醛脱氢酶(GAPDH)灰度值的比值代表CXCR7蛋白的相对表达量。所有内参均使用β肌动蛋白。每组样本各重复实验3次。
3.引物设计:基因库上查找CXCR7的基因全系列后,Primer zpremier5.0软件设计,通过使用核酸序列数据库检索程序排除其他的可能同源序列。引物由生工生物工程(上海)股份有限公司合成。CXCR7:上游引物:5′-GCGTCCAACAATGAGACCT ACTG-3′,下游引物:5′-GGCAAAGCCCAAGACAAC GGAGA-3′,目的产物 302 bp。
4.siRNA序列设计以及分组:用美国Ambion公司和德国Qiagen公司的siRNA设计软件,设计siRNA序列,其中CXCR7-siRNA片段正义链5′-G GAAAGGAUCAUCUUCUCCATT-3′,反义链 5′-UAG GGAAGAAGAUGAUCUUCGG-3′,阴性对照siRNA片段正义链 5′-UUCUUCCGAACGUGUCACCGTT-3′,反义链 5′-ACGUUGACACGUUCGGAGGATT-3′。由南京金斯特公司合成双链siRNA编码序列。将M14细胞随机分为实验组、阴性对照组和空白对照组:实验组转染CXCR7-siRNA,阴性对照组转染阴性对照siRNA,空白对照组不做任何处理。
5.细胞转染:选择对数生长期细胞接种于24孔板,按照Lipofectamine2000脂质体转染试剂盒说明书进行转染操作。细胞转染后继续孵育48 h后接种于培养瓶。1 000 mg/L的G418浓度为最终确定的筛选浓度,维持该浓度2周进行筛选。将筛选的细胞接种形成克隆,且尚未发生融合时,在荧光显微镜下挑取克隆,继续培养于含G418 500 mg/L的培养基中。
6.实时定量PCR方法检测M14细胞转染前后CXCR7 mRNA的表达水平:首先应用Trizol试剂分别提取总RNA,测定总RNA的质量和浓度,吸光度比值(A260/A280)在1.9~2.1之间为合格,各样本取大致等量的总RNA,按说明书推荐条件将其反转录为cDNA。引物设计和合成由生工生物工程(上海)股份有限公司完成。CXCR7引物见上。内参照β肌动蛋白:上游引物5′-GAAGGATTCCTATGTGGG CGAC-3′,下游引物 5′-AGCCTGGATAGCAACGTA CATGG-3′,目的片段268 bp。PCR扩增目的基因片段,其反应条件为:95℃预变性2 min,94℃变性30 s,56℃退火30 s,72℃延伸30 s,循环30次,最后72℃再延伸10 min。得到的PCR产物经琼脂糖凝胶电泳,凝胶紫外线成像仪下观察、拍照,检验各电泳条带的灰度值,计算Gadd45a mRNA/β肌动蛋白mRNA比值。所有实验均重复3次。
7.Western印迹实验检测M14细胞转染前后CXCR7蛋白的表达水平:实验分组同上,取3组实验的对数生长期细胞,48 h后提取各组细胞总蛋白,实验步骤同前述。
8.Transwell实验测定转染对M14细胞侵袭能力的影响:在每个Transwell小室的多聚碳酸酯膜上铺人工基底膜胶(Matrigel),制成人工基底膜。分别取对数生长期的实验组、阴性对照组和空白对照组M14细胞,胰蛋白酶消化计数后,以无血清培养基调整浓度为0.6×106/ml,将Transwell小室置入24孔板中,在小室中加入无血清培养基,室温放置2 h,在小室外部加入含10%血清的培养基500 μl,弃去小室内部的无血清培养基,加入300μl细胞悬液,孵育48h,并在下室中加入10μg/LCXCR7配体CXCL12,作用12 h后弃去小室内的上清并轻拭去小室内膜多聚碳酸脂膜上的细胞,小室置入含有500 μl染液的培养孔中染色20 min,显微镜下计数高倍(×200)视野下穿过小室的细胞数,每组实验重复3次。
9.细胞划痕法测定转染前后细胞的迁移能力:制备转染前后M14单层细胞后,用10 μl移液枪枪头在单层细胞上呈“一”字划痕,用PBS清洗3次,孵育24 h后换成含10%胎牛血清的DMEM细胞培养液,孵育24 h后,吸去培养液,用PBS清洗3次后,在高倍镜下计数迁移到划痕区的细胞数目。
10.统计学分析:采用SPSS13.0统计软件进行分析。实验数据以±s表示,作方差齐性检验,采用方差分析统计数据,组间比较采用LSD检测,以P<0.05差异有统计学意义。
结 果
一、CXCR7在黑素瘤细胞中的表达
CXCR7蛋白在M14和A375细胞中均有表达,其表达值分别为0.649±0.008、0.288±0.004,因此本实验选择CXCR7蛋白表达较高的M14细胞用于后续实验研究(图1)。
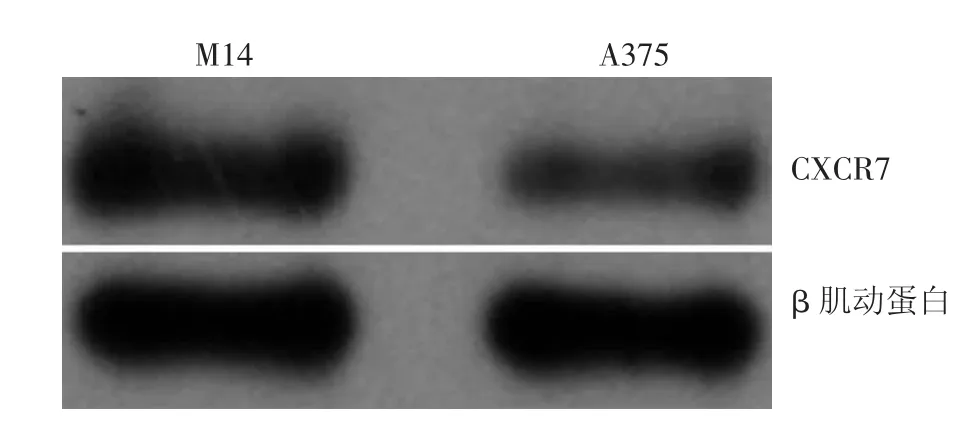
图1 黑素瘤细胞株M14和A375中CXCR7蛋白表达情况
二、siRNA转染后M14细胞内CXCR7基因、蛋白表达
经过G418筛选和单克隆挑选后,表达绿色荧光蛋白的细胞达到95%以上,转染空质粒或转染带有shRNA片段的质粒对细胞形态几乎无影响。
干扰后实验组中CXCR7 mRNA的相对表达量为0.412±0.023,阴性对照组1.211±0.117,空白对照组1.000±0.102,3组间差异有统计学意义(F=30.068,P=0.001)。组间比较显示,实验组与阴性对照组和空白对照组间差异均有统计学意义(P值分别为 0.000、0.002)。
干扰后3组细胞均不同程度表达CXCR7,实验组CXCR7蛋白表达强度为0.144±0.005,阴性对照组为1.000±0.002,空白对照组为1.016±0.004,3组间差异有统计学意义(F=11 485.5,P=0.000)。组间比较显示,实验组与阴性对照组和空白对照组间差异均有统计学意义(P值均为0.000)。见图2。

图2 免疫印迹法检测shRNA干扰后3组黑素瘤细胞株M14细胞CXCR7蛋白表达
三、CXCR12/CXCR7对黑素瘤细胞M14细胞侵袭和迁移的影响
1.siRNA干扰对M14细胞侵袭能力的影响:Transwell小室实验显示,在10 μg/L CXCL12趋化下,每高倍(×200)视野下迁移穿过聚碳酸酯膜的细胞数在实验组为20.617±1.503,阴性对照组为42.000±6.018,空白对照组为43.627±2.152,3组间比较差异有统计学意义(F=32.416,P=0.001)。组间比较显示,实验组与阴性对照组和空白对照组间差异均有统计学意义(P值分别为0.001、0.000)。
2.特异性沉默CXCR7对人黑素瘤细胞M14迁移能力的影响:体外培养转染后的M14细胞,在10μg/L CXCL12趋化下,单层细胞划痕24 h后,实验组细胞迁移数为15.00±1.10,阴性对照组为44.90±2.20,而空白对照组为45.30±2.30,3组间比较差异有统计学意义(F=2 411.945,P=0.000)。组间比较显示,实验组与阴性对照组和空白对照组间差异均有统计学意义(P值均为0.000)。
讨 论
研究表明,黑素瘤细胞系存在多种趋化因子受体及配体共表达[2]。趋化因子与瘤细胞表面受体结合后参与黑素瘤血管形成、瘤细胞生长、侵袭、转移等恶性过程[3]。其中黑素瘤细胞表面表达CXCR4受体与原位黑素瘤表面溃疡形成、浸润深度及致死率增高有关[4]。免疫组化染色显示,CXCR3在原发性侵袭性黑素瘤中表达,且CXCR3阳性瘤细胞浸润深度>1 mm[5]。体外实验研究显示,鼠黑素瘤B16F10细胞表达CXCR3及其配体CXCL9、CXCL10,可导致肌动蛋白聚合、侵袭;趋化因子受体CCR7、CCR10、CXCR3和CXCR4高表达参与黑素瘤淋巴转移。其中CCR10与黑素瘤定向转移皮肤有关,CXCR3和CXCR4参与黑素瘤肺部定向转移过程。Lee 等[6]研究发现,CXCR7 与受体 CXCL12 结合后可导致正常人表皮黑素细胞CXCL12诱导的迁移过程。研究显示,在黑素瘤瘤组织及黑素瘤细胞株A375和M14细胞中均存在CXCR7蛋白表达,提示CXCR7可能在黑素瘤生物学行为中发挥作用[1]。
CXCR7参与多种肿瘤生长、生存和转移过程[7]。研究显示,CXCR7 在乳腺癌[8]、胰腺癌[9]、甲状腺乳头状癌[10],前列腺癌[11]等多种肿瘤组织表达升高,并且靶向沉默肝癌、结肠癌细胞株CXCR7表达后可有效抑制肿瘤细胞增殖和迁移能力[12-13];与肿瘤分期、分级有关,可促进血管生成,参与肿瘤细胞与内皮细胞之间的黏附,增强瘤细胞侵袭力,促进肿瘤侵袭转移。在前列腺癌中,缺氧诱导因子1a(HIF-1a)诱导CXCR7表达升高后,激活表皮生长因子受体(EGFR)信号转导,促进癌细胞生长[14]。CXCR7 在多种人类髓系恶性细胞系中高表达,通过核因子κB(NF-κB)依赖性调节,导致丝裂原活化蛋白激酶(MAPK)p42/44和蛋白激酶B磷酸化,促进细胞黏附和迁移[15]。
我们通过RNA干扰技术阻断黑素瘤M14细胞表达CXCR7,进而观察干扰后细胞侵袭、转移相关生物学行为的变化。首先利用免疫印迹技术检测2株黑素瘤细胞CXCR7蛋白表达量,实验证实,M14细胞株表达上调明显,故选择M14细胞作为后续实验。利用RNAi干扰技术后观察到细胞表达CXCR7基因和蛋白量均明显下调。Transwell小室实验及细胞划痕实验结果均显示,CXCR7-shRNA干扰组到达聚碳酸酯膜下表面的细胞数较两个对照组均明显下降,表明干扰后在CXCL12趋化下细胞迁移能力明显下降。因此推测,CXCR7参与M14细胞侵袭迁移过程以及黑素瘤的恶性侵袭过程。关于CXCR7与其配体结合后激活的具体信号转导通路及相关分子作用机制以及与其他趋化因子受体信号通路之间的交互作用等方面的研究还有待深入。
[1]李小静,刘排,陈浩,等.CXCR7在常见皮肤恶性肿瘤及其细胞株中的表达及意义[J].中华皮肤科杂志,2011,44(12):854-856.
[2]Pinto S,Martínez-Romero A,O′Connor JE,et al.Intracellular coexpression of CXC-and CC-chemokine receptors and their ligands in human melanoma cell lines and dynamic variations after xenotransplantation[J].BMC Cancer,2014,14:118.
[3]Richmond A,Yang J,Su Y.The good and the bad of chemokines/chemokine receptors in melanoma[J].Pigment Cell Melanoma Res,2009,22(2):175-186.
[4]Longo-Imedio MI,Longo N,Treviño I,et al.Clinical significance of CXCR3 and CXCR4 expression in primary melanoma [J].Int J Cancer,2005,117(5):861-865.
[5]Monteagudo C,Martin JM,Jorda E,et al.CXCR3 chemokine receptor immunoreactivity in primary cutaneous malignant melanoma:correlation with clinicopathological prognostic factors[J].J Clin Pathol,2007,60(6):596-599.
[6]Lee E,Han J,Kim K,et al.CXCR7 mediates SDF1-induced melanocyte migration [J].Pigment Cell Melanoma Res,2013,26(1):58-66.
[7]Sun X,Cheng G,Hao M,et al.CXCL12/CXCR4/CXCR7 chemokine axis and cancer progression[J].Cancer Metastasis Rev,2010,29(4):709-722.
[8]Salazar N,Muñoz D,Kallifatidis G,et al.The chemokine receptor CXCR7 interacts with EGFR to promote breast cancer cell proliferation[J].Mol Cancer,2014,13:198.
[9]张泉东,金政锡,郝迪斯,等,磷脂酰肌醇蛋白多糖-1与趋化因子受体CXCR7在胰腺癌中的表达及临床意义[J].国际免疫学杂志,2014,37(2):157-160.
[10]刘臻,滕绪永,张恒玮,等.甲状腺乳头状癌组织中CXCR7 mRNA和蛋白表达的生物学意义[J].中国医科大学学报,2014,43(2):114-117,121.
[11]Wang J,Shiozawa Y,Wang J,et al.The role of CXCR7/RDC1 as a chemokine receptor for CXCL12/SDF-1 in prostate cancer[J].J Biol Chem,2008,283(7):4283-4294.
[12]王鑫,陈玲,孙飞,等.CXCR7-shRNA靶向抑制结肠癌SW620细胞的体外实验研究[J].西安交通大学学报(医学版),2014,35(4):460-464,480.
[13]林灵,韩梅梅,王芳,等.靶向干扰CXCR7基因表达对肝癌(HCC)细胞增殖及凋亡的影响[J].复旦学报(医学版),2014,41(2):161-167,178.
[14]Singh RK,Lokeshwar BL.The IL-8-regulated chemokine receptor CXCR7 stimulates EGFR signaling to promote prostate cancer growth[J].Cancer Res,2011,71(9):3268-3277.
[15]Tarnowski M,Liu R,Wysoczynski M,et al.CXCR7:a new SDF-1-binding receptor in contrast to normal CD34(+)progenitors is functional and is expressed at higher level in human malignant hematopoietic cells[J].Eur J Haematol,2010,85(6):472-483.
Effects of RNA interference targeting the chemokine receptor 7 gene on the invasion and migration of the human melanoma cell line M14
Liu Pai*,Tian Weiwei,Li Xiaojing,Li Zhifeng,Yan Xia,Sun Jianfang.*Department of Dermatology,Jiangxi Province Dermatosis Special Hospital,Nanchang 330001,China
ObjectiveTo explore the effects of targeted silencing of the chemokine receptor 7 (CXCR7)gene on the invasion and migration of the melanoma cell line M14.MethodsWestern-blot analysis was performed to determine the protein expression of CXCR7 in melanoma cell lines M14 and A375,and CXCR7-overexpressing M14 cells were used in this study.Cultured M14 cells were divided into three groups:experimental group transfected with a small interfering RNA(siRNA)targeting CXCR7(CXCR7-siRNA),negative control group transfected with a negative control siRNA,blank control group receiving no treatment.Real-time quantitative PCR and Western-blot analysis were conducted to determine the mRNA and protein expressions of CXCR7 respectively in M14 cells,Transwell chambers were used to evaluate the invasive activity of M14 cells,and wound healing assay to estimate the migratory activity of M14 cells.ResultsThe experimental group showed significantly decreased mRNA and protein expressions of CXCR7 compared with the negative control group and blank control group(CXCR7 mRNA:0.412±0.023 vs.1.211±0.117 and 1.000±0.102,F=30.068,P=0.001;CXCR7 protein:0.144±0.005 vs.1 and 1.016±0.004,F=11 485.5,P=0.000).The number of M14 cells crossing the polycarbonate membrane per high-power field(×200)was significantly smaller in the experimental group than in the negative control group and blank control group(20.617±1.503 vs.42.000±6.018 and 43.627 ± 2.152,F=32.416,P=0.001).Similarly,the number of migrating M14 cells in wound healing assay was significantly decreased in the experimental group compared with the negative control group and blank control group(15.00±1.10 vs.44.90±2.20 and 45.30±2.30,F=2 411.945,P=0.000).ConclusionTargeted silencing of the CXCR7 gene can significantly inhibit the invasion and migration of M14 cellsin vitro,which may provide a potential target for the treatment of cutaneous melanoma.
Melanoma,experimental;Receptors,CXCR7;RNA interference;Neoplasm invasiveness;Cell migration assays
s:Sun Jianfang,Email:fangmin5758@aliyun.com;Li Xiaojing,Email:zlmdsh@126.com
10.3760/cma.j.issn.0412-4030.2015.12.007
孙建方,Email:fangmin5758@aliyun.com;李小静,Email:zlmdsh@126.com
2015-02-05)
(本文编辑:尚淑贤)

