卡介菌多糖核酸对Nc/Nga小鼠特应性皮炎的保护作用
郭亚南 王丽丽 文海泉 任勇 李颂
卡介菌多糖核酸对Nc/Nga小鼠特应性皮炎的保护作用
郭亚南 王丽丽 文海泉 任勇 李颂
目的 探讨卡介菌多糖核酸(BCG-PSN)对Nc/Nga小鼠特应性皮炎皮损的预防作用及可能机制。方法 外用二硝基氯苯(DNCB)反复刺激新生Nc/Nga小鼠,通过皮炎评分、搔抓行为、组织病理学、免疫学指标评价皮炎损伤程度,观察BCG-PSN对小鼠皮损的预防作用。结果 出生后4周内重复注射BCGPSN,可以显著改善DNCB致敏Nc/Nga小鼠皮损炎症程度,降低皮炎评分以及小鼠的搔抓行为,不同浓度BCGPSN组之间搔抓频率差异无统计学意义。BCG-PSN可以降低血浆中IgE的含量,呈剂量依赖性。0.5 mg/kg BCGPSN可增加皮损中分泌干扰素(IFN)γ的细胞数量。不同剂量BCG-PSN均可降低脾单一核细胞培养上清液中IL-4的含量,增加IL-12的浓度。结论 早期注射BCG-PSN可通过促进分泌IFN-γ的细胞增生,增加IL-12合成,降低IL-4和IgE的含量,从而预防Nc/Nga小鼠皮炎发生。
皮炎,特应性;小鼠,Nc/Nga;树突细胞;卡介菌多糖核酸
卡介菌多糖核酸(BCG-PSN)是从卡介菌中提取多糖、核酸混合而制成的新型免疫调节剂,我们前期实验发现,BCG-PSN可以促进AD患者PBMC中IL-12分泌,纠正Th1/Th2失衡状态[1]。我们的动物实验发现,BCG-PSN可能通过促进IL-12和IFN-γ分泌,抑制IgE合成,发挥治疗Nc/Nga小鼠特应性皮炎样皮损的作用[2]。早期注射BCG-PSN对于特应性皮炎是否有预防作用,经查阅文献,未发现相关研究。我们采用日本Nc/Nga小鼠作为小鼠特应性皮炎模型,观察BCG-PSN对Nc/Nga小鼠特应性皮炎皮损的影响,旨在为早期注射BCG-PSN预防特应性皮炎的发生提供依据。
材料和方法
一、动物与试剂
从日本Charles River Laboratories公司购得6周龄SPF级Nc/Nga小鼠(合格证号110600109000211),自由交配,选择出生24 h内Nc/Nga幼鼠16只,3只母鼠所生,前4周以各自母鼠母乳喂养,4周后分笼饲养。饲养条件为清洁级环境,12 h光照/12 h黑暗,室温为22~25℃,湿度为40%~70%,自由饮水进食。BCG-PSN购于湖南九芝堂医药贸易有限公司,二硝基氯苯(DNCB)购于北京市化学试剂公司,兔抗小鼠IFN-γ抗体和羊抗兔IgG(二抗)购于武汉博士德生物工程有限公司,小鼠 IL-4、IL-12、IgE 酶联免疫检测试剂盒购于美国Invitrogen公司。
二、方法
1.给药:16只Nc/Nga新生小鼠分为3个组,正常对照组4只,低浓度组(0.1 mg/kg BCG-PSN)5只,高浓度组(0.5 mg/kg BCG-PSN)7 只。鼠龄 1、8、15、22 d:正常对照组小鼠分别于皮下注射生理氯化钠溶液,低浓度组小鼠分别注射0.1 mg/kg BCG-PSN,高浓度组小鼠分别皮下注射0.5 mg/kg BCG-PSN。
2.皮损诱导:参考DNCB诱发Nc/Nga小鼠皮炎的文献稍有改进[3-4],鼠龄第49天,用含1%DNCB的丙酮溶液致敏各组Nc/Nga小鼠背部除毛后皮肤,第56、63、70天外用含0.1%DNCB的丙酮溶液进行激发。试验过程中小鼠健康,未出现死亡。
3.观察指标:
(1)皮损严重程度:第 57、64、71 天观察小鼠,进行皮炎评分并拍照。皮炎评分按以下方法进行:观察皮肤红斑、鳞屑、表皮干燥、结痂等情况,按严重程度计分:无症状计0分、轻微计1分、中度计2分、严重计 3分,计算所有症状的分数[3]。
(2)小鼠搔抓行为:第 57、64、71天将小鼠单独放置,观察10 min内小鼠搔抓耳部、背部的次数,连续搔抓算作1次。
(3)血清 IgE 含量:第 57、64、71天眼眶后静脉取血,抗凝血在4℃下1 600×g离心30 min,获取血浆,冻存于-20℃,待测。采用酶联免疫吸附试验(ELISA)检测血浆中细胞因子的浓度。
(4)Nc/Nga小鼠脾脏单一核细胞培养液中IL-4、IL-12的含量:小鼠脱颈处死后,无菌取脾脏置于消毒平皿中;取脾脏单一核细胞,调节细胞浓度为1×106/ml,接种至24孔培养板,培养48 h后收集上清液。用ELISA方法检测IL-4、IL-12的含量。
(5)组织病理:第72天处死小鼠后,背部皮损组织用4%甲醛固定,石蜡包埋,HE染色后显微镜下观察组织病理改变。
(6)Nc/Nga小鼠干扰素(IFN)γ的表达:用免疫组化法检测小鼠组织病理中IFN-γ的表达水平。
4.统计学处理:SPSS 16.0统计软件分析数据。计量资料以±s表示。多个样本之间采用单因素方差分析,用方差齐性检验,如方差不齐,采用Dunnetts T3方法进行两两比较,如方差齐,采用Bonferroni分析,进一步比较两两之间差异。P<0.05为差异有统计学意义。
结 果
1.BCG-PSN对Nc/Nga小鼠皮炎评分的影响:早期接种BCG-PSN可以减轻由外用DNCB引起的皮炎。第57、64、71天,低浓度组皮炎评分与正常对照组相比,P值分别为 0.005、0.261、0.014,高浓度组与正常对照组相比,P值分别为0.000、0.002、0.000。第71天高浓度组与低浓度组之间差异有统计学意义,P= 0.013。见表1。
2.BCG-PSN对小鼠搔抓频率的影响:早期注射低浓度BCG-PSN可以明显降低DNCB致敏Nc/Nga小鼠搔抓频率,与正常对照组比较,差异有统计学意义(P= 0.000、0.007、0.000),高浓度 BCG-PSN 明显降低搔抓频率,与正常对照组比较,差异有统计学意义(P= 0.00、0.00、0.00)。BCG-PSN两个剂量之间差异无统计学意义,P= 0.058、0.074、0.051。见表2。
3.Nc/Nga小鼠各组第57、64、71天血浆IgE含量:早期多次注射BCG-PSN可以降低血浆中IgE的含量。第57、64、71天,低浓度组与正常对照组相比,P值分别为0.000、0.000、0.000;高浓度组与正常对照组相比,P值分别为 0.000、0.000、0.000。高浓度BCG-PSN能更有效的降低血浆内IgE的含量,第57、64、71天,高浓度组与低浓度组比较,P值分别为 0.001、0.009、1。见表 3。
表1 Nc/Nga小鼠各组不同时间皮炎评分(±s)

表1 Nc/Nga小鼠各组不同时间皮炎评分(±s)
注:a:与正常对照组比较,P < 0.05;b:与低浓度组比较,P < 0.05
组别 只数 57 d 64 d 71 d正常对照组 4 7±0.82 8.75±0.96 9.75±0.96低浓度组 5 4.8±0.84a 7.4±1.14a 7.6±1.14a高浓度组 7 4±0.82a 5.7±1.11a 5.71±0.78ab
表2 Nc/Nga小鼠各组搔抓频率(±s)
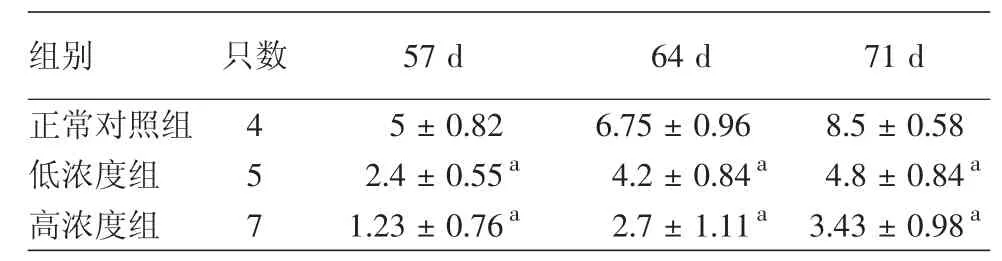
表2 Nc/Nga小鼠各组搔抓频率(±s)
注:a:与正常对照组比较,P<0.05
组别 只数 57 d 64 d 71 d正常对照组 4 5±0.82 6.75±0.96 8.5±0.58低浓度组 5 2.4±0.55a 4.2±0.84a 4.8±0.84a高浓度组 7 1.23±0.76a 2.7±1.11a 3.43±0.98a
4.Nc/Nga小鼠各组脾单一核细胞培养上清液IL-4、IL-12的含量:Nc/Nga小鼠早期皮下注射低浓度、高浓度的BCG-PSN,均可降低DNCB激发的Nc/Nga小鼠脾脏单一核细胞培养上清液中IL-4的含量,与正常对照组相比,差异有统计学意义,P值分别为0.000、0.000。可增加IL-12含量,与正常对照组比较,差异有统计学意义,P值分别为0.000、0.000。高浓度BCG-PSN可明显降低IL-4和提高IL-12的含量,与低浓度BCG-PSN比较,差异有统计学意义,P值分别为0.013、0.002,见表4。
表3 Nc/Nga小鼠各组第57、64、71天血浆IgE浓度(μg/L,±s)

表3 Nc/Nga小鼠各组第57、64、71天血浆IgE浓度(μg/L,±s)
注:a:与正常对照组比较,P < 0.05;b:与低浓度组比较,P < 0.05
组别 只数 57 d 64 d 71 d正常对照组 4 38.45±3.09 58.77±4.5 70.9±2.97低浓度组 5 25.2±4.77a 32.69±3.92a 39.38±4.8a高浓度组 7 16.09±1.9ab 24.38±3.51ab 37.15±4.68
表4 Nc/Nga小鼠各组单一核细胞培养上清液中IL-4、IL-12的含量(ng/L,±s)

表4 Nc/Nga小鼠各组单一核细胞培养上清液中IL-4、IL-12的含量(ng/L,±s)
注:a:与正常对照组比较,P < 0.05;b:与低浓度组比较,P < 0.05
组别 只数 IL-4 IL-12正常对照组 4 50.26±5.24 19.78±5.11低浓度组 5 32.56±4.62a 36.44±3.48a高浓度组 7 23.91±3.39ab 47.81±4.43ab
5.Nc/Nga小鼠各组背部皮肤组织病理学:正常对照组小鼠组织病理提示有角化过度、棘层肥厚、基底细胞空泡化,真皮增厚、较多淋巴细胞浸润。早期多次注射低浓度BCG-PSN可以减少后期DNCB致敏Nc/Nga小鼠炎症程度,表现为基底层细胞空泡化消失,真皮内稀疏淋巴细胞浸润;早期多次注射高浓度BCG-PSN可以明显减轻小鼠炎症程度,组织病理图片提示轻微角化过度,棘层恢复正常,真皮内散在少许淋巴细胞浸润,见图1~3。
6.Nc/Nga小鼠各实验组背部皮损IFN-γ的表达:用高浓度BCG-PSN早期处理Nc/Nga小鼠,经DNCB致敏后,其真皮内有较多分泌IFN-γ的细胞,低浓度BCG-PSN早期处理的小鼠和正常对照组小鼠真皮内未见明显的分泌IFN-γ的细胞。见图4。

图1 正常对照组小鼠背部组织角化过度、棘层肥厚、基底细胞空泡化,真皮增厚、较多淋巴细胞浸润(HE×40)

图2 低浓度组表现为基底层细胞空泡化消失,真皮内稀疏淋巴细胞浸润(HE×40)

图3 高浓度组提示轻微角化过度,棘层恢复正常,真皮内散在少许淋巴细胞浸润(HE×40)

图4 Nc/Nga小鼠背部皮损干扰素γ的表达(免疫组化 ×40) 正常对照组(4A)及低浓度组(4B)小鼠真皮内未见分泌IFN-γ的细胞,高浓度组(4C)小鼠真皮内有较多分泌干扰素γ的细胞
讨 论
一些研究结果表明,BCG-PSN是较强的Th1型细胞因子活化剂,可以促进IFN-γ的表达。林恩尧等[4]研究表明,经BCG-PSN免疫的豚鼠,外周血的T淋巴细胞明显增加,但是早期注射BCG-PSN是否可以防止过敏性疾病的发生未见相关报道。AD是一种慢性瘙痒性皮肤病,通常与过敏性鼻炎和哮喘等过敏性疾病相关[5-6]。Nc/Nga鼠是日本一种名叫Nishiki的宠物鼠,1997年Matsuda等对其进行了基础和临床研究,正式确立它作为AD模型。当Nc/Nga小鼠在普通环境下饲养时,它们在第8周开始出现搔抓行为,皮肤开始变得干燥并覆盖鳞屑;在以后的几个星期,小鼠的耳朵、背部、颈部和面部出现皮损。普通环境下Nc/Nga小鼠皮损免疫组化显示有过度角化、棘层肥厚、角化不全,所有的这些表现与AD患者身上所观察到的皮损非常相似[7-8]。小鼠皮损还提示有淋巴细胞浸润、巨噬细胞浸润,肥大细胞和嗜酸性粒细胞脱颗粒[9-11]。
我们前期实验[2]利用DNCB重复刺激Nc/Nga小鼠皮肤,成功的建立特应性皮炎小鼠模型,由于部分小鼠在用5%DNCB刺激后,出现较为严重的溃疡、出血。为避免出现类似结果,我们将Nc/Nga小鼠背部毛发除掉后,涂抹1%的DNCB致敏,0.1%的DNCB重复刺激3次。结果发现,正常对照组小鼠第1次重复刺激后,小鼠背部出现鳞屑、红斑及皮肤干燥,第2次重复刺激后,小鼠背部出现红斑、鳞屑,第3次重复刺激后,小鼠背部严重红斑、厚痂。早期多次注射BCG-PSN可以缓解DNCB所致的皮炎严重程度,低浓度组小鼠早期出现少量抓痕和红斑,后期皮肤干燥有较多鳞屑,未见明显红斑及结痂;高浓度组小鼠早期仅有皮肤干燥,后逐渐出现少许鳞屑。皮炎评分进一步证实,BCG-PSN对于特应性皮炎样皮损有保护作用。早期多次注射低浓度和高浓度BCG-PSN可以明显减少DNCB对成年Nc/Nga小鼠造成的搔抓行为,不同剂量BCG-PSN之间搔抓频率无差异。我们的实验还发现,早期多次注射BCG-PSN可以降低Nc/Nga小鼠血浆中IgE的含量,呈剂量依赖性。组织病理学提示正常对照组小鼠有过度角化、棘层肥厚、基底细胞空泡化,真皮增厚、有大量淋巴细胞浸润;早期多次注射低浓度的BCG-PSN可以减少后期DNCB致敏Nc/Nga小鼠炎症程度,表现为基底层细胞空泡化消失,真皮内淋巴细胞减少;早期多次注射高浓度BCG-PSN可以明显减轻小鼠炎症程度,组织病理图片提示轻微角化过度,棘层恢复正常,真皮内稀疏淋巴细胞。以上结果说明,早期多次注射BCG-PSN对于Nc/Nga小鼠特应性皮炎样皮损炎症程度的改善有益。
Sugiura等[12]检测5~28周龄普通环境下饲养的Nc/Nga鼠,发现皮损中分泌IL-4和IL-5的细胞明显增多,并且随周龄增长而增加,而分泌IFN-γ的细胞在21周前非常稀少,21周后才开始出现。Gately等[13]认为IL-12在免疫反应中可诱导IFN-γ产生,对IL-4的产生起抑制作用,从而诱导免疫反应朝着Th1型方向发展。IFN-γ有抑制Th2类细胞因子IL-4,IL-5的产生,促使Th0向Th1分化,抑制其向Th2分化的作用,并可阻断IgE的合成,减少嗜酸性粒细胞的浸润和活化。IFN-γ可以加强IL-12诱导Th1细胞产生的能力,而IL-12本身又能诱导IFN-γ的产生。这样,形成一个正反馈的调节,加强了Th1的免疫反应,抑制了Th2的免疫反应[14]。我们通过免疫组化染色发现,高浓度BCG-PSN组小鼠皮损内分泌IFN-γ的细胞大量出现,而单一核细胞培养上清液中IL-4含量与正常对照组相比,明显下降,IL-12的含量明显增高。我们认为早期多次皮下注射高浓度的BCG-PSN,可诱导分泌IFN-γ细胞产生,促进IL-12分泌,抑制IL-4和IgE的合成,从而减轻皮损炎症程度,发挥早期干预的作用。
[1]胡南,文海泉,肖嵘,等.卡介菌多糖核酸对特应性皮炎患者PBMC产生嗜酸粒细胞活化趋化因子和CCR3的表达[J].中华皮肤科杂志,2006,39(11):657-658.
[2]郭亚南,文海泉,张桂英,等.卡介菌多糖核酸对二硝基氯苯诱导的Nc/Nga小鼠特应性皮炎样皮损的影响[J].中华皮肤科杂志,2010,43(7):497-500.
[3]Takano N,Sakurai T,Kurachi M.Effects of anti-nerve growth factor antibody on symptoms in the NC/Nga mouse,an atopic dermatitis model[J].J Pharmacol Sci,2005,99(3):277-286.
[4]林恩尧,王世珍,朱绍璋,等.卡介苗提取物调节慢性支气管炎免疫功能效果的观察[J].中华结核和呼吸杂志,1987,10(1):41-43.
[5]Akdis CA.New insights into mechanisms of immunoregulation in 2007[J].J Allergy Clin Immunol,2008,122(4):700-709.
[6]Akdis CA.Immune regulation by histamine H4 receptors in skin[J].J Invest Dermatol,2008,128(7):1615-1616.
[7]Vestergaard C,Yoneyama H,Matsushima K.The Nc/Nga mouse:a model for atopic dermatitis[J].Mol Med Today,2000,6(5):209-210.
[8]Vestergaard C,Bang K,Gesser B,et al.A Th2 chemokine,TARC,produced by keratinocytes may recruit CLA+CCR4+lymphocytes into lesional atopic dermatitis skin[J].J Invest Dermatol,2000,115(4):640-646.
[9]Yamashita H,Makino T,Mizukami H,et al.Pharmacological characterization of a chronic pruritus model induced by multiple application of 2,4,6-trinitrochlorobenzene in NC mice[J].Eur J Pharmacol,2007,563(1-3):233-239.
[10]Tanaka Y,Yamashita Y,Michikawa H,et al.Pharmacological characterization ofthebeta-adrenoceptorthatmediatesthe relaxant response to noradrenaline in guinea-pig tracheal smooth muscle[J].Naunyn Schmiedebergs Arch Pharmacol,2007,375(1):51-64.
[11]Gao XK,Nakamura N,Fuseda K,et al.Establishment of allergic dermatitis in Nc/Nga mice as a model for severe atopic dermatitis[J].Biol Pharm Bull,2004,27(9):1376-1381.
[12]Sugiura K,Hiramoto K,Shamoto M,et al.Immunological cell situation in the skin of atopic model mice [J].J Eur Acad Dermatol Venereol,2004,18(2):148-152.
[13]Gately MK,Gubler U,Brunda MJ,et al.Interleukin-12:a cytokine with therapeutic potential in oncology and infectious diseases[J].Ther Immunol,1994,1(3):187-196.
[14]Matsumoto M,Ra C,Kawamoto K,et al.IgE hyperproduction through enhanced tyrosine phosphorylation of Janus kinase 3 in Nc/Nga mice,a model for human atopic dermatitis [J].J Immunol,1999,162(2):1056-1063.
Protective effect of polysaccharide nucleic acid fraction of bacillus Calmette-Guerin against atopic dermatitis in Nc/Nga mice
Guo Yanan*,Wang Lili,Wen Haiquan,Ren Yong,Li Song.*Shandong Provincial Hospital,Shandong University,Jinan 250021,China
Li Song,Email:123250349@qq.com
Objective To evaluate the protective effect of polysaccharide nucleic acid fraction of bacillus Calmette-Guerin(BCG-PSN)against atopic dermatitis(AD)in Nc/Nga mice,and to explore its possible mechanism.Methods Sixteen Nc/Nga mice were classified into normal control group (n=4),low-concentration BCG-PSN group (n=5)and high-concentration BCG-PSN group (n=7)to be subcutaneously injected with sodium chloride physiological solution,BCG-PSN of 0.1 mg/kg and 0.5 mg/kg respectively,at 1,8,15 and 22 days of age.Dinitrochlorobenzene(DNCB)was repeatedly and topically applied to these Nc/Nga mice to induce AD-like lesions at 49 days of age.The preventive effect of BCG-PSN against AD was evaluated by dermatitis scores,scratching frequency,histopathological manifestations and immunological parameters(including IgE,interleukin(IL)-4 and-12,and interferon(IFN)-γ).Results Repeated injection of BCG-PSN within 4 weeks after birth significantly decreased the severity of DNCB-induced AD-like lesions,dermatitis scores and scratching behavior in Nc/Nga mice.There was no statistical difference in scratching frequency between the high-and low-concentration BCG-PSN groups.BCG-PSN treatment reduced the plasma level of IgE in Nc/Nga mice in a dose-dependent manner.BCG-PSN at 0.5 mg/kg increased the number of cells secreting IFN-γ in skin lesions of mice.Both doses of BCG-PSN down-regulated IL-4 level,but up-regulated IL-12 level in the culture supernatant of spleen mononuclear cells from mice.Conclusion Early injection of BCG-PSN could protect Nc/Nga mice against dermatitis by promoting the proliferation of IFN-γsecreting cells,increasing the synthesis of IL-12,and reducing the levels of IL-4 and IgE.
Dermatitis,atopic;Mice,Nc/Nga;Dendritic cells;BCG-PSN
10.3760/cma.j.issn.0412-4030.2015.01.011
250021济南,山东大学附属省立医院(郭亚南、任勇、李颂);济南市第五人民医院(王丽丽);中南大学湘雅二医院(文海泉)
李颂,Email:123250349@qq.com
2014-06-24)
(本文编辑:吴晓初)

