消胆胺联合阿嗪米特对糖尿病小鼠胆汁酸代谢的影响
梁业飞,周有望,陶文
(1.广西壮族自治区钦州市第一人民医院药剂科,钦州 535001;2.广西壮族自治区百色市人民医院药学部,百色533000;3.广西中医药大学第一附属医院药学部,南宁 530023)
糖尿病是由遗传因素、免疫功能紊乱、自由基毒素等多种致病因子引起的机体代谢紊乱,导致多器官的慢性损伤和功能障碍,严重影响患者的身体健康,甚至危及生命。胆汁酸是胆汁的主要成分,不仅参与机体脂质的乳化吸收,而且还作为重要的内分泌信号因子,在机体的糖代谢、脂代谢以及能量代谢中发挥着重要的调节作用[1-2]。消胆胺(cholestyramine)是一种高分子量季胺类阴离子交换树脂,可与胆汁酸结合形成络合物从大便排出,减少胆汁酸的重吸收,改善胆汁酸循环[3]。阿嗪米特(azintamide)为一种促进胆汁分泌药物,它可以增加胆汁的液体量,增加胆汁中固体成分的分泌[4]。笔者在本研究通过糖尿病小鼠模型实验探讨消胆胺和阿嗪米特联合用药对糖尿病胆汁酸代谢的影响,从分子水平对胆汁酸代谢相关基因进行研究,旨在为糖尿病的治疗提供新思路和新途径。
1 材料与方法
1.1 动物 健康清洁级C57BL/6J雄性小鼠,体质量20~25 g,北京大学医学部实验动物中心提供。动物生产许可证号:SCXK(京)2011-0012,均饲养于通风良好,室温(24±2)℃,12 h光照周期,自由进食。
1.2 试药与材料 消胆胺购自南京厚生药业有限公司;阿嗪米特购自扬州一洋制药有限公司;逆转录酶、Taq DNA聚合酶、限制性内切酶均购自TaKaRa公司;全自动胆汁酸检测试剂盒购自北京戴格诺斯生物科技有限公司,批号:20130627;RNeasy Mini®kit试剂盒(批号:20130303)、High Capacity cDNA Reverse Transcription®kit试剂盒(批号:20130805)均购自QIAGEN公司;兔抗人胆固醇7α羟化酶(Cholesterol 7α-hydroxylase,CYP7A1)多抗、羊抗人胆固醇 27α 羟化酶(Cholesterol 27α-hydroxylase,CYP27A1)多抗、兔抗鼠β-actin多抗、辣根过氧化物酶标记羊抗兔二抗,均购自Santa Cruz公司;牛血清清蛋白(bovine serum albumin,BSA)购自Sigma公司;其他试剂为分析纯。
1.3 动物分组及糖尿病小鼠模型构建 健康清洁级C57BL/6J雄性小鼠,适应性喂养2周。将实验小鼠随机分为4组。正常对照组:以普通饲料喂养8周,禁食过夜,继续普通饲料喂养4周;模型对照组:以高脂高糖饲料(含酪蛋白23.6%,蔗糖20.4%,猪油20.9%)喂养8周,禁食过夜,取成模小鼠继续高脂高糖饲料喂养4周;消胆胺组:与模型对照组同种饲料喂养8周,禁食过夜,取成模小鼠添加3%消胆胺的高脂高糖饲料继续喂养4周;联合治疗组:与模型对照组同种饲料喂养8周,禁食过夜,取成模小鼠添加3%消胆胺及1%阿嗪米特的高脂高糖饲料继续喂养4周。
1.4 糖尿病小鼠成模标准及空腹血糖的测定 所有小鼠在适应性喂养2周后,禁食过夜测定空腹血糖。为考察是否建模成功,所有小鼠在普通饲料/高脂高糖饲料喂养8周后,禁食过夜测定空腹血糖。糖尿病小鼠成模标准:空腹血糖>11.0mmol·L-1。选取符合成模标准的小鼠,继续按组别喂养4周,禁食过夜测定空腹血糖。
1.5 大便、肝脏、血液中胆汁酸浓度的测定 实验小鼠在普通饲料/高脂高糖饲料喂养8周后,收集小鼠的大便样本,进行大便胆汁酸浓度测定,之后各组在给药/不给药状态下分别喂养4周,在处死前收集小鼠的大便样本。大便样本冷冻干燥呈粉末状,65℃恒温条件下,90%乙醇提纯大便胆汁酸两次,1h。离心后,将上清液在氮气条件下干燥,并再溶解于90%乙醇中,作为大便中胆汁酸浓度测定样本;在麻醉状态下,开腹后在十二指肠上方横断胆总管,插入硬膜外导管结扎固定,收集胆汁1h,作为肝脏中胆汁酸浓度测定样本;股动脉采血,3000 r·min-1分离血清,作为血液中胆汁酸浓度测定样本。采用全自动胆汁酸检测试剂盒进行胆汁酸浓度测定。
1.6 胆汁酸代谢相关基因mRNA表达分析 将喂养12周的小鼠处死,迅速提取小鼠肝脏组织于液氮中冻存。冰浴条件下,用RNeasy Mini®kit试剂盒提取肝组织总 RNA,然后利用 High Capacity cDNA Reverse Transcription®kit试剂盒进行逆转录。预设引物和Taqman®探针,在 lightcycler®480实时荧光定量 PCR系统中,对胆汁酸经典合成途径的限速酶-CYP7A1基因、胆汁酸的核受体法尼醇 X受体(Farnesoid X receptor,FXR)基因、替代合成途径的限速酶-CYP27A1基因进行定量。β-actin基因作为内参对照。
1.7 Western bolt检测肝组织 CYP7A1、CYP27A1 蛋白的表达 肝脏组织100 mg加入预冷的RIPA裂解液1mL,冰浴匀浆,8000 r·min-1(有效离心半径8 cm)离心10 min,收集上清液备用,取1 mg·mL-1BSA制作蛋白标准曲线,根据蛋白标准曲线浓度估算肝脏上清液的蛋白含量。上样,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),电泳结束后,将目的蛋白所在凝胶剪下并电转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜。用含5%脱脂奶粉的磷酸盐缓冲液(phosphate buffered solution,PBS)浸泡缓慢摇动4℃封闭过夜。封闭结束后,加入兔抗人CYP7A1多抗、羊抗人CYP27A1多抗和兔抗鼠β-actin多抗溶液孵育,摇床轻摇1~2 h。洗涤缓冲液TBST洗3次,再加入HRP标记羊抗兔二抗溶液,摇床轻摇1~2 h。TBST洗涤后,曝光,显色,检测杂交信号。
1.8 统计学方法 应用SPSS16.0版软件进行统计学分析,数据资料采用均数±标准差()来表示,分类变量使用卡方检验,连续变量采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 糖尿病小鼠空腹血糖的测定 结果见表1。正常对照组:小鼠在普通饲料喂养12周前后血糖变化差异无统计学意义(t=0.76,P >0.05);模型对照组:高脂高糖饲料喂养8周前后血糖显著增加(t=3.18,P<0.01),表明糖尿病小鼠模型构建成功。消胆胺组:在高脂高糖饲料喂养8周后,血糖明显增加(t=3.03,P<0.01),后添加消胆胺喂养4周后,小鼠血糖显著降低(t=2.54,P <0.05);联合治疗组:在高脂高糖饲料喂养8 周后,血糖明显增加(t=2.97,P <0.01),后添加消胆胺联合阿嗪米特喂养4周后,小鼠血糖显著降低(t=3.35,P <0.01);可见消胆胺联合阿嗪米特对糖尿病小鼠血糖控制具有正向协同作用。
2.2 大便、肝脏、血液中胆汁酸浓度的测定 实验小鼠在普通饲料/高脂高糖饲料喂养8周后,高脂高糖饲料喂养的小鼠大便胆汁酸浓度较普通饲料喂养的小鼠有所增加,但差异无统计学意义(t=1.74,P>0.05)。之后各组在给药/不给药状态下分别喂养4周后,由图1可知,经过消胆胺和阿嗪米特治疗,小鼠大便中胆汁酸浓度显著增加(t=2.64,P <0.05),可见阿嗪米特可以协同消胆胺促进大便中胆汁酸的排出;血液中胆汁酸浓度显著提高,差异有统计学意义(t=5.61,P<0.01);肝脏中胆汁酸浓度增高(t=3.01,P <0.05,t=7.90,P <0.01),说明通过用药,使肝脏合成的胆汁酸浓度增加,阿嗪米特进一步促进了胆汁酸的合成,有利于减少肝胆固醇的沉积,这可能是对胆固醇合成增加的一种适应性调节。
表1 4组小鼠空腹血糖的测定Tab.1 Determination of fasting blood-glucose in four groups of micemmol·L -1,

表1 4组小鼠空腹血糖的测定Tab.1 Determination of fasting blood-glucose in four groups of micemmol·L -1,
与本组饲养2周时比较,*1 P<0.01;与本组饲养8周时比较,*2 P <0.05,*3 P <0.01Compared with the same group at the 2nd week,*1 P <0.01;Compared with the same group at the 8th week,*2 P <0.05,*3 P <0.01
组别 小鼠数 饲养2周 饲养8周 饲养12周正常对照组20 6.10 ±0.35 6.11 ±0.21 6.23 ±0.85模型对照组 20 5.90 ±0.56 15.64 ±1.26*1 15.73 ±1.81消胆胺组 20 5.94 ±0.68 14.57 ±1.31*1 11.76 ±1.71*2联合治疗组 20 6.03 ±0.26 15.32 ±1.44*1 8.73 ±0.95*3
2.3 胆汁酸代谢相关基因mRNA定量分析 结果见图2。消胆胺和阿嗪米特联合治疗条件下,胆汁酸的核受体 FXR基因 mRNA表达减少(t=3.62,P<0.05),CYP7A1基因 mRNA 表达明显增加(t=2.68,P<0.05),CYP27A1基因 mRNA表达基本不变(t=0.93,P >0.05),这表明,在消胆胺和阿嗪米特的联合用药条件下,抑制FXR基因的表达,从而激活CYP7A1基因的表达调控,可见消胆胺和阿嗪米特联合治疗对胆汁酸经典合成途径产生增强作用。
2.4 肝组织CYP7A1、CYP27A1蛋白表达 结果见图3。Western blot结果可以看出,在消胆胺和阿嗪米特的联合治疗下,CYP7A1蛋白表达增加,CYP27A1蛋白表达无明显变化。这与胆汁酸代谢相关基因mRNA表达结果一致,都说明消胆胺和阿嗪米特联合治疗对胆汁酸经典合成途径产生增强作用,而对胆汁酸替代合成途径无显著影响。
3 讨论
近年来,随着社会经济的发展和居民生活水平的提高,糖尿病发病率及患病率逐年增长,已成为继心脑血管疾病及恶性肿瘤之后严重危害人类健康的慢性疾病[5]。糖尿病患者常伴随胆固醇和胆汁酸水平增高和脂质沉积,对胆固醇和胆汁酸代谢平衡产生影响[6]。胆汁酸是胆汁的主要成分,占胆汁总固体量50% ~70% ,也是胆固醇在肝内的代谢产物,胆汁中胆汁酸/胆固醇比值下降是导致胆固醇过饱和状态的重要因素[7]。胆汁酸不仅对脂类和脂溶性物质的消化吸收以及调节胆固醇代谢起着重要作用,而且它还作为信号分子在糖代谢、脂代谢、能量代谢等方面发挥着重要的作用[8]。

A.正常对照组;B.模型对照组;C.消胆胺组;D.联合治疗组;a.大便;b.血液;c.肝脏;与正常对照组比较,*1 P <0.05,*2 P <0.01图1 4组小鼠饲养12周后大便、血液和肝脏中胆汁酸浓度的柱状图A.normal control group;B.model control group;C.cholestyramine group;D.combination treatment group;a.feces;b.blood;c.liver;Compare with normal control group,*1 P <0.05,*2 P <0.01Fig.1 Bile acid levels in feces,blood and liver of four groups of mice at the 12th week
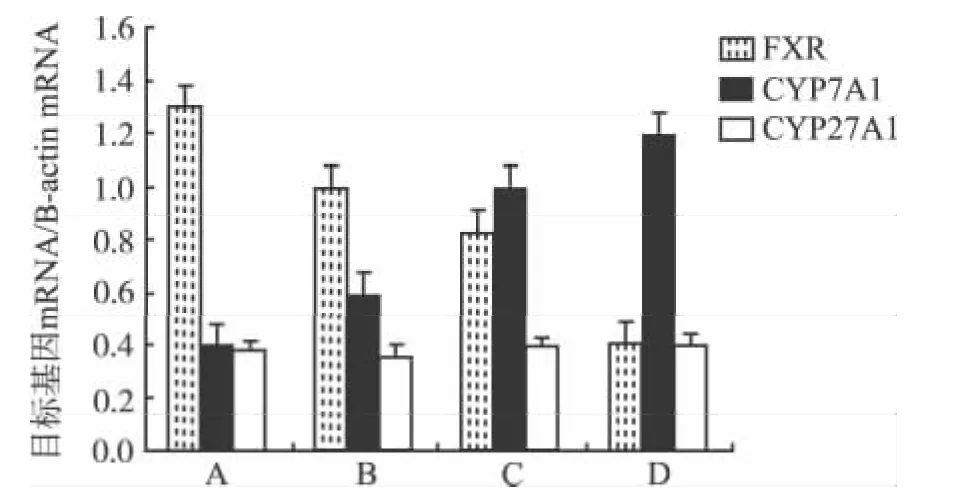
A.正常对照组;B.模型对照组;C.消胆胺组;D.联合治疗组图2 胆汁酸代谢相关基因mRNA定量分析柱状图A.normal control group;B.model control group;C.cholestyramine group;D.combination treatment groupFig.2 Quantitative analysis on mRNA expression related to bile acid metabolism

A.正常对照组;B.模型对照组;C.消胆胺组;D.联合治疗组图3 4组肝组织CYP7A1和CYP27A1蛋白表达电泳图A.normal control group;B.model control group;C.cholestyramine group;D.combination treatment groupFig.3 Protein expression of CYP7A1 and CYP27A1 in liver tissue of four groups
胆汁酸是机体胆固醇转化排出体外的最主要形式,正常情况下胆汁酸主要在小肠下端被重吸收,只有很少的胆汁酸可以到达大肠,消胆胺可与胆汁酸螯合,阻碍胆汁酸的重吸收,增加随大便排出的胆汁酸量,促进胆固醇向胆汁酸转化,从而降低体内胆固醇含量[9]。然而,对于代谢紊乱的糖尿病患者单用消胆胺一种药物疗效往往不很满意。糖尿病状态下,肝脏胆固醇合成限速酶活性降低,肝内胆固醇呈过饱和状态,同时因内脏自主神经功能紊乱和微血管病变使胆囊收缩功能低下,胆囊排空延迟,胆汁流出不畅,造成胆汁郁积[10]。阿嗪米特为一强效的促进胆汁分泌药物,不仅影响肝脏的脂代谢,使肝脏合成胆汁酸的速率增强,改善胆固醇的过饱和状态,而且可增加胆汁分泌量,特别是胆汁中固体成分的含量,增加胰酶活性[11]。本研究发现,消胆胺可与胆汁酸结合形成络合物从大便排出,减少胆汁酸的重吸收,从而增加大便中胆汁酸的浓度。另一方面,由于重吸收的胆汁酸减少,这也促进肝脏消耗更多的胆固醇来合成新的胆汁酸,从而减少肝脏中胆固醇的瘀积。阿嗪米特与消胆胺协同治疗,进一步促进胆汁酸的合成及分泌,这可能也是大便、肝脏、血液中胆汁酸浓度明显增高的原因,联合治疗可获得较满意的疗效。
肝通过“经典途径”和“替代途径”合成胆汁酸。经典途径是主要途径,胆汁酸是内源性FXR配体,二者结合后抑制CYP7A1的表达。CYP7A1是胆汁酸经典合成途径的限速酶,其活性似乎与血浆胆固醇浓度成反比,CYP7A1的表达上调可以增加肝脏中胆固醇向胆汁酸的转化[12]。本研究结果表明,消胆胺在肠道与多种胆汁酸螯合,显著影响胆汁酸的重吸收,导致FXR表达减少,CYP7A1的表达增加,使肝脏胆汁酸合成增加,消耗肝细胞内的胆固醇,使胆固醇水平下降,在阿嗪米特协同作用下,进一步促进了CYP7A1表达。本研究还表明胆汁酸替代合成途径的关键酶CYP27A1在用药前后均未发生变化,说明胆汁酸合成增加是通过经典途径代谢增强引起。
综上所述,深入研究胆汁酸及其信号通路,对于探讨代谢相关性疾病如胰岛素抵抗、2型糖尿病、高血压、高脂血症和动脉粥样硬化等的发病机制和干预措施具有重要意义。消胆胺与阿嗪米特的联合治疗,探索其在胆汁酸代谢通路中所发挥的作用,不仅有利于丰富肠肝循环的研究内容,深化对于代谢性疾病致病机制的了解,而且还寻找到新的治疗途径与靶点,为高胆固醇血症、胆汁淤积肝病、糖尿病等疾病的治疗提供了新的方向。
[1]THOMAS C,AUWERX J,SCHOONJANS K.Bile acids and the membrane bile acid reeeptor TGR5-connecting nutrition and metabolism[J].Thyroid,2008,18(2):167-174.
[2]NORLIN M,WIKVALL K.Enzymes in the conversion of cholesterol into bile acids[J].Curr Mol Med,2007,7(2):199-218.
[3]TAKEBAYASHI K,ASO Y,INUKAI T.Role of bile acid sequestrants in the treatment of type 2 diabetes[J].World J Diabetes,2010,15(1):146 -152.
[4]PIERO P,AGOSTINO D C,LEONILDE B,et al.Therapy of gallstone disease:What it was,what it is,what it will be[J].World J Gastr Pharm Therap,2012,26(2):298 -304.
[5]张婉珠,梁斌鑫,王维.降糖药的研究现状及新进展[J].医药导报,2013,32(11):1455-1458.
[6]LOOMBA R,ABRAHAM M,UNALP A,et al.Association between diabetes,family history of diabetes and risk of nonalcoholic steatohepatitis and fibrosis[J].Hepatology,2012,56(3):943-951.
[7]徐沙丽,李中明,李哈妮,等.缬草提取物对胆汁酸代谢及肝损伤影响的实验研究[J].医药导报,2011,30(3):298-301.
[8]HUANG W,MA K,ZHANG J.Nuclear receptor-dependent bile acid signaling is required for normal liver regeneration[J].Science,2006,312(5771):233 -236.
[9]NILSSON L M,ABRAHAMSSON A,SAHLIN S,et al.Bile acids and lipoprotein metabolism:effects of cholestyramine and chenodeoxycholic acid on human hepatic mRNA expression[J].Biochem Biophys Res Cornmun,2007,357(3):707-711.
[10]WANG H H,PORTINCASA P,WANG D Q.Molecular pathophysiology and physical chemistry of cholesterol gallstones[J].Front Biosci,2008,1(13):401 - 423.
[11]WANG M.Efficacy of compound azintamide combined with itopride in treatment of chronic cardiac insufficiency patients with dyspepsia[J].Med J Chin Peop Armed Poli Forc,2012,23(6):499-501.
[12]具明玉,宋洪涛,刘茜.降血脂药物的药物基因组学研究进展[J].医药导报,2009,28(1):89-92.

