余甘多糖分离纯化及其分子结构的研究
许丽宾,郑凌君,卢 旭,郭 睿,郑宝东,曾绍校
(福建农林大学食品科学学院,福建福州350002)
余甘多糖分离纯化及其分子结构的研究
许丽宾,郑凌君,卢旭,郭睿,郑宝东,曾绍校*
(福建农林大学食品科学学院,福建福州350002)
分离纯化余甘多糖(PePs),并研究其理化性质和结构特征。采用热水浸提法提取余甘粗多糖,经DEAESephadex A-25柱层析分离得到两种不同多糖组分。综合运用硫酸-苯酚、硫酸-咔唑、碘-碘化钾等化学分析方法对多糖的理化性质进行分析;采用高效液相色谱法鉴定组分的均一性及其分子量(Mw),并用气相色谱法测定组分的单糖组成;利用紫外光谱、红外光谱、旋光度研究多糖组分的结构特征。结果表明:余甘粗多糖经纯化分级后得到两种均一的多糖组分:PePsⅠ和PePsⅡ。经鉴定,PePsⅠ为含有吡喃的中性还原糖,而PePsⅡ为含有糖醛酸的吡喃酸性还原糖;两者对热稳定,不溶于有机溶剂,不含蛋白质和氨基酸;比旋光度[α]D20分别为+68°、+108°;分子量分别为1.49×105、1.51×105u。PePsⅠ主要是由L-鼠李糖、L-阿拉伯糖、D-木糖等5种单糖构成;而PePsⅡ主要是由L-鼠李糖、L-阿拉伯糖、D-半乳糖3种单糖构成。
余甘,多糖,分离,结构,性质
余甘(Phyllanthus emblica L.)又称“油甘子”、“庵摩勒”,是大戟科(Euphorbiaceae)叶下珠属(Phyllanthus)植物[1],1998年被我国卫生部确定为药食两用植物。余甘主产于印度、马来西亚等热带国家
[2]以及我国的福建、海南、广东、广西、云南等地,目前在福建已成规模化栽培。研究表明,余甘多糖(PePs)具有抑菌[3]、抗氧化[4]和抗肿瘤[5]等生物活性,可抑制癌细胞生长,值得深入研究和开发应用。多糖的结构是决定多糖类物质生理活性的基础,对多糖化学结构的研究有助于了解结构与活性之间的关系。多糖结构的研究包括多糖的一级结构和高级结构的分析[6]。多糖一级结构,主要包括单糖组成及比例、分子量分布、单糖残基间顺序、环状结构类型和糖苷键构型等[7]。糖链的结构信息,对于了解多糖的生理性质和多糖类物质在生物体内重要的生物活性具有重要的理论意义。然而对余甘多糖的研究主要集中在其药理活性方面,对于多糖的组成、含量、结构等的研究甚少。且从自然界分离得到的余甘粗多糖是复杂的混合物,因此需要对其进行分离和纯化,得到分子量相对均一的组分,再进行进一步的结构分析。本文在余甘多糖提取[8]及抗氧化研究的基础上,对余甘多糖的分离纯化工艺、理化性质及结构进行研究,为进一步了解余甘多糖的构效关系提供必要的理论基础,以促进余甘多糖的这一宝贵资源的开发利用。
1 材料与方法
1.1材料与仪器
余甘鲜果于10月份采摘自福建惠安县紫山镇尾山山脉,品种:南大余甘;单糖标样上海博奥生物科技公司;肌醇六乙酸酯(内标)上海试剂厂;碘-碘化钾溶液、茚三酮溶液、95%乙醇、苯酚、硫酸、氯仿、异戊醇、丙酮、乙醚、盐酸羟胺、吡啶、醋酸酐、肌醇均为分析纯。
DEAE-SephadexA-25美国Sigma公司;AVATAR360型傅立叶红外光谱仪美国尼高力公司;DYY-Ⅲ型稳压稳流电泳仪北京六一厂;BSZ-160型自动部分收集器上海沪西仪器厂;UV-2000型紫外可见分光光度计尤尼柯(上海)仪器有限公司;TDL-5型低速台式大容量离心机上海安亭科学仪器厂;RE-52A型旋转蒸发器上海亚荣生化仪器厂;pHS-3C型精密pH计、Wzz-2B型自动旋光仪上海精密科学仪器有限公司;MDF-382E型超低温冰箱(-85℃) 日本三洋公司;DY 89-1型电动玻璃匀浆机宁波新芝生物科技股份有限公司;Waters2695型高效液相色谱仪、Waters2420型检测器、Ultrahydrogel Linear型水相GPC柱Waters公司。
1.2实验方法
1.2.1余甘多糖水提工艺流程余甘果经筛选、清洗等处理后,切取300g果肉研磨成浆,按料液比1∶20加入蒸馏水,100℃浸提4h,冷却后过100目筛得滤液,反复浸提2次,滤液合并,3000r/min离心10min,取上清液加入5倍量的95%乙醇,除去单糖、低聚糖和色素等物质,3000r/min离心15min,取沉淀用蒸馏水溶解,于60℃真空干燥至水分含量在10%左右,粉碎过100目筛即得粗多糖。称量后按照式(1)计算得粗多糖提取率。
式中:m1为余甘多糖粗品的质量(mg);m2为余甘果肉的质量(mg)。
1.2.2余甘多糖的分离纯化准确称取余甘粗多糖1.0g,配成20mg/mL的水溶液,5000r/min离心,弃去沉淀,上清液用Sevage法[9](氯仿∶正丁醇=5∶1)去除游离蛋白质,重复操作4次,离心10min,上清液用蒸馏水透析48h,60℃减压浓缩得余甘多糖半纯品。半纯品经DEAE-Sephadex A-25柱层析纯化,0.1~1.0mol/L NaCl梯度洗脱,苯酚-硫酸法[10]跟踪检测,490nm处测定吸光度值,以洗脱管数为横坐标,吸光度值为纵坐标作图,收集含糖组分,旋蒸浓缩,透析脱盐,冷冻干燥得两个纯组分PePsⅠ、PePsⅡ(水分含量约为10%)。称量后按式(2)计算余甘多糖纯品的提取率。

式中:m1为余甘多糖粗品的质量(mg);m3为余甘多糖纯品的质量(mg)。
1.2.3余甘多糖纯度鉴定在纸层析预实验的基础上,采用聚丙烯酰胺凝胶电泳(PAGE)[11],分离胶浓度10%,浓缩胶浓度3%,电泳缓冲液为0.0125mol/L硼砂-硼酸缓冲液(pH9.0),电压100~150V,电泳3h,高碘酸Schiff试剂染色,1%偏重亚硫酸钠-0.1mol/L于HCl中保存。
1.2.4余甘多糖理化性质的测定
1.2.4.1蛋白质含量和多糖含量的测定采用CBBG250色素结合法[10]测定蛋白质含量;采用硫酸-苯酚比色法测定多糖含量,以葡萄糖为标样,校正系数0.9,用硫酸-咔唑法[12]测定糖醛酸含量,以半乳糖醛酸为标样。
1.2.4.2颜色反应a.碘-碘化钾反应:配成1mg/mL溶液,加入碘-碘化钾试剂(含0.02%I2的0.2%KI溶液),观察其颜色变化。
b.费林试剂反应:取费林试剂A(50μL浓硫酸和3.45g硫酸铜,用蒸馏水定容于500mL的容量瓶)和B(6.85g酒石酸钠钾和6.25g氢氧化钠,用蒸馏水定容于25mL的容量瓶)各0.25mL混匀,分别加入余甘多糖溶液数滴,沸水浴加热2~3min,观察其颜色变化。
c.茚三酮反应:取10mL试管,加入余甘多糖溶液1mL,加入茚三酮溶液10滴,将试管放入沸水中加热10min,观察现象,有蓝紫色化合物生成为阳性反应。
1.2.4.3余甘多糖的热稳定性测定分别称取PePsⅠ、Ⅱ样品各5份,每份20mg,加沸蒸馏水1mL溶解后,分别置室温、40、60、80、100℃烘干,观察其颜色变化,随后分别用10mL蒸馏水溶解、离心后取上清液透析后定容至10mL,用硫酸-苯酚法测其含量,设定室温条件下样品含量为100%,其他样品以相对含量表示。
1.2.5余甘多糖结构性质研究
1.2.5.1余甘多糖的光谱性质a.紫外光谱性质(UV):将样品配成0.1%水溶液,用紫外可见分光光度计在190~400nm区间进行扫描。
b.红外光谱性质(IR):采用KBr压片法制样;检测器分辨率:4cm-1;扫描次数:64;测试范围:4000~400cm-1。称取1mg干燥的多糖样品与在红外干燥箱中干燥的溴化钾(KBr)粉末,在玛瑙研钵中充分研磨,用压片机压成薄片进行红外光谱扫描;不添加多糖的KBr薄片作为背景扫描。
1.2.5.2余甘多糖的比旋光度测定准确称取PePsⅠ和PePsⅡ样品各5mg,定容于10mL容量瓶中待测。计算公式为l为旋光管的长度,dm;ρB为质量浓度(100mL溶液中所含样品的质量),g;t为测定时的温度,℃;λ为光源的光波长,nm;α为旋光度的测定值;[α]为比旋光度。
1.2.5.3余甘多糖分子量(Mw)的测定采用高效液相色谱(HPLC)分析。色谱柱为Ultrahydrogel Linear,RID-5A示差折射检测器检测,流动相为蒸馏水,流速为1.0mL/min,进样量为25μL,样品浓度为5mg/mL。
1.2.5.4余甘多糖的单糖组分分析a.气相色谱分析:将上述水解过的样品及标准单糖制备成糖腈乙酸酯衍生物后进行气相色谱分析。糖腈乙酸酯衍生物制备方法参照Qiao等[13]的方法。气相色谱条件为:FID,石英毛细管柱30m×0.25mm×0.25mm。固定液为SE-54,高纯氮气作为载气,总流速为77mL/min,分流比为1∶76,氢气流速为10mL/min。柱温箱温度190℃,汽化室280℃,氢焰280℃。程序升温起始温度190℃,以5℃/min升至215℃,保持2min,再以1℃/min升至240℃,保持1min。对照样品与标准品的出峰位置判断多糖组成。
b.组成单糖摩尔比值测定:内标物为肌朜六乙酸酯,先测定L-鼠李糖、D-葡萄糖、L-阿拉伯糖、D-木糖、D-甘露糖和D-半乳糖等6种标准单糖衍生物的出峰时间,并按公式(m代表单糖质量,A代表峰面积)求出上述6个单糖衍生物的校正因子f。样品的摩尔比测定条件与校正因子相同。将得到各单糖的峰面积与内标的峰面积比,乘以f/M(M代表各个单糖的分子量),即为各单糖摩尔比。
2 结果与分析
2.1余甘多糖的分离纯化及纯度鉴定
DEAE-Sephadex A-25柱层析结果如图1所示。

图1 余甘多糖的DEAE-Sephadex A-25洗脱曲线Fig.1 Elution curve of P.emblica L.polysaccharide by DEAE-Sephadex A-25
余甘多糖半纯品经DEAE-Sephadex A-25层析柱纯化,洗脱得到两种不同分子量分布的多糖:PePsⅠ和PePsⅡ。洗脱曲线为单一对称峰,无明显拖尾,且呈高斯分布,分离效果较佳,样品较纯。经聚丙烯酰胺凝胶电泳,高碘酸-Schiff试剂染色显示出单一条带,表明纯化后的PePsⅠ和PePsⅡ是相对均匀的纯多糖。
2.2余甘多糖纯化组分的理化性质分析
热水浸提得到余甘粗多糖的提取率为1.18%(相对于余甘果肉),再经DEAE-Sephadex A-25柱进一步层析纯化的多糖纯组分得率为28.15%。蛋白质和多糖的测定实验表明,PePsⅠ和PePsⅡ中都不含蛋白质,总糖含量分别为65.73%和68.55%;PePsⅠ不含糖醛酸,属中性多糖,而PePsⅡ含有54.91%糖醛酸,是酸性多糖。经测定,PePsⅠ、PePsⅡ的旋光度分别为0.034、0.054,比旋光度分别为+68°、+108°。此外,由于大分子物质的比旋光度是由单体的不对称性和大分子整体的空间不对称性决定的[16],而PePsⅡ具有较大的比旋光度,说明其整体不对称性较显著。
PePsⅠ和PePsⅡ经不同温度(40、60、80、100℃)烘干后,形态(白色丝状)与室温干燥相似,含糖量无显著变化(数据未给出),表明了PePsⅠ和PePsⅡ的热稳定性好;二者均不溶于乙醇、丙酮和乙醚等有机溶剂,但可溶于水,尤其易溶于热水;PePsⅠ和PePsⅡ水溶液为透明粘状液体,pH分别为6.94和6.87。PePsⅠ和PePsⅡ经化学鉴定结果如下:这两种多糖纯品分别与苯酚-硫酸反应溶液显橙黄色、与费林试剂反应溶液呈砖红色(阳性),说明PePsⅠ和PePsⅡ均属于还原性糖类物质;与硫酸-咔唑反应分别呈阴性和阳性(紫红色),表明PePsⅠ不含糖醛酸,而PePsⅡ含有糖醛酸;与茚三酮反应溶液未呈蓝紫色,说明两者的结构中不含氨基酸;与碘-碘化钾反应溶液未变成蓝色,说明这两种成分不含淀粉。

图2 PePsⅠ和PePsⅡ的紫外扫描光谱Fig.2 The UV spectra of PePsⅠand PePsⅡ
2.3余甘多糖组成与结构的研究
2.3.1余甘多糖的组成图2是PePsⅠ、PePsⅡ水溶液在190~400nm的紫外光谱扫描图谱。紫外光谱分析表明,PePsⅠ和PePsⅡ在紫外扫描范围内均无明显的特征性吸收峰,说明PePsⅠ、PePsⅡ基本不含有蛋白质和核酸。紫外扫描的结果与2.2理化性质的分析结果一致,进一步验证了余甘多糖分离纯化的纯度较高。同时也表明了DEAE-Sephadex A-25层析柱起到了很好的分离作用,有效地去除了残留的蛋白质和核酸等杂质。
2.3.2余甘多糖红外光谱分析红外光谱是研究多糖类物质化学结构的有效途径,可根据吸收峰位置推测多糖的特征基团和糖苷键连接类型[14]。因此红外光谱分析将进一步确定余甘多糖结构的信息。

图3 PePsⅠ和PePsⅡ的红外光谱图(IR)Fig.3 IR Spectrum of PePsⅠand PePsⅡ
图3是PePsⅠ、PePsⅡ的红外吸收光谱图,其结构特征如表1。由图3可知,两种样品在4000~400cm-1区域具有多糖类物质的一般特征,其特征吸收峰分别是3449、2927、1632、1384、1064cm-1和3448、2932、1746、1629、1239、1077cm-1。图3中3600~3200cm-1(3449、3448cm-1)处的吸收峰是由-OH基官能团产生的,峰形尖锐;3000~2800cm-1(2927、2932cm-1)处有中等的糖类C-H伸缩振动吸收峰;1650~1600cm-1(1632cm-1)处有较强的酰氨基C=O特征吸收峰;这几组峰说明样品有糖醛的存在,可初步判断该物质是糖类化合物。1750cm-1附近的吸收峰是糖醛酸的C=O键引起的,1384cm-1的吸收峰代表了C-H键的变角振动,1239cm-1代表-COOH中O-H变角振动。1200~950cm-1附近的吸收峰是由C-O-H和C-O-C的两种C-O键伸缩振动引起,由此说明多糖的结构中含有酸性羧基基团。1063、1073cm-1的强吸收峰证明其中的单糖以吡喃的形式存在[15]。根据红外光谱分析结果,初步鉴定PePsⅠ是含有吡喃的多糖,PePsⅡ是含有糖醛酸的吡喃酸性多糖。
2.3.3余甘多糖的分子量测定多糖分子量是研究多糖生理活性的一个重要的参数,其性质往往跟它的分子量大小有关。一般地,多糖分子量的数量级范围在104~106,属中等分子物质。

表1 PePsⅠ和PePsⅡ的红外光谱图分析Tabel 1 Analysis of IR spectrum of PePsⅠand PePsⅡ
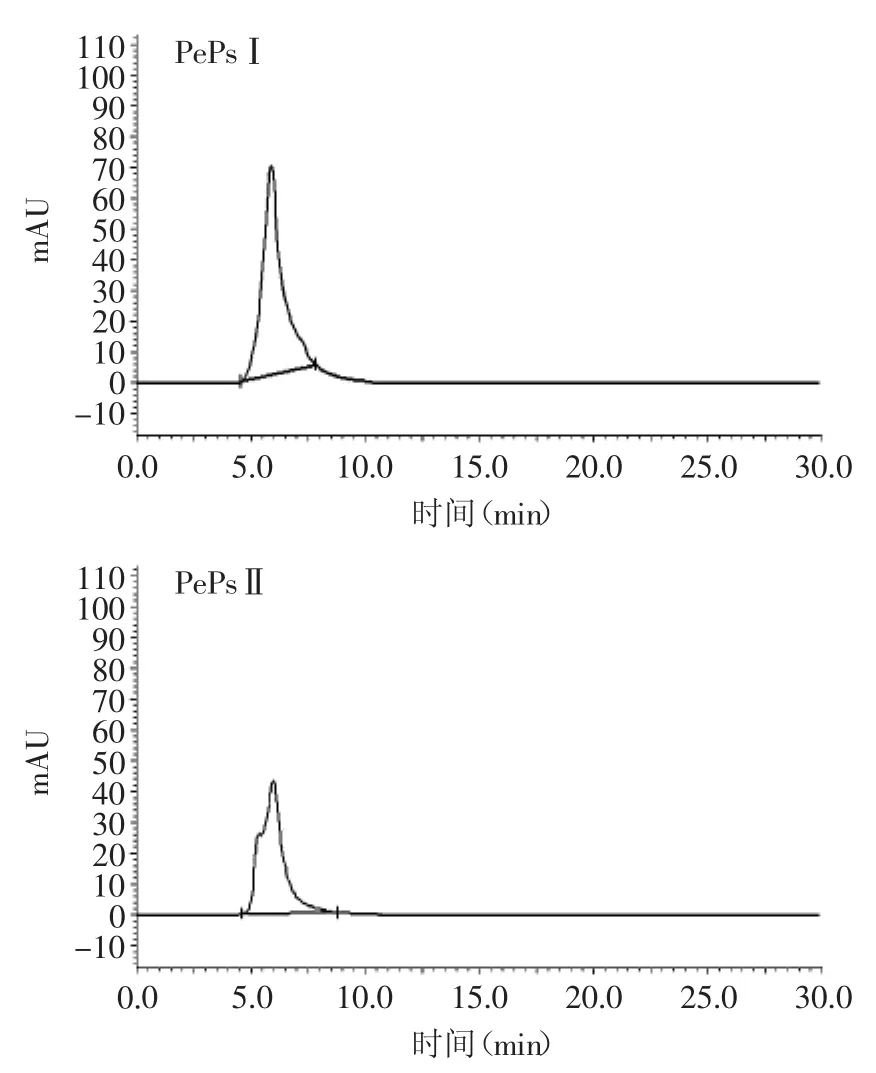
图4 PePsⅠ和PePsⅡ相对分子量的测定Fig.4 The relative molecular weight of PePsⅠand PePsⅡ
由图4可以看出,PePsⅠ和PePsⅡ两个组分经高效液相色谱检测,仅出现单一的、相对对称的洗脱峰,表明余甘粗多糖经分离以后所得到的2个组分均为相对均一的多糖组分[17-18],具有较高的纯度。
以标准葡聚糖分子量和对应的出峰时间为对照,采用归一法计算浓度,定量峰面积。选择分子量(Mw)范围与样品接近的葡聚糖标准品(分子量为5800、9600、15000、27000、40000、65000、130000、300000、500000、600000u)作标准曲线,得到线性回归方程y=-0.0634x+5.5584(R2=0.9945),式中:y为余甘多糖分子量(Mw)的对数值,x为余甘多糖的保留时间(min)。通过测定余甘多糖在色谱柱的保留时间,再根据标准曲线求换算样品的分子量。结果见表2、表3。由此可知,PePsⅠ和PePsⅡ两个组分的保留时间分别为6.073、5.971min;通过线性回归方程计算,得到PePsⅠ和PePsⅡ的分子量分别为1.49×105、1.51×105u。两者的分散系数(Mw/Mn)均小于1,属于窄分布宽度样品,且PePsⅡ的分子量分布比PePsⅠ更广些。

表2 标准葡聚糖分子量和对应出峰时间Table 2 The distribution map of samples dextran molecular weight

表3 样品的分子量和对应的出峰时间Table 3 The distribution map of samples molecular weight
2.3.4余甘多糖的单糖组分分析采用糖睛乙酸酯衍生法,对单糖标准品和余甘多糖全水解后的样品进行衍生化处理,通过GC测定多糖样品的单糖组成,气相色谱图如图5所示。由于样品中的糖醛酸不能衍生,故不能被气相色谱检出,糖醛酸未出峰,因此可结合咔唑法所测糖醛酸的含量来比较。
将PePsⅠ与PePsⅡ的气相色谱图与单糖标样的气相色谱图比较可知,PePsⅠ主要是由L-鼠李糖、L-阿拉伯糖、D-木糖、D-葡萄糖、D-半乳糖5种单糖构成;PePsⅡ主要是由L-鼠李糖、L-阿拉伯糖、D-半乳糖3种单糖构成。
表4反映了各个单糖标准品的出峰时间以及PePsⅠ、PePsⅡ两物质中含有的单糖的出峰情况。与标准单糖的图谱进行对比,可初步判断PePsⅠ、PePsⅡ中的单糖组成。
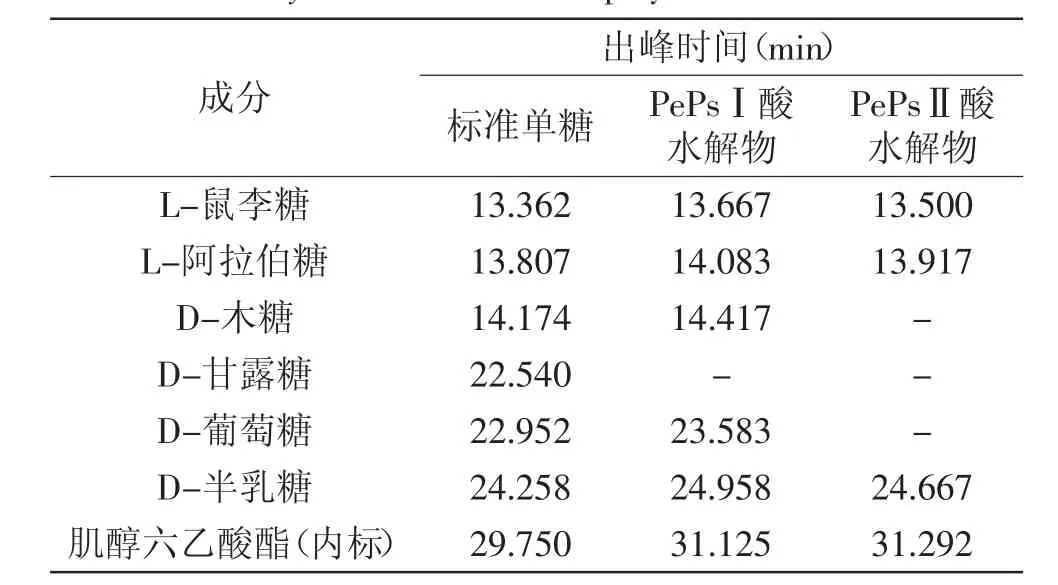
表4 标准单糖以及PePsⅠ和PePsⅡ降解的糖腈乙酸酯衍生物GC结果Table 4 The GC analysis of monosaccharide components of Phyllanthus emblica L.polysaccharide
由表4可见,由于内标有所漂移,因此样品的出峰时间随着漂移是正常的。GC的结果表明PePsⅠ由5种单糖组成,PePsⅡ由3种单糖组成。
2.3.5单糖组成分析表5、表6是PePsⅠ、PePsⅡ经水解后各单糖糖腈乙酸酯衍生化后的气相色谱分析结果。根据相应单糖标准样品的相对保留时间进行定性,以面积归一化法计算各种单糖的含量占样品中总糖量的百分比来定量,峰面积之比=质量比。
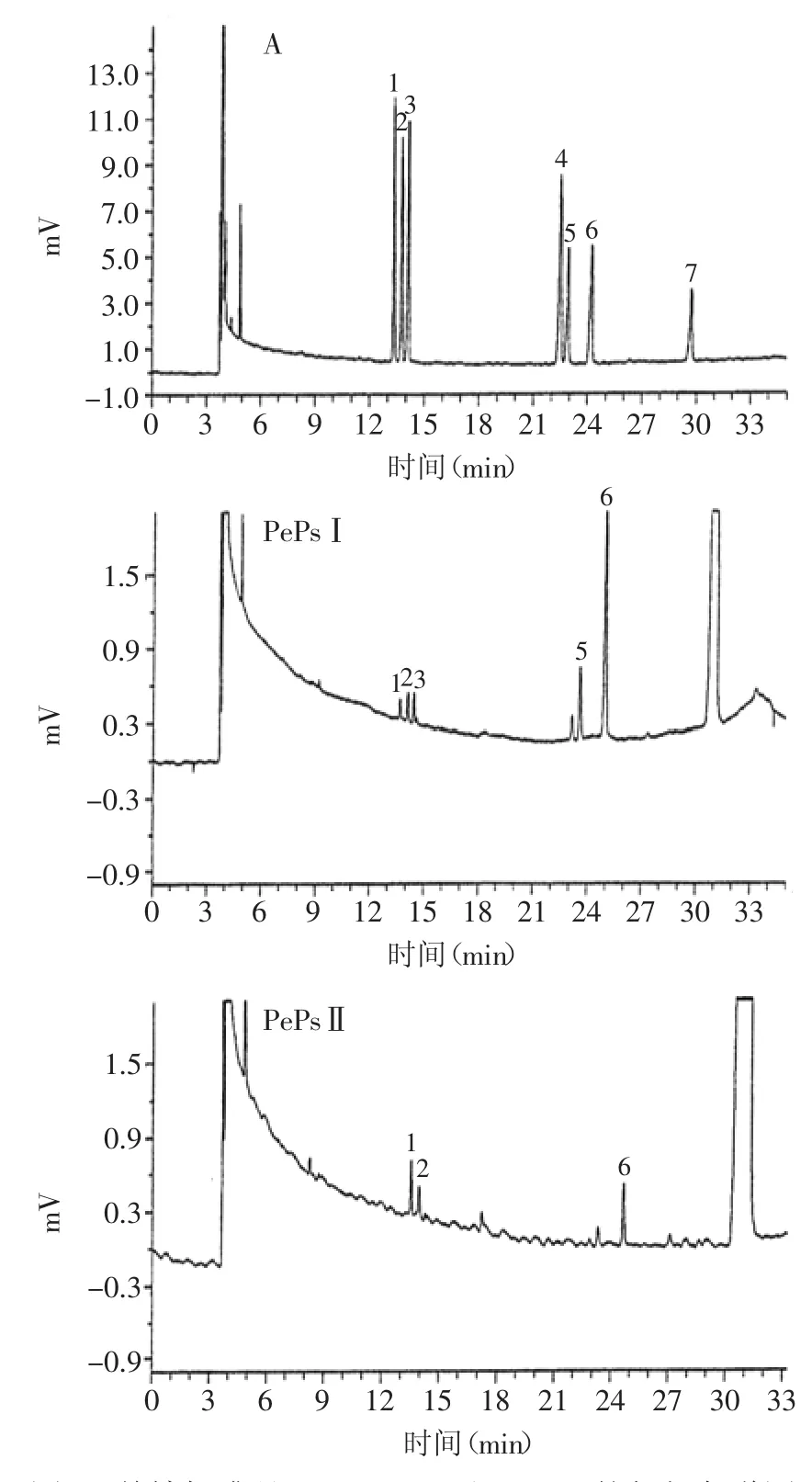
图5 单糖标准品(A)、PePsⅠ和PePsⅡ的气相色谱图Fig.5 The GC chromatography of standard monosaccharide(A),PePsⅠand PePsⅡ

表5 PePsⅠ的单糖组成Table 5 Monosaccharide composition of PePsⅠ
由表5可见,以木糖的物质的量为1,相对摩尔比为n鼠∶n阿∶n木∶n葡∶n半=11.535∶16.349∶1.0∶9.525∶61.63,这5种单糖含量相差较大,半乳糖的含量最高。
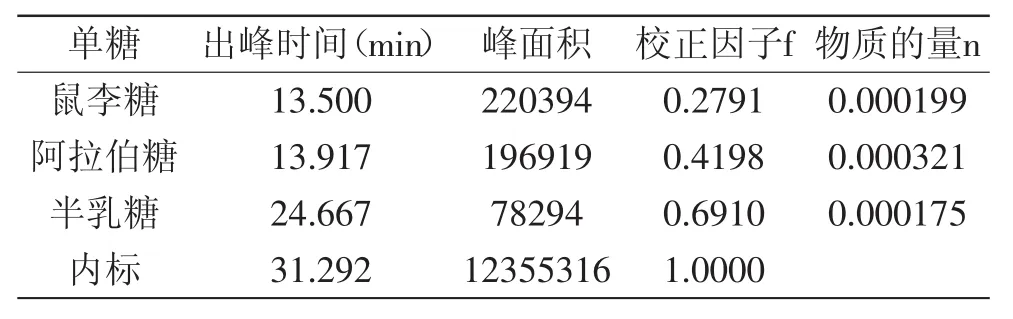
表6 PePsⅡ的单糖组成Table 6 Monosaccharide composition of PePs-Ⅱ
由表6可见,以半乳糖的物质的量为1,相对摩尔比为n鼠∶n阿∶n半=1.137∶1.867∶1.0,这三种单糖的含量比较接近。
3 结论与讨论
采用DEAE-Sephadex A-25柱层析分离纯化余甘粗多糖得到PePsⅠ和PePsⅡ两个不同组分。经理化性质测定,两者对热稳定,不溶于有机溶剂,不含蛋白质和氨基酸;PePsⅠ是含糖量为65.73%的中性多糖;PePsⅡ属酸性多糖,含糖量为68.55%、糖醛酸含量为54.91%。由纯度鉴定可知,PePsⅠ和PePsⅡ是均匀的纯多糖。HPLC测定得到PePsⅠ和PePsⅡ分子量分别为1.49×105、1.51×105u。余甘多糖酸水解物经HPLC和GC测定结果表明:PePsⅠ主要是由L-鼠李糖、L-阿拉伯糖、D-木糖、D-葡萄糖、D-半乳糖5种单糖构成,摩尔比为n鼠∶n阿∶n木∶n葡∶n半=11.535∶16.349∶1.0∶9.525∶61.63;PePsⅡ主要由L-鼠李糖、L-阿拉伯糖、D-半乳糖3种单糖构成,摩尔比为:n鼠∶n阿∶n半=1.137∶1.867∶1.0。
PePsⅠ和PePsⅡ中的总糖含量低于70%,测量结果偏低,可能是由于多糖中存留着少量的色素和灰分等引起的,导致测定结果无法反应多糖的真实含量。苯酚硫酸法最大吸收波长在480~490nm范围内,但在实际应用时会因水解出的单糖种类、比例的不同而出现偏差,如PePsⅠ和PePsⅡ属杂多糖,苯酚硫酸法测定是以葡萄糖为标准对照品,而各单糖的显色灵敏度不同,且葡萄糖的显色较强,这就会造成多糖含量测定的误差。因此,可对苯酚-硫酸法测定余甘多糖含量作进一步研究,先用GC测定多糖的组分及相对比例,再按各糖的比例作出标准曲线,这样可较好的减小测定误差。
[1]AnilakumarK,NagarajN,SanthanamK.Reduction ofhexachlorocyclohexane-induced oxidative stress and cytotoxicity in rat liver by Emblica officinalisgaertn[J].Indian journal of experimental biology,2007,45(5):450.
[2]王辉.余甘子的化学成分和药理作用研究进展[J].中国现代中药,2011,13(11):52-56.
[3]Dhale D,Mogle U.Phytochemical screening and antibacterial activity of Phyllanthus emblica(L.)[J].Sci Res Report,2011,1(3):138-142.
[4]Liu X,Cui C,Zhao M,et al.Identification of phenolics in the fruit of emblica(Phyllanthus emblica L.)and their antioxidant activities[J].Food Chemistry,2008,109(4):909-915.
[5]Sultana S,Ahmed S,Jahangir T.Emblica officinalis andhepatocarcinogenesis:A chemopreventive study in Wistar rats[J].Journal of ethnopharmacology,2008,118(1):1-6.
[6]Sun Y,Wang S,Li T,et al.Purification,structure and immunobiological activity of a new water-soluble polysaccharide from the mycelium of Polyporus albicans(Imaz.) Teng[J]. Bioresource technology,2008,99(4):900-904.
[7]谢明勇,聂少平.天然产物活性多糖结构与功能研究进展[J].中国食品学报,2010,10(2):1-11.
[8]郑宝东,曾绍校.福建余甘可溶性多糖提取工艺研究[J].中国食品学报,2003,3(1):37-40.
[9]Wang X,Yuan Y,Wang K,et al.Deproteinization ofgellangum produced by Sphingomonas paucimobilis ATCC 31461[J].Journal of biotechnology,2007,128(2):403-407.
[10]胡建.牛蒡多糖的提取纯化及其抗氧化性研究[D].扬州:扬州大学,2011.
[11]Weitzhandler M,Kadlecek D,Avdalovic N,et al. Monosaccharideandoligosaccharideanalysisofproteins transferred to polyvinylidene fluoride membranes after sodium dodecyl sulfate-polyacrylamidegel electrophoresis[J].Journal of Biological Chemistry,1993,268(7):5121-5130.
[12]杨明康.肝素前体多糖的分离纯化研究[D].杭州:浙江工业大学,2013.
[13]Qiao D,hu B,gan D,et al.Extraction optimized by using responsesurfacemethodology,purificationandpreliminary characterization of polysaccharides fromhyriopsis cumingii[J]. Carbohydrate Polymers,2009,76(3):422-429.
[14]Kacurakova M,Capek P,Sasinkova V,et al.FT-IR study of plantcellwallmodelcompounds:pecticpolysaccharides andhemicelluloses[J].Carbohydrate Polymers,2000,43(2):195-203.
[15]Cai W,gu X,Tang J.Extraction,purification,and characterization of the polysaccharides from Opuntia milpa alta[J].Carbohydrate Polymers,2008,71(3):403-410.
[16]Di X,Chan K K,Leungh W,et al.Fingerprint profiling of acidhydrolyzates of polysaccharides extracted from the fruiting bodies and spores of Lingzhi byhigh-performance thin-layer chromatography[J].Journal of Chromatography A,2003,1018(1):85-95.
[17]甘聃.鼎湖鳞伞菌丝体多糖的发酵条件优化、分离纯化、抗肿瘤活性及其机制的研究[D].南京:南京农业大学,2012.
[18]戴艳.骏枣多糖的提取纯化、结构分析及抗氧化活性研究[D].武汉:华中农业大学,2013.
Study on the separation,purification and molecular structure characterization of Phyllanthus emblica L.polysaccharide
XU Li-bin,ZHENG Ling-jun,LU Xu,GUO Rui,ZHENG Bao-dong,ZENG Shao-xiao*
(College of Food Science,Fujian Agriculture and Forestry University,Fuzhou 350002,China)
The refined polysaccharide fractions were conducted from Phyllanthus emblica L.,then characterized their physiochemical and structural properties.The P.emblica polysaccharide was extracted with hot water,purified sequentially by DEAE-Sephadex A-25 column chromatography then obtained two different polysaccharides.With analyzed for physical and chemical properties by chemical analysis,such as sulphuric acid-phenol,sulphuric acid-carbazole,I-KI.Homogeneity and relative molecular weights(Mw)tested by high performance liquid chromatography(HPLC)and monosaccharide composition which was determined by gas chromatography.Structural characterizations were carried out by ultraviolet spectroscopy and infrared spectroscopy(FT-IR).The result showed that the fractional purification included PePsⅠand PePsⅡ.PePsⅠwas neutral sugar with pyran,then PePsⅡ was pyran acidic polysaccharide containing uronic acid.Both of them were heat-stable,insoluble in organic solvents and free of proteins and amino acids.The specific rotation of PePsⅠand PePsⅡ were+68°and+108°,relative molecular mass were 1.49×105u and 1.51×105u,respectively.PePsⅠwere constituted mainly by five monosaccharide residues,including L-rhamnose,L-arabinose,D-xylose,then PePsⅡwere constituted mainly by three monosaccharide residues,such as L-rhamnose,L-arabinose,D-galactose.
Phyllanthus emblica L.;polysaccharide;separation;structure;properties
TS201.1
A
1002-0306(2015)12-0127-06
10.13386/j.issn1002-0306.2015.12.018
2014-09-10
许丽宾(1988-),女,硕士研究生,研究方向:农产品加工及贮藏工程。
曾绍校(1980-),男,博士,副教授,研究方向:淀粉化学及天然产物活性。
福建省高等学校科技创新团队支持计划(闽教科[2012]03号);福建农林大学科技创新团队支持计划(cxtd12009)。

