应用主成分和判别分析的红外光谱法快速鉴别酸败植物油
周 俊,张 军,*,谢梦圆,陈 哲,汪 勇,关贺元
(1.光电信息与传感技术广东普通高校重点实验室(暨南大学),广东广州510632;2.暨南大学光电工程系,广东广州510632;3.暨南大学食品科学与工程系,广东广州510632)
应用主成分和判别分析的红外光谱法快速鉴别酸败植物油
周俊1,2,张军1,2,*,谢梦圆1,2,陈哲1,2,汪勇3,关贺元1,2
(1.光电信息与传感技术广东普通高校重点实验室(暨南大学),广东广州510632;2.暨南大学光电工程系,广东广州510632;3.暨南大学食品科学与工程系,广东广州510632)
通过收集并分析40个合格植物油和44个酸败植物油的傅里叶变换红外光谱,选取25个合格植物油和39个酸败植物油组成训练集,利用主成分分析获得累积可信度95%的三个主成分及对应的1743~1710cm-1、1172~1130cm-1、2945~2844cm-1、1728~1689cm-1、2987~2840cm-1和1731~1660cm-1对植物油酸败最为敏感的光谱波数范围。在主成分分析的基础上,选取对植物油酸败敏感的波段,利用训练集建立鉴别植物油酸败判别分析模型。采用验证集20个样品验证判别分析模型,判别正确率达100%。主成分结合判别分析的红外光谱法能快速、准确、无损地区分合格植物油和酸败植物油。
植物油酸败鉴别,主成分分析,判别分析,傅里叶变换红外光谱
食用油脂是人体三大营养源之一,其品质与人们健康密切相关,是人们生活中的必需品之一。当前由食用植物油引发的食品安全事件长期困扰着生产和监管部门,并由此引发消费者恐慌,严重影响了人们的正常生活。对于食用植物油安全问题,主要注意力都集中到地沟油、潲水油、工业油脂、煎炸油违规用于食品加工行业方面[1-2]。事实上,合格食用植物油在储藏时,同样存在很大的安全隐患且没有引起足够的重视。植物油在存放过程中,经常受到光、热、空气中的氧以及油脂中的水分和酶的作用,发生各种复杂的变化,这种变化通常称之为酸败[3]。研究证明,摄入这种酸败的食用油对身体有极大的危害,甚至有可能诱发癌症、心血管等疾病[4-5]。以前对于植物油酸败的研究重点都放在预防和形成原因研究上,如董文丽、李德溥[6]研究了包装对松仁油脂氧化酸败的抑制效果,侯景芳、李桂霞等[7]对油脂酸败及储存进行了研究。已有植物油酸败的检测方法主要是高效液相色谱(HPLC)、气相色谱-质谱联用仪(GC/MS)等组分分析及对植物油的色泽、酸价、烟点、过氧化值等理化指标进行检测[8],如黄西文[9]对食用油脂的酸败指标进行了研究。
这些检测酸败植物油的方法较为复杂,对操作人员的要求较高,且检测周期较长。傅里叶变换红外光谱(FTIR)具有采集简单、快速,无需对样品进行预处理的特点。对于植物油的FTIR谱图,其谱峰的峰位、峰形和峰高就是油脂中各种成分的不同基团谱峰叠加的结果,当植物油的成分发生变化时,就会引起植物油的FTIR谱图变化[10]。王美美等[11-12]已经证明了红外光谱法在定性分析、分类与判断不同油脂种类时的有效性。
另外在光谱分析采用的方法中,主成分分析在不丢失主要光谱信息的前提下,选择为数较少的新变量来代替原来的变量,解决了由于谱带的重叠而无法分析的困难;判别分析法是判别距离,通过计算样品向量间的马氏距离值,判别样品的类别归属[13]。Tay A[14]研究了利用判别分析法来对橄榄油中是否掺入廉价植物油进行鉴别,Aderval S Luna[15]研究了利用主成分分析来对不同种类的植物油进行区分。
因此本文针对植物油的FTIR光谱,首先应用主成分分析方法对植物油是否酸败进行聚类并取得主成分数,同时确定酸败植物油的敏感波段,然后将植物油敏感波段的FTIR输入到判别分析模型中,最后通过验证集验证该模型的准确度,从而探讨将主成分分析方法和判别分析法相结合的FTIR用于植物油酸败快速鉴别的正确率。
1 材料与方法
1.1材料与仪器
不同品牌与种类的合格植物油样品共40个,购自广州华润万家超市,包括大豆油、花生油、玉米油、葵花籽油,调和油等植物油样品,以及本校食品科学与工程系实验室提供的酸败植物油样品44个。
VERTEX 70 Bruker傅里叶变换红外光谱仪德国布鲁克光谱仪器公司,衰减全反射(Attenuated Total Reflection,ATR)附件,DTGS探测器;100~1000μL可调式移液器。
1.2实验方法
采集样品光谱前,将光谱仪预热约1h,并进行仪器性能测试,通过后再进行光谱采集。实验在室温(20℃)条件下进行,采集每个样品的光谱之前,均先测量背景光谱,扣除空气中水和二氧化碳的干扰。使用可调式移液器吸取50μL样品滴到ATR附件表面(ZnSe晶体),开始采集样品光谱数据。检测所使用的红外光谱条件为[16]:扫描范围为4000~550cm-1,分辨率为4cm-1,扫描次数为16。
1.3数据处理
采用Ominc、Unscrambler和TQ Analyst软件分析处理数据,包括分析所有样品的FTIR谱图。分别选取25个合格植物油、39个酸败植物油,用主成分分析法对这些样本进行聚类;经过主成分分析后,获取对植物油酸败敏感的波段,同时获取主成分个数;选取上述64个样品组成训练集(其余20个样品组成验证集),利用已经获取的主成分建立鉴别植物油酸败判别分析模型,依据由主成分分析得到对植物油脂酸败程度最为敏感的波段来优化判别分析模型。
2 结果与讨论
2.1合格植物油和酸败植物油FTIR谱图分析
油脂均为不同脂肪酸甘油三酯的混合物,所以合格植物油和酸败植物油的主要分子结构与官能团基本相同[17]。图1是部分合格油和酸败油的FTIR光谱图,在FTIR谱图上表现出来的就是两者具有类似的峰位、峰型和峰强。各谱峰对应的分子结构和官能团信息为:在3009、2923、2853cm-1处为C-H伸缩振动峰,2500~1600cm-1区域的强吸收峰是酯键羰基基团(C=O)的振和动峰;如果油脂发生氧化水解,会产生醛酮和游离脂肪酸中羰基基团(C=O)的吸收峰;1743cm-1处为C=O伸缩振动峰,1654cm-1处为C=C伸缩振动峰,1462cm-1和1377cm-1处为亚甲基的弯曲振动峰,1236、1120、1160、1098cm-1处甘油三酯C-O伸缩振动峰,以及721cm-1处是碳链骨架振动峰等[18]。
从图1可以观察到,在4000~3100cm-1波数范围,酸败植物油和合格植物油的吸收强度都很小,且两者的光谱差别不大。仔细观察,在1710cm-1附近,可以在酸败植物油谱图上观察到一个特殊的吸收峰;而在合格植物油样品的光谱中,在相同位置并没有观察到吸收峰的存在。分析这个吸收峰形成的原因可能是:平时在使用植物油后,把植物油长时间放置在高温环境下,导致植物油和氧、水分以及微生物等作用,在酯键处发生水解、氧化和缩合等一系列反应[19],从而生成食用植物油原本不含的醛、酮类等物质。由于醛、酮不受氧原子吸引电子诱导效应的影响,羰基峰会向低波数方向位移[20],因此部分酸败植物油在会1710cm-1出现特征吸收峰。

图1 部分合格植物油和酸败植物油的红外光谱Fig.1 FTIR of partial qualified edible oil and rancid edible oil
2.2主成分分析
经过对64个训练集样本进行主成分分析,获得主成分的累积可信度分别为:68%、85%和95%;因为三个主成分的累积可信度已经达到了95%,所以选用主成分个数为3。图2是三个主成分聚类的得分图,图2(a)横坐标表示每个样本的第一主成分得分值,纵坐标表示每个样本的第二主成分得分值。图2(a)显示利用第一主成分和第二主成分进行聚类,合格植物油和酸败植物油可以分成两类;酸败植物油大部分位于第一象限,合格植物油基本位于第三象限;但是有3个酸败植物油在第三象限,与合格植物油混在一起,同时有一个合格植物油聚类位置恰好位于PC2轴上,这很容易使该样品被误判为不合格油。图2(b)横坐标表示每个样本的第三主成分得分值,纵坐标表示每个样本的第一主成分得分值。图2(b)显示利用第一主成分和第三主成分进行聚类,合格植物油和酸败植物油基本上无法区分。图2(c)横坐标表示每个样本的第三主成分得分值,纵坐标表示每个样本的第二主成分得分值。图2(c)显示利用第二主成分和第三主成分进行聚类,合格植物油和酸败植物油也完全不能区分。由此可见,主成分分析方法不能很好的区分合格植物油和酸败植物油,存在误判现象。

图2 主成分分析得分图Fig.2 PCA scores plot
图3是主成分1、2、3在整个波长范围的载荷图。图3中横坐标表示波数范围4000~550cm-1,纵坐标表示各波长对主成分的载荷值,即是各个波长变量与主成分的相关性大小。从图3可以看出主成分1、2、3与全波长变量的相关程度。主成分1与1743~1710cm-1和1172~1130cm-1光谱范围的相关性最强;主成分2与2945~2844cm-1和1728~1689cm-1光谱范围的相关性最强;主成分3与波数2987~2840cm-1和1731~1660cm-1光谱范围的相关性最强;由于主成分1、2、3的累计可信度已经达到95%,即主成分1、2、3几乎能解释所有原变量,与它们有很高相关度的波数范围1743~1710cm-1、1172~1130cm-1、2945~2844cm-1、1728~1689cm-1、2987~2840cm-1和1731~1660cm-1是对植物油脂酸败程度最为敏感的光谱波段范围。

图3 主成分1、2和3在全光谱范围内的载荷值Fig.3 Loading value of principal component 1,2 and 3 on whole spectrum range
2.3基于植物油酸败敏感波段建立判别分析模型
由于单独用主成分分析法对酸败植物油进行鉴别时,有3个酸败植物油混杂在合格植物油的类别中,被误判成合格植物油;而且考虑到每个样品FTIR谱图从4000~550cm-1共有1788个数据点,如果采用全光谱来进行分类计算,从统计分析的角度讲,自变量数目远大于因变量数目,计算结果的可靠性及模型的稳定性都不好。另外有些光谱区域,例如4000~3100cm-1光谱波段范围的吸光度小于0.02,与样品的组成或性质缺乏相关性。所以本文在主成分分析的基础上,选取三个主成分以及对植物油酸败程度敏感的波段作为输入建立了判别分析预测模型。
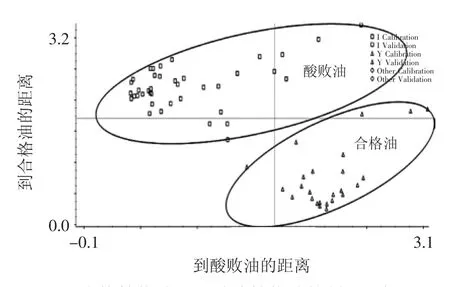
图4 合格植物油脂和酸败植物油的判别分析图Fig.4 Discriminate analysis figure of qualified edible oil and rancid edible oil
图4是训练集合格植物油脂和酸败植物油的判别分析图,通过判别分析图可以直观的看到分类结果。从图4可以看到,判别分析模型进行交叉检验时,没有出现误判的情况。用验证集的20个样品对判别分析模型进行检验,同样没有出现误判的情形,最终模型的准确率为100%。
3 结论与讨论
采用主成分分析法分析油脂的FTIR光谱,得到1743~1710cm-1、1172~1130cm-1、2945~2844cm-1、1728~1689cm-1、2987~2840cm-1和1731~1660cm-1光谱范围是对植物油脂酸败程度最为敏感的波数范围。单独使用主成分分析法对酸败植物油进行鉴别时,出现3个酸败植物油被误判成合格植物油的情况。进一步将主成分分析法结合判别分析方法,利用上述光谱波数范围对判别分析模型进行优化,建立植物油酸败程度鉴别模型,该模型性能稳定,预测验证集样品的识别率达到100%。说明使用FTIR技术可以快速、准确、无损地对植物油酸败与否进行鉴别。在以后的实验中,需要随时根据市场变化丰富样品的品种和数量,进一步优化更新模型的处理方法是保证模型实际应用效果的关键。
[1]代小容,刘伯云.潲水油研究进展[J].粮食与油脂,2008(4):36-37.
[2]季祥,蔡禄.鉴别食用油脂中地沟油的方法探讨[J].技术油脂工程,2010,21(3):32-34.
[3]孙丽琴,孙立君,郑刚.不同的存放条件对油脂酸价和过氧化值的影响[J].粮油检测与加工,2007(2):45-46.
[4]郧海丽,刘树彬.食用植物油的抗氧化研究进展[J].煤炭与化工,2013,36(4):31-34.
[5]潘红红.食用植物油脂品质监测和预警指标的研究[D].成都:成都理工大学,2012.
[6]董文丽,李德溥.包装对松仁油脂氧化酸败抑制的研究[J].包装工程,2014,35(17):53-56.
[7]侯景芳,李桂霞,李奕然,等.浅谈油脂酸败及储存[J].农产品加工,2013(6):60-62.
[8]穆昭,王兴国,刘元法.加热过程煎炸油品质分析[J].油脂工程,2008(2):65-67.
[9]黄西文.食用油脂的酸败指标检测研究[J].科技信息,2013(22):418.
[10]Rohman A,Che M Y,Yusof F.The use of FTIR spectroscopy and chemometrics for rapid authentication of extra virgin olive oil[J].J Am Oil Chem Soc,2014(91):207-213.
[11]王美美,范璐,钱向明,等.3种植物油傅里叶变换红外光谱信息的判别分析研究[J].中国油脂,2009,34(10):72-74.
[12]谢梦圆,张军,陈哲,等.地沟油的近红外光谱分析鉴别[J].中国油脂,2011,36(12):80-83.
[13]李沂光,单杨.近红外光谱法定性检测餐桌废弃油脂的掺伪[J].食品工业科技,2013(20):87-90.
[14]Tay A,Singh R K,Krishnan S S,et al.Authentication of olive oil adulterated with vegetable oils using Fourier transform infrared spectroscopy[J].LWT-Food Science and Technology,2002,35(1):99-103.
[15]Luna A S,da Silva A P,Ferré J,et al.Classification of edible oils and modeling of their physico-chemical properties bychemometricmethodsusingmid-IRspectroscopy[J]. SpectrochimicaActaPartA:MolecularandBiomolecular Spectroscopy,2013,100:109-114.
[16]刘玲玲.应用红外光谱技术进行食用油真伪及掺伪的快速鉴定[D].北京:北京林业大学,2012.
[17]毕艳兰.油脂化学[M].北京:化学工业出版社,2005:1-7.
[18]Rohman A,Man Y B.Fourier transform infrared(FTIR)spectroscopy for analysis of extra virgin olive oil adulterated with palm oil[J].Food Research International,2010,43(3):886-892.
[19]潘剑宇,尹平河.潲水油、煎炸老油与合格食用植物油的鉴别研究[J].食品科学,2003(8):27-29.
[20]刘玲玲,武彦文.傅里叶变换红外光谱结合模式识别法快速鉴别食用油真伪[J].化学学报,2012(8):995-1000.
Rapid authentication of rancid edible oil based on fourier transform infrared spectroscopy of principal component and discrimination analysis
ZHOU Jun1,2,ZHANG Jun1,2,*,XIE Meng-yuan1,2,CHEN Zhe1,2,WANG Yong3,GUAN He-yuan1,2
(1.Key Laboratory of Optoelectronic Information and Sensing Technologies of Guangdong Higher Education Institutes,Ji’nan University,Guangzhou 510632,China;2.Department of Optoelectronic Engineering,Ji’nan University,Guangzhou 510632,China;3.Department of Food Science and Engineering,Ji’nan University,Guangzhou 510632,China)
40 qualified edible oils and 44 rancid ones were collected and analyzed.25 qualified edible oils and 39 rancid ones were selected to compose training set.Principal component analysis(PCA)was used to compress thousands of spectral data into several variables and describe the body of spectra,the analysis suggested that the accumulate reliabilities of PC1,PC2 and PC3(the first three principle components)were more than 95% and corresponding 1743~1710cm-1,1172~1130cm-1,2945~2844cm-1,1728~1689cm-1,2987~2840cm-1and 1731~1660cm-1were the most sensitive bands for edible oil rancidity.The training set was used to build discrimination analysis(DA)model,and then the most sensitive bands were applied as DA model inputs.The model was validated by other 20 samples as validation set with the correct recognition rate of 100%,which showed this method could be used to distinguish the rancid edible oil rapidly,accurately and soundly.
authentication of rancid edible oil;principal component analysis;discrimination analysis;FTIR
TS207.3
A
1002-0306(2015)12-0053-04
10.13386/j.issn1002-0306.2015.12.002
2014-09-24
周俊(1990-),男,在读硕士研究生,研究方向:光谱分析。
张军(1968-),女,博士,研究员,研究方向:光谱分析,光电检测。
国家自然科学基金项目(61177075,61275046,61475066,61405075);广东省战略性新兴产业核心技术攻关项目(2012A032300016,2012A080302004);广东省学科建设专项资金项目(2013CXZDA005);广东省自然科学基金项目(2014A030313377);中央高校基本科研业务费专项资金项目(21614313,21615307)。

