黄原胶寡糖琥珀酸酯衍生物的制备及其对野油菜黄单胞菌的抑菌性能研究
孙 涛,徐宏蕾,周可鹏,谢 晶,薛 斌,邵则淮,吴逸飞
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海201306)
黄原胶寡糖琥珀酸酯衍生物的制备及其对野油菜黄单胞菌的抑菌性能研究
孙涛,徐宏蕾,周可鹏,谢晶,薛斌,邵则淮,吴逸飞
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海201306)
将碱性条件下制备的黄原胶寡糖与琥珀酸酐进行反应,得到三种不同取代度的黄原胶寡糖琥珀酸酯衍生物(SA-XG-1、SA-XG-2、SA-XG-3),凝胶渗透色谱(GPC)法测定产物分子量分别为7560、6400和7430u。三种衍生物的取代度分别为0.18、0.32和0.43。采用琼脂平板打孔法、最低抑菌浓度以及生长曲线法,考察了三种衍生物对野油菜黄单胞菌的抑菌能力;检测了三种衍生物对野油菜黄单胞菌细胞膜通透性影响。结果表明,随取代度的上升,抑菌圈缩小,最小抑菌浓度升高,对野油菜黄单胞菌细胞膜破坏能力减弱。当分子量相仿、丙酮酸和还原糖含量相近时,衍生物的抑菌性能可能与其取代度有关;但取代度上升,衍生物对野油菜黄单胞菌细胞膜破坏减弱,表明破坏细胞膜通透性是抑菌主要机理之一。
黄原胶,取代度,抑菌性
黄原胶,又称单胞多糖,是一种由野油菜黄单胞菌(X.campestris)分泌的胞外多糖,由D-葡萄糖、D-甘露糖、D-葡萄糖醛酸、乙酸、丙酮酸组成的“五糖重复单元”构成[1]。由于黄原胶分子之间靠氢键作用而形成规则螺旋和保护,使得黄原胶的官能团被包围在内部,只有水溶性较好的低分子量黄原胶才会表现出一些生物活性。黄单胞菌属是植物病原菌,对一百多种单子叶植物和数百种双子叶植物有危害。其中野油菜黄单胞菌是引起十字花科植物黑腐病的重要病原菌,会严重影响甘蓝、白菜、花椰菜、荠菜和萝卜等植物的产量和质量,对蔬菜产业影响重大[2-3]。研究表明[4]将卡拉胶低聚糖进行酰基化可以增强其抗菌性,其抗凝血、抗氧化及抑菌性都有很大的提升;将黄原胶进行琥珀酰基化反应制备黄原胶寡糖琥珀酸酯衍生物,其抗氧化活性明显增强的研究也已见报道[5],但是其抑菌性能及机理的研究罕见报道。
本文在碱性条件下降解黄原胶得到黄原胶寡糖,而合成三种黄原胶寡糖琥珀酸酯衍生物,并考察了三种衍生物对野油菜黄单胞菌的抑制作用,以及对野油菜黄单胞菌细胞膜通透性的影响,为黄原胶寡糖衍生物抑菌机理的研究提供参考。
1 材料与方法
1.1材料与仪器
黄原胶食品级,上海联合食品添加剂有限公司;琥珀酸酐分析纯,上海化学试剂公司;野油菜黄单胞菌上海海洋大学食品学院提供;其他试剂为分析纯。
YXQ-SG46-280S型手提式压力蒸汽灭菌锅上海博迅实业有限公司;SW-CJ-1F型净化工作台苏净集团苏州安泰空气技术有限公司;THZ-82N型台式恒温振荡器上海跃进医疗器械厂;PYX-DHS-40X50BS型隔水式电热恒温培养箱上海跃进医疗器械厂;DELTA-320-S型pH计梅特勒-托利多仪器上海有限公司;WFZ UV2000型紫外分光光度计上海合利仪器有限公司;METTLER AE200型电子分析天平梅特勒-托利多仪器上海有限公司;DDSJ-308A型电导率仪上海仪电科学仪器股份有限公司。
1.2实验方法
1.2.1黄原胶寡糖琥珀酸酯衍生物制备
1.2.1.1黄原胶寡糖XG-OH制备将30g黄原胶(XG)溶于1600mL的pH为12.0的水中,并向其中加入50mL 30%H2O2,于80℃下搅拌5d,冷却,用0.1mol/L HCl调节溶液pH至7.0,先通过微孔过滤器(0.45μm),然后在蒸馏水中透析(截流分子量为3500、7000和14000u)6d,冷冻干燥后得到黄原胶寡糖XG-OH约1.0g[6]。
1.2.1.2黄原胶寡糖琥珀酸酯衍生物SA-XG-1制备向100mL含黄原胶寡糖(XG-OH)1.0g的去离子水中,滴加50mL含琥珀酸酐0.5g的丙酮溶液,恒温40℃,搅拌4h。产物经丙酮析出后,用丙酮溶液反复洗涤、抽滤,真空干燥后得黄原胶琥珀酸酯衍生物SA-XG-1。
1.2.1.3黄原胶寡糖琥珀酸酯衍生物SA-XG-2制备当反应时间为8h,重复1.2.1.2操作得SA-XG-2[5]。
1.2.1.4黄原胶寡糖琥珀酸酯衍生物SA-XG-3制备当琥珀酸酐量为1.0g时,搅拌4h,重复1.2.1.2操作得SA-XG-3。
1.2.2测试表征
1.2.2.1分子质量及分布测定红外光谱在EQUNOX55傅里叶红外-拉曼光谱仪上进行,采用溴化钾(KBr)压片法制样,测定波数范围为400~4000cm-1,分辨率为150cm-1。采用凝胶渗透色谱法(GPC)测定黄原胶降解产物的相对分子质量及其分布。
GPC测试条件如下:柱子:TOSOH BIOSEP G4000SWXL;流动相:0.2mol/L醋酸钠溶液;色谱仪:Waters 515型凝胶色仪;检测器:Waters2410示差折光检测器;进样量:50μL;柱温:40℃。标准物质:葡聚糖,分子量分别为473000、188000、76900、43200、10500、4400u[7]。
1.2.2.2丙酮酸含量测定采用紫外分光光度法,在波长条件为320nm下对黄原胶降解产物的丙酮酸含量进行测定[8]。
1.2.2.3还原糖含量测定采用3,5-二硝基水杨酸比色法测定黄原胶降解产物中还原糖的含量[9]。
1.2.2.4取代度测定黄原胶寡糖琥珀酸衍生物SA-XG-1、SA-XG-2、SA-XG-3的取代度测定参照Sigga[10]的方法。取1.0g黄原胶寡糖琥珀酸衍生物于250mL的锥形瓶中,再加入40mL的75%乙醇,加热到55℃并搅拌0.5h,再加入10mL 0.05mol/L浓度的NaOH溶液,皂化搅拌15min,之后用0.5mol/L HCl溶液滴定到酚酞指示剂的红色刚好消失。用黄原胶寡糖琥珀酸酯衍生物等量的寡糖做空白。黄原胶寡糖琥珀酸酯衍生物中琥珀酸基团的含量(WMA)与取代度(DS)的计算如下[5]。
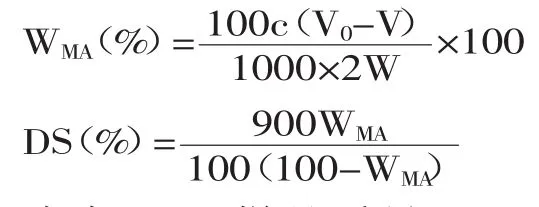
式中:W—样品质量(g);c—HCl溶液的浓度(mg/mL);V0—空白组消耗HCl的体积(mL);V—实验组消耗HCl的体积(mL)。
1.2.3抑菌性能测定
1.2.3.1琼脂平板打孔法测定抑菌作用用接种环挑取少许野油菜黄单胞菌菌体于20mL胰蛋白胨大豆肉汤培养基中,37℃,200r/min摇床培养12h。稀释至终浓度106CFU/mL左右的菌悬液,备用。向平板中倾注15~20mL的营养琼脂培养基,并摇匀。待凝固后加入0.1mL菌悬液,用无菌涂布棒涂布均匀,静置片刻,然后在平皿中用无菌6mm牛津杯打孔,并用无菌牙签挑出多余培养基,分别吸取0.2mL两种浓度(10.00、5.00g/L)的三种取代度的无菌黄原胶寡糖琥珀酸酯衍生物注入已打好的孔中。于37℃下培养24h,测量抑菌圈大小。以2.00g/L的头孢曲松钠作阳性对照,无菌水做空白对照,平行实验3次[11]。
1.2.3.2最低抑菌浓度(MIC)的测定配制胰蛋白胨大豆肉汤液体培养基,121℃高压灭菌。利用胰蛋白胨大豆肉汤进行平板连续稀释得抑菌剂的浓度分别为10.00、7.50、5.00、2.50、1.25、1.00g/L,然后在每一系列平板培养基中接种野油菜黄单胞菌,每个浓度三次平行,并置于37℃下培养24h,之后观察生长情况。将平板利用划线法接种、培养,观察各实验菌的生长情况,以平板中没有细菌生长的最低浓度即为最低抑菌浓度MIC[12]。
1.2.3.3生长曲线测定将活化后菌落总数为106CFU/mL的野油菜黄单胞菌液以3%接种量接入含有2.50g/L黄原胶寡糖琥珀酸酯衍生物的胰蛋白胨大豆肉汤培养基中,分装试管,分别在0、3、6、9、12、15、18、21h测定溶液OD600的值[13]。
1.2.3.4黄原胶寡糖琥珀酸酯衍生物对野油菜黄单胞菌细胞膜通透性的影响取菌落总数约为106CFU/mL的野油菜黄单胞菌液5mL与等体积浓度为5g/L的黄原胶寡糖琥珀酸酯衍生物溶液混合,使三种黄原胶寡糖琥珀酸酯衍生物浓度达到2.50g/L,于37℃、150r/min条件下振荡培养。分别在0、20、40、60、80、100、120、140、180min时取样,测定培养液的电导率,对照组用无菌水代替黄原胶寡糖琥珀酸酯衍生物溶液[14]。
1.2.4数据分析采用OriginPro 8作图,并用SPSS 20.0对数据进行分析(n=3,p<0.05)。
2 结果与分析
2.1黄原胶琥珀酸酯衍生物的结构表征
图1是黄原胶寡糖XG-OH及取代度不同的黄原胶寡糖琥珀酸衍生物SA-XG-1、SA-XG-2和SA-XG-3的红外谱图。从图1中可知,三种衍生物SA-XG-1、SA-XG-2和SA-XG-3的多数伸缩振动吸收峰与黄原胶寡糖的吻合,分别出现在1000、1600、3500cm-1处,这表明三种黄原胶寡糖琥珀酸衍生物保留了黄原胶寡糖骨架的基本结构[7]。而三种衍生物SA-XG-1、SA-XG-2和SA-XG-3在1727cm-1处出现了酯基中C= O的伸缩振动峰,表明琥珀酸酐与黄原胶寡糖发生了酯化接枝反应[7]。
GPC测试结果表明,三种黄原胶寡糖琥珀酸酯衍生物SA-XG-1、SA-XG-2、SA-XG-3相对平均分子质量分别为7560、6400、7430u。SA-XG-1、SA-XG-2、SA-XG-3的丙酮酸含量分别为4.6%、4.9%和4.9%;三种衍生物的还原糖含量分别为20.5%、19.4%和19.0%。取代度测试结果:三种黄原胶寡糖琥珀酸酯衍生物SA-XG-1、SA-XG-2、SA-XG-3的取代度分别是0.18、0.32和0.43。

图1 黄原胶寡糖及其琥珀酸酯衍生物红外光谱图Fig.1 FT-IR spectra of succinyl xanthan oligosaccharides
2.2黄原胶寡糖琥珀酸酯衍生物对野油菜黄单胞菌的抑菌效果
抑菌圈测量是微生物分析的经典方法。通过测量抑菌圈的直径,来初步判断抑菌剂的抑菌能力。从表1可知,当抑菌剂浓度为5g/L时,SA-XG-1的抑菌圈直径为16.83cm,大于XG-OH和其他两种衍生物;当抑菌剂浓度增大至10g/L时,抑菌圈均有所增大,而且三种黄原胶琥珀酸酯衍生物对野油菜黄单胞菌的抑菌效果大小仍是:SA-XG-1>SA-XG-2>SA-XG-3,表现出随着取代度的增加,抑菌效果减弱的现象。其中,衍生物SA-XG-1的效果优于寡糖。

表1 黄原胶寡糖琥珀酸酯衍生物对野油菜黄单胞菌的抑菌效果Table 1 The inhibitory effect of succinyl xanthan oligosaccharides against X.campestris
2.3最低抑菌浓度(MIC)测定
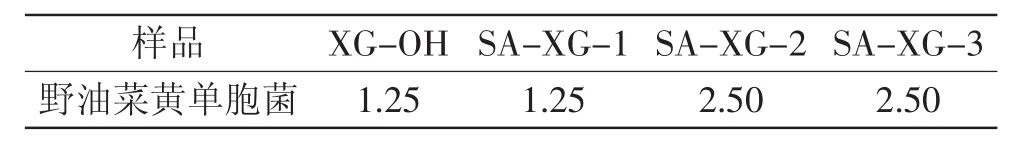
表2 黄原胶寡糖琥珀酸酯衍生物的最小抑菌浓度(g/L)Table 2 The MIC of succinyl xanthan oligosaccharides(g/L)
MIC是指抑菌剂能够完全抑制细菌生长所需要的最低浓度,其值越低说明抑菌剂对细菌的抑制效果越好。三种黄原胶寡糖琥珀酸酯衍生物对野油菜黄单胞菌的最小抑菌浓度见表2,结果表明在1.25g/L时,SA-XG-1可以完全抑制野油菜黄单胞菌的生长,而SA-XG-2和SA-XG-3完全抑制野油菜黄单胞菌生长需要2.50g/L,即SA-XG-1具有最好的抑菌效果。这与抑菌圈实验结果规律一致。
2.4黄原胶寡糖琥珀酸酯衍生物对野油菜黄单胞菌生长的影响
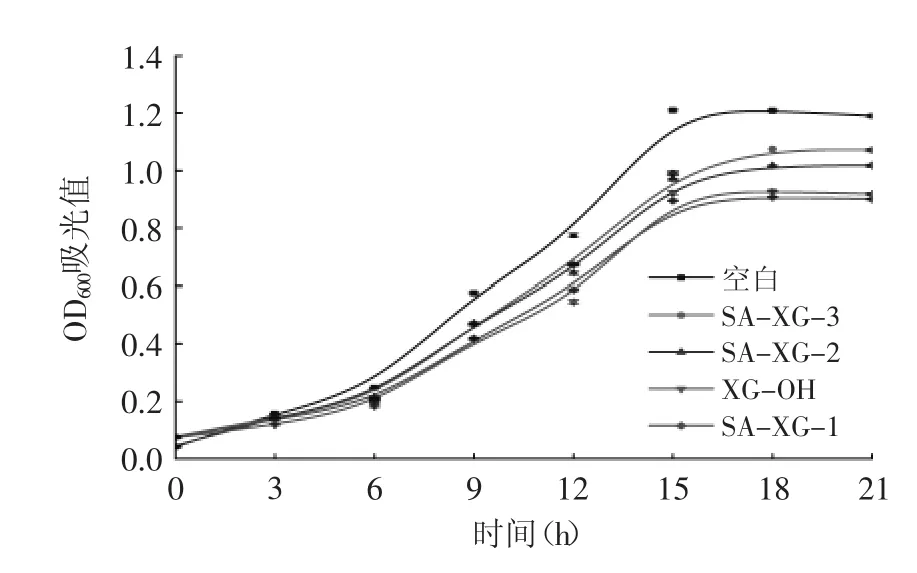
图2 黄原胶寡糖琥珀酸酯衍生物对野油菜黄单胞菌生长的影响Fig.2 Antibacterial activity of succinyl xanthan oligosaccharides against X.campestris
三种黄原胶琥珀酸酯衍生物对野油菜黄单胞菌生长的抑制效果见图2,由图2可知,在21h内空白组OD值从坐标原点附近上升到约1.2随后趋于平稳,加入黄原胶寡糖琥珀酸衍生物的实验组OD值有所下降,其中加入SA-XG-1的实验组OD值下降最为明显。表明SA-XG-1对野油菜黄单胞菌的抑制效果最佳,且随着取代度的升高,衍生物抑菌效果减弱,这与抑菌圈以及MIC规律一致。
2.5黄原胶琥珀酸酯衍生物对野油菜黄单胞菌细胞膜通透性的影响
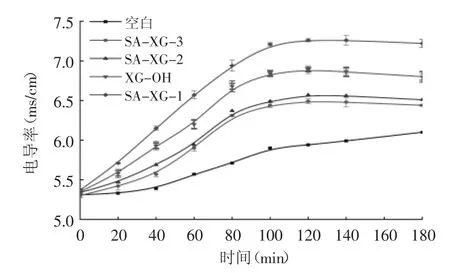
图3 黄原胶琥珀酸酯衍生物对野油菜黄单胞菌液电导率的影响Fig.3 Effect of succinyl xanthan oligosaccharides on electric conductivity of X.campestris
抑菌剂对细菌细胞膜通透性的影响是抑菌剂的抑菌机理之一。细胞膜是细菌的一层保护屏障,当细菌遇到不利生长环境或与抑菌剂作用时,其细胞膜会遭到破坏,丧失半透性,内部电解质大量渗入至培养液中,导致培养液的电导率上升。因此菌液电导率的变化反映了细菌细胞膜通透性的变化情况[15]。三种黄原胶寡糖琥珀酸酯衍生物对野油菜黄单胞菌细胞膜通透性的影响见图3,在180min内空白组电导率由初始值上升逐渐至6.0附近,这是由于细菌细胞的自然死亡导致,加入黄原胶寡糖琥珀酸衍生物后电导率有明显上升的趋势。其中SA-XG-1组电导率上升的最高,即取代度最小的SA-XG-1对野油菜黄单胞菌细胞膜具有最强的破坏性,这与抑菌能力的实验结果一致,说明黄原胶寡糖琥珀酸衍生物对细菌细胞膜的破坏是抑菌机理之一。
3 结论
黄原胶寡糖对野油菜黄单胞菌的抑菌活性与其粘度/还原末端比有关[16]。而本研究探讨了黄原胶寡糖琥珀酸酯衍生物的取代度对抑菌效果的影响以及抑菌机理。将碱性条件下制得的黄原胶寡糖与琥珀酸酐反应,制得三种分子量、丙酮酸、还原糖含量相近,而取代度不同的黄原胶寡糖琥珀酸酯衍生物,通过评价它们对野油菜黄单胞菌的抑菌圈、MIC、生长曲线及细胞膜通透性影响,结果表明只有取代度最小的黄原胶寡糖琥珀酸酯衍生物比原料黄原胶寡糖有更好的抑菌效果,并且随着取代度的提升,抑菌性能逐渐下降,这可能是由于随着取代度的升高,黄原胶寡糖琥珀酸酯衍生物中的活性羟基数目逐渐下降,导致抑菌性能下降,相关机理还需要进一步分析实验得出。
[1]黄成栋,白雪芳,杜昱光.黄原胶(Xanthan Gum)的特性、生产及应用[J].微生物学通报,2005,32(2):91-98.
[2]郭瑞,丁恩勇.黄原胶的结构、性能与应用[J].日用化学工业,2006,36(1):42-45.
[3]韩冠英,凌沛学,王凤山.黄原胶的特性及其在医学领域的应用[J].生物医学工程研究,2010,29(4):277-281.
[4]孙涛,朱云,卫颖隽,等.不同取代度马来酰κ-卡拉胶的抗氧化活性研究[J].上海海洋大学学报,2011,23(1):144-148.
[5]熊小英.黄原胶的化学改性及其衍生物抗氧化活性[D].上海:上海海洋大学,2013.
[6]江丽丽,张庆,徐世艾.黄原胶降解的研究进展[J].微生物学通报,2008,35(8):1292-1296.
[7]孙涛,熊小英,魏颖隽,等.黄原胶降解及其抗氧化性能研究[J].天然产物研究与开发,2012,24(1):102-104,113.
[8]楼良旺,高年发.紫外分光光度法测定丙酮酸[J].分析实验室,2005,24(4):11-13.
[9]Miller G.Use of Dinitrosalicylic Acid Reagent for Determination of Reducing Sugar[J].Analytical Chemistry,1959,31(3):426-436.
[10]Siggia S.Quantitative Organic Analysis via Functional Groups[J].New York:John Wiley Inc,1954:45.
[11]Fernandes JC,Tavaria FK.Antimicrobial Effect of Chitosans andChitooligosaccharidesuponStaphylococcusaureusand Escherichia coli,in Food Model Systems[J].Food Microbiology,2009,25:922-928.
[12]Jeon YJ.Antimicrobial Effect of Chitooligosaccharides Produced by Bioreactor[J].Carbohydrate Polymers,2001,44:71-76.
[13]Hong KN,Na YP,Shin HL,et al.Antibacterial Activity of ChitosanandChitosanOligomerswithDifferentMolecular Weights[J].International Journal of Food Microbiology,2002,74:65-72.
[14]侯伟峰,谢晶,蓝蔚青,等.植酸对大肠杆菌抑菌机理的研究[J].江苏农业学报,2012,28(2):443-447.
[15]陈晶晶,赵辉,方波,等.羧甲基降解黄原胶选择性清除血浆LDL/Fib的研究[J].中国血液流变学杂志,2008,18(4):476-480.
[16]何晓燕,张利英,白雪芳,等.黄原胶寡糖生物活性的研究[J].微生物学通报,2005,32(3):87-90.
Preparation of succinyl xanthan oligosaccharides and its antibacterial activities against Xanthomonas campestris
SUN Tao,XU Hong-lei,ZHOU Ke-peng,XIE Jing,XUE Bin,SHAO Ze-huai,WU Yi-fei
(College of Food Science and Technology,Shanghai Ocean University,Shanghai Engineering Research Center of Aquatic-Product Processing and Preservation,Shanghai 201306,China)
Three succinyl xanthan oligosaccharides with different substituting degrees(SA-XG-1,SA-XG-2 and SA-XG-3)were prepared.Their molecular weights determined by GPC method were 7560,6400 and 7430u,respectively.Their substituting degree was 0.18,0.32 and 0.43,respectively.The antibacterial activities of three succinyl xanthan oligosaccharides against Xanthomonas campestris(X.campestris)were investigated by the inhibition zone,minimal inhibitory concentration(MIC)and the influence on the growth of X.campestris.The influence of three succinyl xanthan oligosaccharides on electric conductivity of X.campestris was also determined.The results showed that the inhibition zone was decreased,the MIC was increased,but the damage capability to cell membrane of X.campestris was decreased with the increasing of the substituting degrees,in other words,the SA-XG-1 possessed the best antibacterial activity.The results showed that the antibacterial activity of succinyl xanthan oligosaccharides may be related to the substituting degrees,and the damage capability to cell membrane of X.campestris may be the one of the main antibacterial mechanism of succinyl xanthan oligosaccharides.
succinyl xanthan oligosaccharides;substituting degree;antibacterial activity
TS201.3
A
1002-0306(2015)12-0091-04
10.13386/j.issn1002-0306.2015.12.011
2014-09-23
孙涛(1970-),女,博士,副教授,研究方向:天然多糖。
“十二五”国家支撑计划项目“鲜活农产品安全低碳物流技术与配套装备”,淡水水产品保活冷鲜冷链物流关键技术研发(2012BAD38B04)基金资助。

