孜然精油对杂拟谷盗的熏蒸效果及代谢酶活的影响
沈科萍,李国林,毕 阳,张 忠(甘肃农业大学食品科学与工程学院,甘肃兰州730070)
孜然精油对杂拟谷盗的熏蒸效果及代谢酶活的影响
沈科萍,李国林,毕阳*,张忠*
(甘肃农业大学食品科学与工程学院,甘肃兰州730070)
本文研究了孜然精油对杂拟谷盗(Tribolium confusum)的熏蒸效果及部分机理。T.confusum经最大剂量30 μL/L孜然精油处理24 h后,死亡率达到了95%,试虫的死亡率与处理浓度和处理时间呈现出明显的正相关。T.confusum经孜然精油熏蒸处理后乙酰胆碱酯酶(AchE)在8 h出现最高值,解毒酶系中的酸性磷酸酯酶(ACP)呈现先下降后升高的趋势;碱性磷酸酯酶(ALP)、羧酸酯酶(CarE)活性明显高于未熏蒸的对照,且这两种酶活力均呈现出升高的趋势;谷胱甘肽-S-转移酶(GSTs)的酶活性被显著(p≤0.05)地抑制;保护酶系中的三种酶活性也被精油的处理诱导升高。由此表明,孜然精油对T.confusum的良好熏蒸效果是通过影响试虫体内的神经、解毒和保护酶系来实现的。
孜然精油,杂拟谷盗,熏蒸作用,酶活性
储粮害虫不仅造成粮食数量的减少,还降低了粮食的食用、加工、种用和工艺品质,缩短了仓房使用寿命。此外,还会传播致病微生物,危害消费者的健康[1-2]。虽然采用人工合成的化学防护剂和熏蒸剂可有效控制储粮害虫,但因此所造成的“3R”(Residue、Resistance、Resurgence)问题也日趋明显[3],因此,亟需寻找新的、更加安全有效的控制方法[4]。采用植物源杀虫剂可在一定程度上减轻储粮害虫的危害,且具有安全、广谱等特点[5]。
从猪毛蒿(Artemisia scoparia)、桉树叶(Eucalyptus globulus Labill)和茼蒿(Crassocephalum crepidioides)等多种植物中提取的精油及其活性成分均对储粮害虫表现不同程度的熏蒸、触杀和驱避效果,植物精油及其活性成分对储粮害虫的熏蒸抑制机理涉及破坏害虫的中枢神经系统[6-7]、抑制代谢解毒酶系[8-9]以及降低抗氧化保护系统的功能[10]等方面[11]。孜然是重要的调味品,有报道孜然精油具有杀虫活性,对杂拟谷盗(T.confusum)和地中海粉斑螟(Ephestiakueh niella)等均具有熏蒸杀卵活性,但孜然精油对杂拟谷盗的熏蒸活性的抑制机理尚未见报道。
本研究的目的在于测定孜然精油对T.confusum的熏蒸效果,以乙酰胆碱酯酶(AchE)为指标,研究孜然精油的神经毒性,以酸性磷酸酯酶(ACP)、碱性磷酸酯酶(ALP)、羧酸酯酶(CarE)和谷胱甘肽-S-转移酶(GSTs)为指标,研究孜然精油对T.confusum解毒酶系的影响。此外,以超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)为指标,研究孜然精油对T.confusum抗氧化酶系的影响,以期为开发孜然精油类防虫剂提供理论依据。
1 材料与方法
1.1材料与仪器
孜然(Cuminum cyminum L.)品种敦玉一号,生长于新疆吐鲁番市,由敦煌种业有限公司提供;试虫杂拟谷盗(T.confusum),由华中农业大学城市有害生物防治研究所提供;5,5’-二硫-二硝基苯甲酸(DTNB)、乙二胺四乙酸(EDTA)、氮蓝四唑(NBT)、聚乙烯吡咯烷酮(PVPP)、十二烷基硫酸钠(SDS)、对三硝基苯(TNB)、丙酮、牛血清蛋白等均为分析纯,上海振企化学试剂有限公司。
SW-CJ-2FD型超净工作台苏州安泰空气技术有限公司;DHG-9245A型电热鼓风箱、DHP-9162型恒温培养箱上海一恒科技有限公司;YX280B型手提式不锈钢压力蒸汽灭菌锅上海三申医疗器械有限公司;XH-B微型旋涡混合器江苏康健医疗器械有限公司。
1.2实验方法
1.2.1精油的提取参照李大强等的水蒸气蒸馏方法[12]。将孜然用小型电动粉碎机粉碎过40目筛,各称取粉碎后物料160 g,加入1600 mL蒸馏水浸泡12 h后进行蒸馏(90℃),蒸馏时间为2~3 h,馏出液用冷凝水冷凝收集,然后用无水乙醚(1∶1)萃取,萃取液以无水硫酸钠干燥后用旋转蒸发仪除去溶剂获得精油,在4℃冰箱中保存备用。
1.2.2试虫的饲养试虫采用麦麸:面粉为7∶3的混匀比例饲养。饲料使用前均在80℃温度下消毒2 h,含水量调至13%±1%,然后分装于罐头瓶中。接入成虫后,置于(27±1)℃、相对湿度75%±5%的黑暗人工气候箱中饲养,7~10 d后筛去成虫,待下一代成虫大量出现后1~2周,筛出成虫供试。在测定过程中,以针触及成虫尾部、触角及足不动视为死亡。
1.2.3不同浓度孜然精油对T.confusum的熏蒸实验采用吕建华等的方法[7]并略加修改,先将滤纸剪成10 cm×1 cm的滤纸条,取250 mL的容量瓶,每瓶中接入20只试虫,根据预实验结果设置处理剂量梯度为2.50、5.00、10.00、20.00、30.00 μL/L。用微量进样器将相应量的孜然精油滴加到滤纸条的中部(对照组不滴加精油),粘在试剂瓶瓶口,将瓶盖拧紧密封,避免试虫出瓶。每个处理设3次重复,将容量瓶移入与饲养条件相同的培养箱中,分别在处理后2、4、8、12和24 h观察死亡的试虫数,观察时先将瓶盖打开散气10 min后再进行,并按照以下公式计算死亡率和校正死亡率及半致死剂量(LC50)。
1.2.4试虫的处理选取成虫数只,采用孜然精油LC50浓度(2.065 μl/L)进行熏蒸,分别在处理后2、4、8、12和24 h取出试虫,用锡箔纸包好后倒入液氮速冻,样品保存于-80℃超低温冰箱内冷冻待测。以不加精油处理作对照,用于AchE、ACP、ALP、CarE、GSTs、SOD、POD、CAT酶活的测定。每处理用虫30只,重复3次。
粗酶液的提取:取1.2.4处理后的试虫30只,加入在4℃预冷的0.1 mol/L、pH8.0的PBS缓冲液3 mL,在冰浴条件下研磨成浆,研钵、研锤用相同磷酸缓冲液洗涤两次,将匀浆液移至10 mL离心管内,在4℃、12000 r/min下离心20 min,取上清液保存于-20℃冰箱内备用待测。
1.2.5酶活力的测定
1.2.5.1AchE活性的测定参照Gorun等和王光峰等的方法并修改[13-14],在试管中按顺序依次加入0.1 mol/L pH8.0的PBS缓冲液0.25 mL、0.075 mol/L的碘化硫代乙酰胆碱(Asch)0.05 mL、0.1 mL的酶液,对照管以0.1 mol/L pH8.0的PBS缓冲液代替酶液,加好后振荡混匀,25℃下水浴保温反应20 min后,加入3.6 mL DTNB-乙醇-磷酸缓冲液终止反应并显色,用对照管作参比调零,412 nm处测定各管的吸光度(A),重复测定3次。以每分钟吸光度变化0.01个单位为一个酶活力单位。
1.2.5.2ACP活性的测定参照Bessey等[15]的方法并略加修改,在试管中按顺序依次加入0.2 mol/L pH4.6的醋酸缓冲液2.15 mL、0.0075 mol/L的对硝基磷酸二钠溶液0.45 mL、粗酶液0.1 mL,对照管以0.2 mol/L pH4.6的醋酸缓冲液代替酶液,加好后振荡混匀。将各试管在37℃水浴中保温振荡30 min后,加入1.8 mL 0.1 mol/L的NaOH溶液终止反应。在400 nm处测定各管吸光度,以对硝基酚为底物做标准曲线。以对照管做参比调零,重复测定3次。按OD值在标准曲线上求出对硝基酚的量,按下式计算出ACP的比活力(μmol/mg·min)。
ACP比活力=对硝基酚/(蛋白质含量×30min)
1.2.5.3ALP活性的测定用0.04 mol/L pH9.6的巴比妥钠-盐酸缓冲溶液代替0.2 mol/L pH4.6的醋酸缓冲液,其他方法同1.2.5.2 ACP活性的测定。
1.2.5.4CarE活性的测定参照Asperen等[16]方法并略加修改,在试管中按顺序依次加入含有1×10-7mol/L毒扁豆碱的0.1 mol/L、pH7.8的PBS 3.49 mL,4×10-4mol/L的α-乙酸萘酯溶液0.5 mL、粗酶液0.01 mL,对照管以含1×10-7mol/L毒扁豆碱的0.1 mol/L、pH7.8的PBS代替酶液,加好后混合均匀。将各试管在37℃水浴中保温振荡30 min后,加入0.5 mL显色液(1%坚固蓝B∶5%SDS=2∶5,体积比),再在室温下放置10 min后,在600 nm处测定各管吸光度,以α-萘酚为底物做标准曲线。以对照管作参比调零,重复测定3次。根据制作的标准曲线和酶原蛋白含量的测定结果,将OD值换算成比活力(μmol/mg·min)。
1.2.5.5GSTs活性的测定参照Clark等[17]的方法并修改,在试管中依次加入含2×10-3mol/L EDTA的0.1 mol/L、pH6.5的PBS 2.5mL,50 mmol/L GSH 0.1 mL,50 mmol/L CDNB 0.1 mL,粗酶液0.3 mL,对照管以含有2×10-3mol/L的EDTA,0.1 mol/L PBS(pH6.5)代替酶液,加好后混合均匀,以对照管作参比调零,立即在340 nm处测定各管的吸光度值,重复测定3次。
1.2.5.6SOD活性的测定参照程伟霞等[18]的方法并略加修改,在试管中依次加入0.1 mol/L PBS 1.5 mL、0.13 mol/L甲硫氨酸(MET)溶液0.3 mL、750 μmol/L氮蓝四唑(NBT)溶液0.3 mL、100 μmol/L乙二胺四乙酸二钠(EDTA-Na2)溶液0.3 mL、粗酶液0.4 mL,最后加入20 μmol/L核黄素0.3 mL,另取两支试管分别加入上述试剂,以pH7.5 0.1 mol/L的磷酸缓冲液代替粗酶液,混匀后将1支试管放于暗处,其他各试管放于4000 LUX光照条件下反应15 min,要求各管照光情况均匀一致,温度在(30±1)℃。待反应结束后,以暗处放置试管作空白对照调零,于560 nm处测定其他各管的吸光度值(A)。重复测定3次。SOD活性以每毫克蛋白抑制氮蓝四唑(NBT)光化还原的50%为酶活性单位(U/mg蛋白)表示。
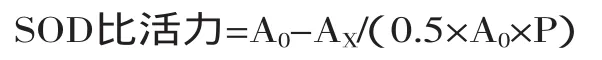
其中:A0—照光对照管;AX—样品管;P—蛋白含量。
1.2.5.7CAT活性的测定参照Clairbone等[19]的方法并修改,在各试管中按顺序依次加入20 mmol/L H2O2(用50 mmol/L、pH7.5的PBS缓冲液配制),200 μL粗酶液。以蒸馏水作参比,加入粗酶液30 μL后立即开始记录反应体系在240 nm处的吸光度(A),连续测定2 min,重复测定3次。以每分钟吸光度值变化0.01为1个CAT活力单位(U),以U/mg蛋白表示其活性。
1.2.5.8POD活性的测定参照Simon等[20]的方法并修改,在各试管中按顺序依次加入2.0 mL 0.2 mol/L PBS(pH6.0)缓冲液,0.12 mol/L愈创木酚2.0 mL,0.1 mol/L H2O2(用0.2 mol/L pH6.0 PBS缓冲液配制),粗酶液0.2 mL。混合均匀后在25℃水浴中反应10 min,以蒸馏水作参比,在470 nm处测定反应体系的吸光度(A),重复测定3次。以每分钟吸光度值变化0.01为1个POD活力单位(U),以U/mg蛋白表示其活性。
1.3蛋白含量的测定
参照Bradford[21]方法,以牛血清蛋白为标准蛋白制作标准曲线,计算蛋白含量。
1.4数据处理
全部实验数据采用Microsoft Excel 2010和SPSS 18.0(SPSS Inc.,USA)数据处理系统进行分析,计算毒力回归方程和LC50等参数,用Duncan’s法进行多重显著性分析和标准偏差(±SD)计算。
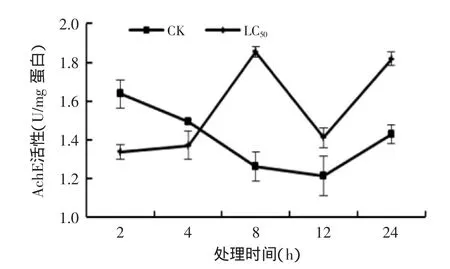
图1 孜然精油熏蒸对T.confusum成虫AchE活性的影响Fig.1 Effect of C.cyminum essential oil on the AchE activities in T.confusum
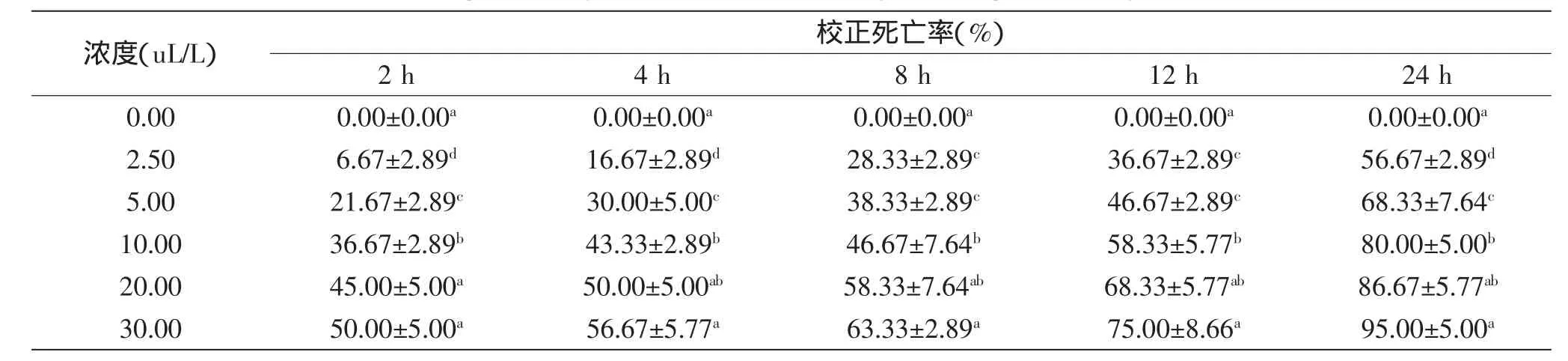
表1 不同浓度孜然精油对T.confusum的熏蒸效果(平均数±标准偏差)Table 1 Fumigant toxicity of essential oil from C.cyminum against T.confusum(x±SD)
2 结果与分析
2.1不同浓度孜然精油对T.confusum的熏蒸效果
孜然精油对T.confusum成虫具有良好的熏蒸效果,由表1可知,熏蒸效果随着处理浓度的增加而明显增强。在较低浓度下也表现出了不同的熏蒸效果,2.50 μL/L孜然精油熏蒸2 h后,成虫的校正死亡率仅为6.67%,处理24 h后可达56.67%,为2 h熏蒸处理的8.6倍;当浓度升至30.00 μL/L时,2 h后校正死亡率为50.00%,24 h后达到95%,为2 h的1.9倍。
对T.confusum害虫熏蒸24 h结果做probit回归分析求得熏蒸毒力方程为y=-0.395+1.254x,计算得到T.confusum害虫的LC50为2.065 μL/L。由此可见,T.confusum对孜然精油的熏蒸较敏感。该结果与Rajendran和Purohit等在二斑叶螨上(Tetranychus urticae)的研究结果相似[22-23]。
2.2孜然精油熏蒸对T.confusum的AchE影响
AchE是昆虫神经系统的关键酶,通过调控水解神经递质——乙酰胆碱来实现正常的神经传递[24],随着乙酰胆碱分解的加速,试虫反应速度变慢,表现出一种自身的应激反应[25]。由图1可知,处理组AchE活性在2 h时最低,8 h达到最大;对照组酶活呈先降低后升高的趋势;处理组除在2、4 h时低于对照组外,8、12、24 h均分别高为同期对照1.47、1.16和1.32倍。本研究结果表明LC50孜然精油处理可有效诱导试虫体内的AchE活性。有研究表明,低剂量的杀虫剂可以诱导试虫体内AchE的活性,但高剂量可能抑制其活性,导致试虫因过度兴奋而死亡[26]。
2.3孜然精油熏蒸对T.confusum成虫解毒酶系的影响
CarE、ACP、ALP和GSTs是昆虫体内的重要解毒酶系,可分解环境中的有毒因子,ACP和ALP酶活性的提高可提高试虫对杀虫剂的耐受性[27-29]。有研究发现,ACP活性的改变会影响B.germanica对杀虫剂的敏感性,导致抗药性的产生[30-31]。
2.3.1孜然精油熏蒸对T.confusum成虫ACP酶活的影响由图2可知,对照组ACP活性呈先升高后下降的趋势,12 h时达到最大;而处理组的酶活性先下降,在8 h时最低,24 h时活性最大,为同期对照组的1.4倍。结果表明LC50孜然精油处理可以有效诱导试虫体内的ACP活性。
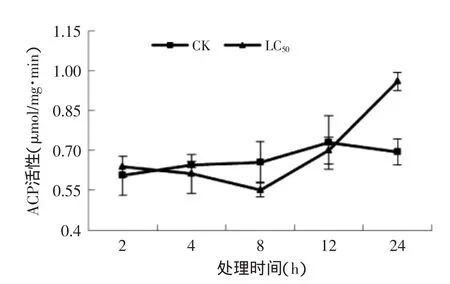
图2 孜然精油熏蒸对T.confusum成虫ACP活性的影响Fig.2 Effect of C.cyminum essential oil on the ACP activities in T.confusum
2.3.2孜然精油熏蒸对T.confusum成虫ALP酶活的影响由图3可知,LC50孜然精油处理后ALP的酶活性随着处理时间的延长而增加。对照组酶活性呈先下降后升高的趋势,在8 h处最低,处理组为对照组的1.52倍。2 h时处理组活性低于对照组,随着时间的延长,处理组的酶活显著(p≤0.05)高于对照组,分别是同期对照组的1.07、1.52、1.20和1.22倍。
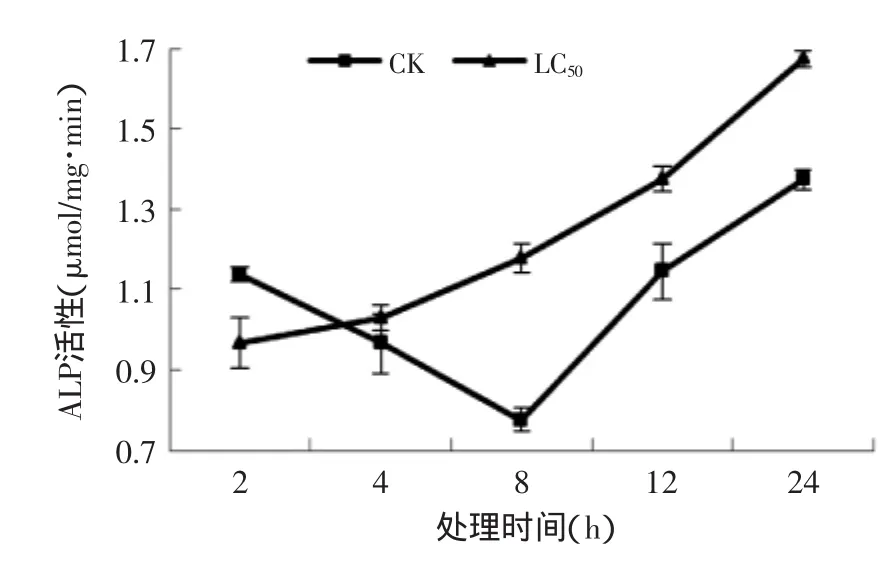
图3 孜然精油熏蒸对T.confusum成虫ALP活性的影响Fig.3 Effect of C.cyminum essential oil on the ALP activities in T.confusum
孜然精油处理后试虫体内ACP和ALP活性的变化说明当试虫接触到低浓度的精油时,先对酶活性产生了抑制作用,之后激发了体内防御性应激反应,使酶活性升高。
2.3.3孜然精油熏蒸对T.confusum成虫CarE酶活的影响由图4可知,处理组酶活在2 h最低,随着时间的延长,活性逐渐升高,在24 h到达最大值。处理组酶活性均随着时间的延长而呈现出缓慢增长的趋势,除24 h时处理组的酶活显著(p≤0.05)高于对照组(为对照组的1.11倍)外,其他时间点处理组酶活均低于同期对照组,与尚利娜等[32]用黄花蒿精油处理玉米象的结果相似。结果表明孜然精油明显诱导了CarE的活性,其可以提高试虫的CarE活性。
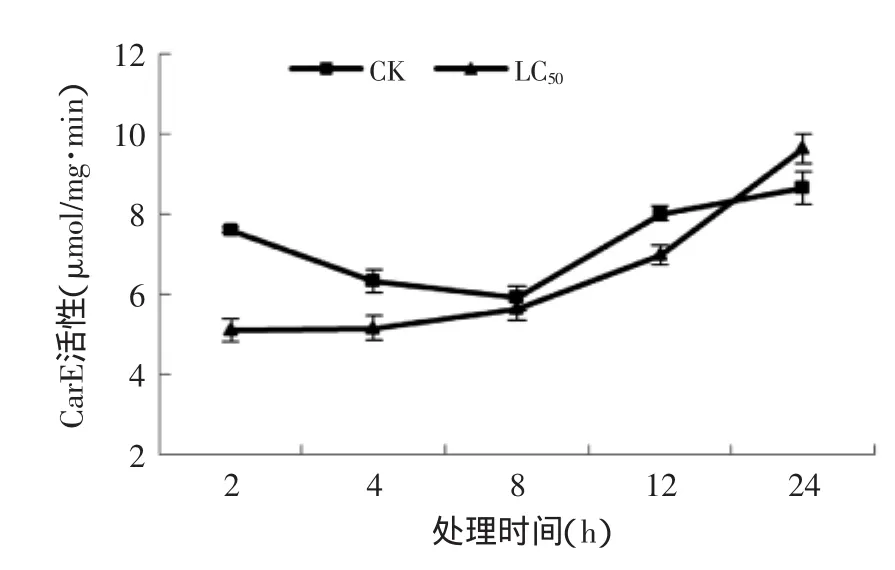
图4 孜然精油熏蒸对T.confusum成虫CarE活性的影响Fig.4 Effect of C.cyminum essential oil on the CarE activities in T.confusum
2.3.4孜然精油熏蒸对T.confusum成虫GSTs酶活的影响图5表明处理组和对照组的酶活力均呈先下降后上升的趋势,处理组的酶活性始终显著(p≤0.05)低于对照组,两组处理均在4 h时,活性降到最低,之后上升,在24 h处到达最大值。12 h时,处理组与对照组的差异达到最大,处理比对照低0.4个活性单位,为对照组的85%。结果表明经孜然精油处理后试虫体内的GSTs活性被显著抑制。该结果与程伟霞等[18]发现的敌敌畏和对氧磷对虱的抑制结果相似。由此推断,GSTs可能是孜然精油杀虫作用的主要作用位点。
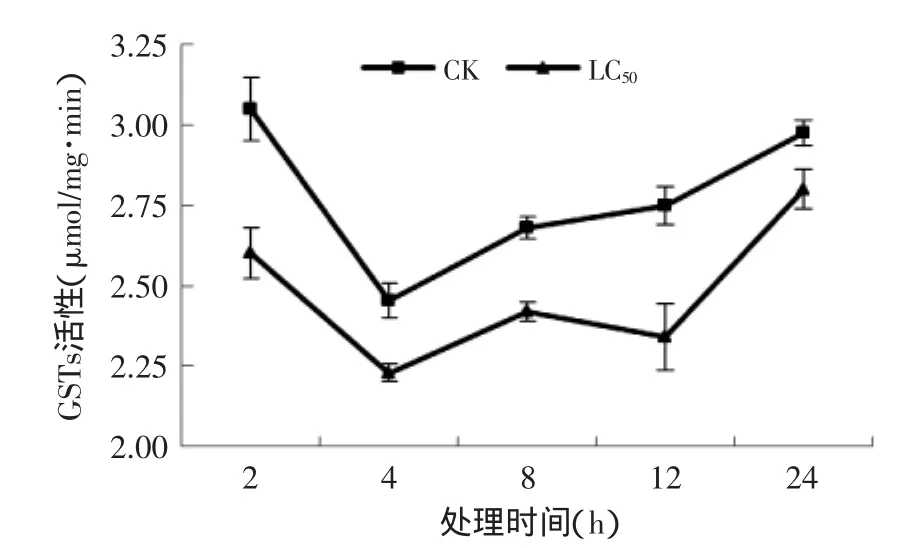
图5 孜然精油熏蒸对T.confusum成虫GSTs活性的影响Fig.5 Effect of C.cyminum essential oil on the GSTs activities in T.confusum
2.4孜然精油熏蒸对T.confusum保护酶系的影响
SOD、CAT和POD被认为是昆虫体内的保护酶系,与昆虫的正常生长与死亡有着密切的关系,在动物和植物体内都存在着各种各样的自由基,其中主要有过氧化氢、超氧阴离子、羟自由基,它们会对昆虫的细胞产生毒害,SOD、CAT和POD可以消除自由基在体内的存留时间,减少对机体产生伤害。其中SOD可以催化降解超氧阴离子自由基生成过氧化氢,过氧化氢又可以被CAT和POD催化降解,从而起到保护机体的作用[33]。
2.4.1孜然精油熏蒸对T.confusum成虫SOD酶活的影响由图6可知处理组酶活性的变化呈先下降后上升的趋势,在4 h处,酶活性达到最低;4 h后处理组试虫的SOD活性明显升高,在24 h处达到最大值,较4 h时提高了64%,较同期对照组提高了22%。所以,孜然精油可以有效诱导试虫的SOD活性。
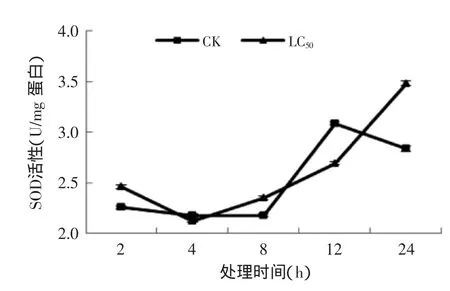
图6 孜然精油熏蒸对T.confusum成虫SOD活性的影响Fig.6 Effect of C.cyminum essential oil on the SOD activities in T.confusum
2.4.2孜然精油熏蒸对T.confusum成虫CAT酶活的影响由图7知,处理和对照组试虫的CAT活性变化基本一致,均呈先下降后上升的趋势。2 h时处理组为对照组的0.91倍;在4、24 h时,处理组活性均高于对照组,分别是对照组的1.05和1.07倍。表明孜然精油可以提高试虫的CAT活性。
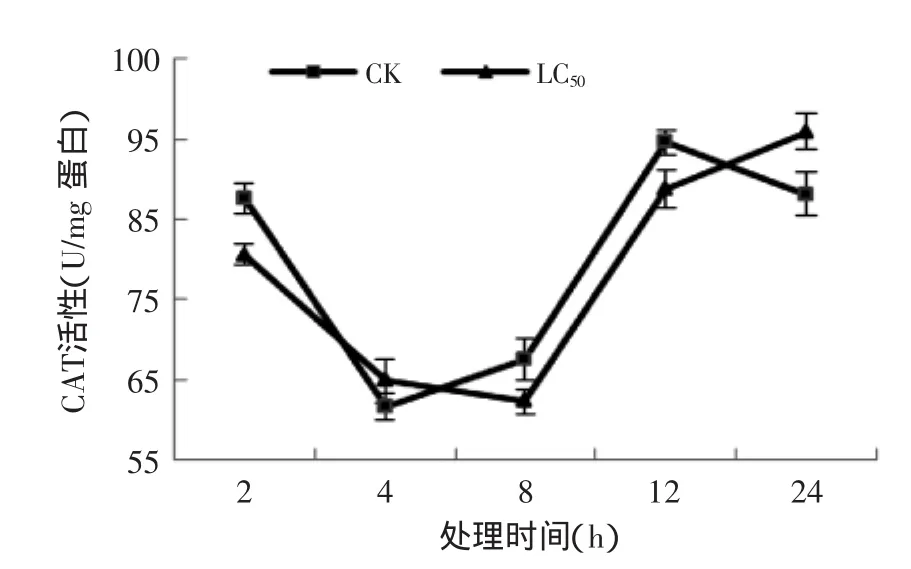
图7 孜然精油熏蒸对T.confusum成虫CAT活性的影响Fig.7 Effect of C.cyminum essential oil on the CAT activities in T.confusum
2.4.3孜然精油熏蒸对T.confusum成虫POD酶活的影响由图8得,处理和对照组均呈现出先下降后上升的趋势,对照组最低点出现在8 h,而处理组的最低点在12 h;除在12 h处,处理组酶活性都显著(p≤0.05)大于对照组,分别比同期对照组高17.6%、47.8%、65%和41.4%。所以,孜然精油可以增强试虫的POD活性。
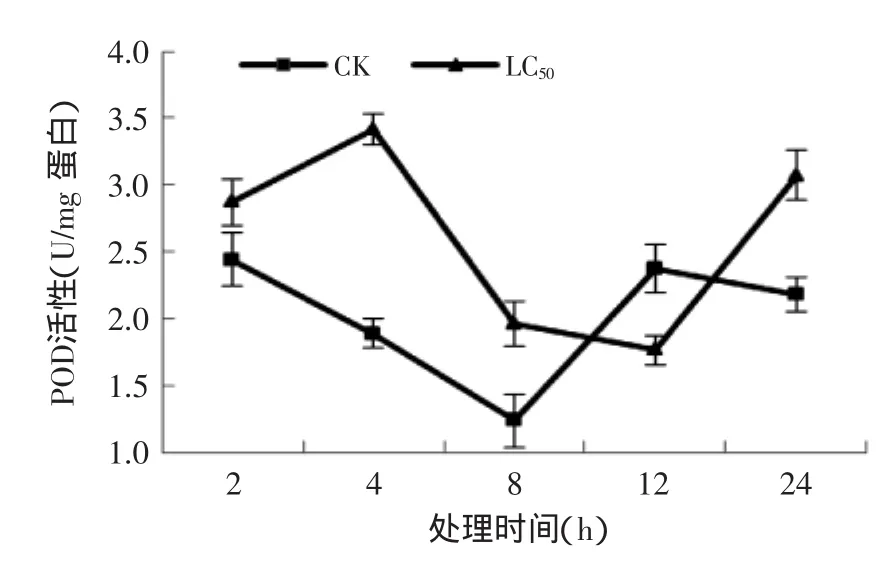
图8 孜然精油熏蒸对T.confusum成虫POD活性的影响Fig.8 Effect of C.cyminum essential oil on the POD activities in T.confusum
本研究发现,孜然精油处理后试虫体内的CAT和SOD活性均被诱导升高,这可能与昆虫对外界防御机制有关。Brattsten等[34]提出,昆虫体内的酶合成受外界和自身条件的调控,当试虫接触精油时,会产生应激反应从而加快代谢外源的有毒物质。李周直等[33]研究发现昆虫体内保护酶活性的大小与昆虫的抗药性有关,因此对保护酶系的研究有助于更深入的了解昆虫抗病性的产生机理并且预防这种不利方面带来的影响,维持杀虫剂对昆虫的毒杀作用。
3 结论
孜然精油对T.confusum具有良好的熏蒸作用,对T.confusum体内的多种酶活性均有影响,对AchE、解毒代谢酶系(如ACP、ALP、CarE)和保护酶系(如SOD、CAT、POD)有诱导激活的作用,在部分处理时间内处理组酶活性高于对照组,这可能是昆虫自身的一种防御应激反应,GSTs可能是孜然精油对T. confusum发挥作用的靶点之一。前期的研究表明,孜然精油的主要成分为枯茗醛和α-蒎烯其可能参与了孜然精油的抗虫作用[35-36],但精油的组成复杂,寻找并分离精油中高效活性成分也成为有效防治储粮害虫的新思路和新方法,孜然精油的抗虫机理还有待进一步研究。
[1]Madrid F J,White N D G,Loschiavo S R.Insects in stored cereals,and their association with farming practices in southern Manitoba[J].Can Entomol,1990,122(3):515-523.
[2]程小丽,武传欣,刘俊明,等.储粮害虫防治研究进展[J].粮油仓储科技通讯,2010(6):26-29.
[3]韩俊艳,张立竹,纪明山.植物源杀虫剂的研究进展[J].中国农学通报,2011,27(21):229-233.
[4]王晶磊,肖雅斌,邹春霞,等.主要植物源杀虫剂防治储粮害虫应用及展望[J].粮食科技与经济,2014,39(2):47-50.
[5]顾海莎.植物源农药研究进展综述[J].安徽农业科学,2007,35(24):7520-7521.
[6]张珣,周莹莹,李燕,等.植物源杀虫剂对葡萄绿盲蝽和斑叶蝉的防治效果[J].科技导报,2014,32(12):36-40.
[7]吕建华,林敏刚,屠亚伟.α-蒎烯对杂拟谷盗成虫的控制作用[J].中国粮油学报,2010(12):88-91.
[8]韩群鑫,黄寿山.丁香酚对赤拟谷盗的生物活性[J].重庆师范大学学报,2009,26(3):16-19.
[9]Chaubey M K.Fumigant toxicity of essential oils against rice weevil Sitophilus oryzae L.(Coleoptera:Curculionidae)[J].Int J Biol Sci,2011,11(6):411-416.
[10]Ebadollahi A.Essential oils isolated from Myrtaceae family as natural insecticides[J].Annu Rev Res Biol,2013,3(3):148-175.
[11]Shaaya E,Kostjukovski M,Eilberg J,et al.Plant oils as fumigants and contact insecticides for the control of storedproduct insects[J].J Stoed Prod Res,1997,33(1):7-15.
[12]李大强,张忠,毕阳,等.甘肃和新疆产区孜然精油成分的比较[J].食品工业科技,2012,33(11):141-143.
[13]Gorun V,Proinov I,Băltescu V,et al.Modified Ellman procedure for assay of cholinesterases in crude enzymatic preparations[J].Anal Biochem,1978,86(1):324-326.
[14]王光峰,张友军,柏连阳,等.多杀菌素对甜菜夜蛾多酚氧化酶和羧酸酯酶的影响[J].农药学学报,2003,5(2):40-46.
[15]Sabokbar A,Millett P J,Myer B,et al.A rapid,quantitative assay for measuring alkaline phosphatase activity in osteoblastic cells in vitro[J].Bone Miner Metab,1994,27(1):57-67.
[16]Van Asperen K.A study of housefly esterases by means of a sensitive colorimetric method[J].Insect Physiol,1962,8(4):401-416.
[17]Clark A G,Dick G L,Smith J N.Kinetic studies on a glutathione S-transferase from the larvae of Costelytra zealandica[J].Biochem J,1984,217:51-58.
[18]程伟霞,柴玉鑫,王进军.四种杀虫剂对两种书虱谷胱甘肽-S-转移酶和超氧化物歧化酶的影响[J].植物保护学报,2006,33(3):333-334.
[19]Kakkar V,Muppu S K,Chopra K,et al.Curcumin loaded solid lipid nanoparticles:an efficient formulation approach for cerebral ischemic reperfusion injury in rats[J].Eur J Pharm Biopharm,2013,85(3):339-345.
[20]Zhu Z,Jiang W,Thompson H J.Edible dry bean consumption(Phaseolus vulgaris L.)modulates cardiovascular risk factors and diet-induced obesity in rats and mice[J].Brit J Nutr,2012,108(S1):S66-S73.
[21]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72(1):248-254.
[22]Purohit P,Mustafa M,Osmani Z.Insecticidal properties of plant-extract of Cuminum cyminum Linn[J].J Sci Food Agr,1983,49(4):101-103.
[23]Rajendran S,Sriranjini V.Plant products as fumigants for stored-product insect control[J].J Stored Prod Res,2008,44(2):126-135.
[24]尹飞,冯夏,李振宇,等.亚致死剂量氯虫苯甲酰胺对小菜蛾体内活性酶的影响[J].植物保护,2014,40(2):66-69.
[25]李亚红,余志涛,张学尧,等.昆虫谷胱甘肽S-转移酶农药解毒与内源代谢研究进展[J].山西大学学报,2014,4:49-51.
[26]徐汉虹,赵善欢,朱亮锋.精油对储粮害虫种群的繁殖抑制作用研究[J].中国粮油学报,1993,8(2):11-17.
[27]Nathan S S,Kalaivani K,Murugan K,et al.The toxicity and physiologicaleffectofneemlimonoidsonCnaphalocrocis medinalis(Guenée)the rice leaffolder[J].Pestic Biochem Phys,2005,81(2):113-122.
[28]Sakharov I Y,Makarova I E,Ermolin G A.Chemical modification and composition of tetrameric isozyme K of alkaline phosphatase from harp seal intestinal mucosa[J].Comp Biochem Phys B,1989,92(1):119-122.
[29]张红英,赤国彤,张金林.昆虫解毒酶系与抗药性研究进展[J].河北农业大学学报,2009(z1):193-195.
[30]吕敏,刘惠霞,吴文君.谷胱甘肽S-转移酶与昆虫抗药性的关系[J].昆虫知识,2004,40(3):204-207.
[31]蔡慧珍,沈孝兵.德国小蠊酸性磷酸酯酶测定条件的方法研究[J].环境与职业医学,2007,24(3):251-254.
[32]尚利娜,袁海滨,魏春艳,等.黄花蒿精油对玉米象成虫体内酶活力的影响[J].吉林农业大学学报,2010,32(6):616-621.
[33]李周直,沈惠娟,蒋巧根,等.几种昆虫体内保护晶系统活力的研究[J].昆虫学报,1994,37(4):399-403.
[34]Brattsten L B,Holyoke C W,Leeper J R,et al.Insecticide resistance:challenge to pest management and basic research[J]. Sci,1986,231(4743):1255-1260.
[35]Sekine T,Sugano M,Majid A,et al.Antifungal effects of volatile compounds from black zira(Bunium persicum)and other spices and herbs[J].Journal of Chemical Ecology,2007,33:2123-2132.
[36]Lucia A,Audino P G,Seccacini E,et al.Larvicidal effect of Eucalyptus grandis essential oil and turpentine and their major components on Aedes aegypti larvae[J].Journal of the American Mosquito Control Association,2007,23:299-303.
Control with essential oils of cumin(Cuminum cyminum)against Tribolium confusum and influence of metabolic enzyme activity
SHEN Ke-ping,LI Guo-lin,BI Yang*,ZHANG Zhong*
(College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China)
The study was used the methods of fumigant to measure the effects of physiological and biochemical index of T.confusum.The motality of T.confusum was 95%after 24 h of treatment at 30 μL/L cumin essential oil.The motality rate showed positive correlation with concentration and treatment time.Through T.confusum fumigant by the essential oil of cumin,the result showed that the activity of AchE was appeared highest at 8 h,detoxification enzymes ACP presented variation trend,increased at first and then decreased.ALP and CarE activity were significantly higher than the control fumigation and vitality of these two enzymes were shown a rising trend.The activity of GST was significant inhibited(p≤0.05)during the treatment.In conclusion,the essential oil of cumin possessed activity of repellency and fumigation,and contact toxicity against T.confusum. The insectieidal mechanism mainly involved the activities of many impotant enzymes.
Cuminum cyminum L.essential oil;T.confusum;fumigant;enzymatic activity
TS201.1
A
1002-0306(2015)18-0320-06
10.13386/j.issn1002-0306.2015.18.056
2015-01-22
沈科萍(1987-),女,硕士,研究方向:采后生物学与技术,E-mail:15002585408@163.com。
毕阳(1962-),男,博士,教授,研究方向:采后生物学与技术,E-mail:biyang@gsau.edu.cn。张忠(1977-),男,博士,副教授,研究方向:天然抗菌活性物质,E-mail:zhangzhong@gsau.edu.cn。
国家自然科学基金(31360416);甘肃省自然科学基金(1308RJZA162)。
——硫酰氟熏蒸应用技术

