Notch1在B细胞淋巴瘤中的表达及临床意义
吕杰谭亚娜邰宵辉李红玲
作者单位:730000 兰州 1宁夏医科大学;2甘肃省中医药大学;甘肃省人民医院3肿瘤内科,4组织与病理室
临床经验
Notch1在B细胞淋巴瘤中的表达及临床意义
吕杰1谭亚娜2邰宵辉3李红玲4
作者单位:730000兰州1宁夏医科大学;2甘肃省中医药大学;甘肃省人民医院3肿瘤内科,4组织与病理室
目的 探讨Notch1在B细胞淋巴瘤组织的表达及其临床意义。方法 采用免疫组化SP法检测55例B细胞淋巴瘤组织(B细胞淋巴瘤组)和27例淋巴结反应性增生组织(对照组)中Notch1蛋白的表达情况及其特点。结果Notch1蛋白在B细胞淋巴瘤组和对照组中的阳性表达率分别为27.27%和7.41%,两组比较差异有统计学意义(P<0.05);Notch1蛋白的表达与患者年龄、性别、淋巴结受侵位置及临床分期均无关(P均>0.05)。结论Notch1在B细胞淋巴瘤中的表达上调,其在B细胞淋巴瘤的发生、发展中可能起重要作用。
淋巴瘤;B细胞淋巴瘤;Notch1;表达;临床意义
淋巴瘤是一种发病率较高的血液系统恶性肿瘤,原发于淋巴结及其它器官的淋巴组织,可发生于身体任何部位,以实体瘤的形式生长,常见于淋巴组织丰富的组织器官,如淋巴结、扁桃体、脾、骨髓等,其具有高度异质性,不同病理类型其临床表现、治疗反应及预后有所差异。我国T细胞淋巴瘤约占30%,而B细胞淋巴瘤则占70%左右。
Notch信号传导通路是由Morgan于1916年在果蝇中发现,因其部分突变可引起果蝇翅膀残缺(Notch)而得名。Notch是在生物进化过程中高度保守的信号传导通路,广泛存在于包括哺乳动物在内的多个物种之中,Notch信号传导通路由Notch受体、配体以及下游靶基因组成。它可通过与表达配体的相邻细胞间的相互作用传导信号,参与调节细胞的增殖、分化和凋亡。因而Notch信号传导通路发生异常可导致多种疾病的发生、发展。Notch受体蛋白有4种(Notch1~Notch4)。目前研究多集中在Notch1受体蛋白与T细胞白血病/淋巴瘤方面。本研究通过免疫组化SP法检测B细胞淋巴瘤Notch1蛋白的表达情况,探讨其在B细胞淋巴瘤发生、发展中的作用,以期为临床治疗提供新的思路。
1 资料与方法
1.1一般资料
回顾性分析2013年1月至2015年1月甘肃省人民医院病理科检测的55例B细胞相关淋巴瘤标本(B细胞淋巴瘤组),其中慢性淋巴细胞白血病8例,滤泡性淋巴瘤9例,边缘区B细胞淋巴瘤4例,浆细胞瘤3例,弥漫大B细胞淋巴瘤25例,Burkitt淋巴瘤1例,套细胞淋巴瘤5例;男性32例,女性23例;年龄16~70岁,中位年龄56岁,年龄≤50岁21例,>50岁34例;另取27例淋巴结反应性增生组织标本作为对照组。
1.2主要试剂
兔抗人跨膜受体蛋白Notch1抗体、免疫组化SP检测试剂盒、DAB染色试剂盒均购自上海联硕生物科技有限公司。
1.3标本制备
所有标本均经4%福尔马林溶液固定,常规石蜡包埋连续切片,厚度为4μm。石蜡切片脱蜡并予乙醇水化;3%H2O2溶液室温避光孵育20min以消除内源性过氧化物酶活性;100ml/L正常山羊血清室温封闭30min,弃去血清,滴加1∶100稀释的兔抗人Notch1单克隆抗体,4℃过夜;37℃复温1 h后滴加二抗、三抗。以上每一步实验用0.01mol/L PBS缓冲液振洗3次,每次5min。滴加新鲜配置的DAB显色液,镜下控制显色,苏木精复染,二甲苯透明,封片。用已知阳性表达的标本作为阳性对照,阴性对照以PBS代替一抗。
1.4结果判定
由两名实验者对检测结果进行评估。评估时综合考虑切片中阳性细胞占观察细胞数的百分比和阳性细胞着色的强度。根据着色强度判断阳性表达程度:标本无染色为0分,弱染色(淡黄色)为1分,中等染色(棕黄色)为2分,强染色(棕褐色)为3分。根据阳性细胞占观察细胞数的比例计分:无阳性细胞为0分,阳性细胞数<10%为1分,10%~49%为2分,50%~79%为3分,≥80%为4分。用染色指数表示细胞染色强度,染色指数为上述两项指标的乘积,其结果分为4级:0分为(-),1~2分为(+),3~6分为(++),8~12分为(+++)[1]。本实验以+~+++为阳性表达。
1.5统计学处理
应用SPSS 19.0统计学软件进行处理和分析。样本率的比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1样本组织Notch1蛋白的免疫组化SP法检测
Notch1蛋白免疫组化SP法检测的阳性染色主要集中在细胞膜和(或)细胞质,部分淋巴瘤组织的细胞核亦染色。见图1。

图1 Notch1蛋白的免疫组化SP法检测结果(SP×200)
在B细胞淋巴瘤组中Notch1蛋白阳性表达(+~+++)者15例,其中慢性淋巴细胞白血病6例,滤泡性淋巴瘤1例,边缘区B细胞淋巴瘤1例,浆细胞瘤1例,弥漫大B细胞淋巴瘤4例,Burkitt淋巴瘤1例,套细胞淋巴瘤1例,而对照组仅有2例细胞质轻着色。Notch1蛋白在B细胞淋巴瘤组和对照组中的阳性表达率分别为27.27%(15/55)、7.41%(2/27),两者比较差异有统计学意义(χ2=4.349,P=0.037)。提示Notch1蛋白在B细胞淋巴瘤组织中的表达明显升高。见表1。
2.2Notch1蛋白的阳性表达与B细胞淋巴瘤患者临床病理特征的关系
在B细胞淋巴瘤中Notch1蛋白的阳性表达分别与患者不同年龄、性别、淋巴结受侵位置及临床分期进行比较,差异均无统计学意义(P均>0.05),即Notch1蛋白在B细胞淋巴瘤中的表达与患者年龄、性别、淋巴结受侵位置及临床分期均无关。见表2。

表1 Notch1蛋白在B细胞淋巴瘤组与对照组中的免疫组化SP法检测结果
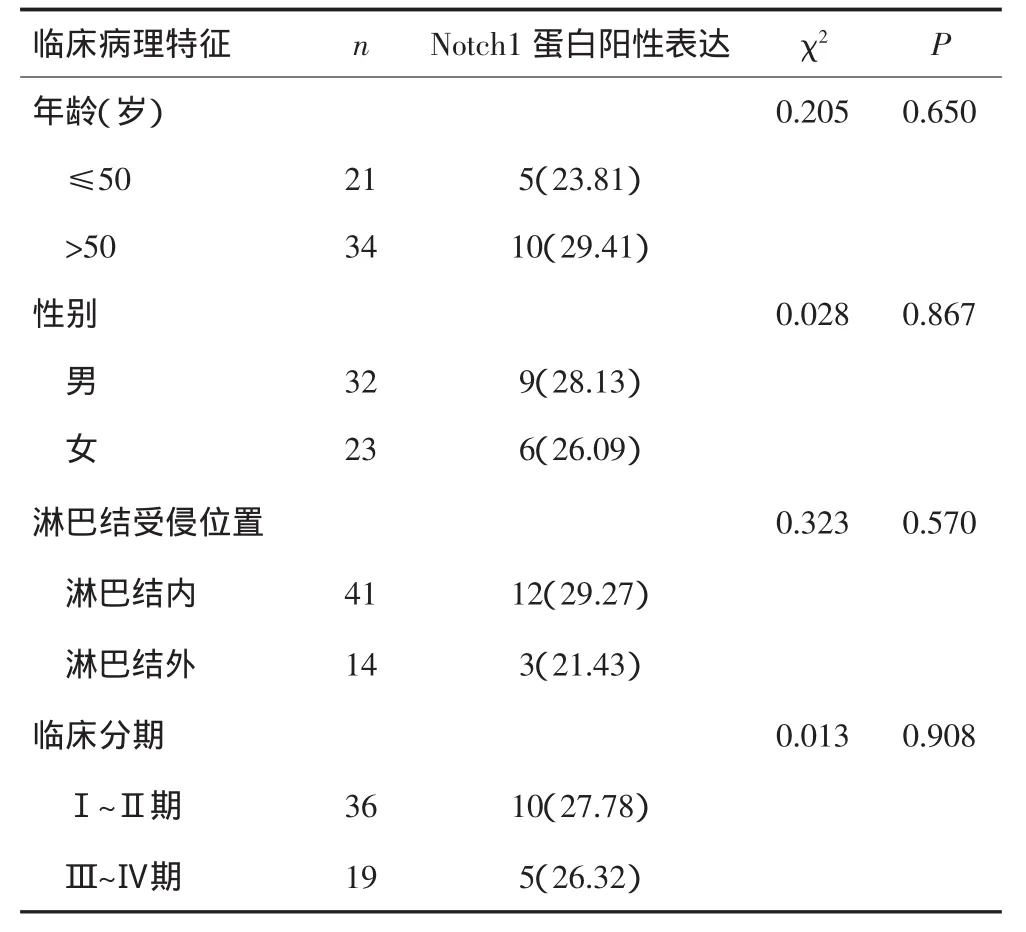
表2 Notch1蛋白的阳性表达与B细胞淋巴瘤患者临床病理特征的关系[n(%)]
3 讨论
Notch是一个复杂的信号传导通路,涉及多个分子信号传导机制,且与其他信号传导通路如C-Myc通路[2]、NF-κB通路[3]等密切相关。诺贝尔奖得主David Baltimore首先研究表明Notch1在急性T淋巴细胞白血病(T-ALL)的发生中可能发挥决定性作用:由点突变或者染色体易位t(7;9)(q34:q34.3)引起的T细胞白血病中,Notch1信号传导通路均持续活化[4]。Notch1基因突变发生在近60%的T-ALL患者中[5]。在霍奇金淋巴瘤和间变大细胞淋巴瘤中也存在Notch1高表达[6,7]。而Notch在B细胞相关淋巴瘤中的研究较少,且目前研究尚存在较大争议。在慢性淋巴细胞白血病患者中存在 Notch1、Notch2及其配体 Jagged1、Jagged2的持续活化,而正常B细胞却不存在此现象,表明Notch信号传导通路参与慢性淋巴细胞白血病细胞的存活及抗凋亡作用[8]。慢性淋巴细胞白血病细胞中Notch1的突变主要发生在第34个外显子,由两个特定碱基缺失移码引起过早产生终止密码子并引起细胞内区C端PEST结构域缺失,最终导致Notch蛋白持续活化[9]。在套细胞淋巴瘤也证实存在与慢性淋巴细胞白血病相同的Notch系统激活机制[10]。滤泡性淋巴瘤中Notch突变的频率为4%~10%,Notch突变患者以女性居多,脾脏易受累及,以低频率的t(14;18)易位为特点,且易进展为弥漫大B细胞淋巴瘤[11]。在弥漫大B细胞淋巴瘤中,Tohda等[12]用DAPT、GSI-I和GSI-XII(γ-分泌酶抑制剂,抑制Notch受体蛋白的表达)抑制弥漫大B细胞淋巴瘤细胞的增殖,说明Notch在弥漫大B细胞淋巴瘤中可促进肿瘤的发展。
本研究通过免疫组化SP法检测Notch1蛋白在B细胞相关淋巴瘤中的表达状况,显示Notch1蛋白在B细胞相关淋巴瘤中高表达,且其表达与患者年龄、性别、淋巴结受侵位置及临床分期均无关。推测Notch1在B细胞淋巴瘤的发生、发展中可能起重要作用。但由于收集病例数量有限,今后还需更多的资料以进一步深入研究。总之,Notch1受体的异常表达可能与B细胞相关淋巴瘤的发生及发展有关,针对Notch信号传导通路研发靶向治疗的药物,以期对淋巴瘤的治疗提供新的疗法。
[1] Bauer L,Takacs A,Slotta-Huspenina J,et al.Clinical significance of NOTCH1 and NOTCH2 expression in gastric carcinomas:an immunohistochemical study[J].FrontOncol,2015,5:94.
[2] Hoemann CD,Beaulieu N,Girard L,et al.Two distinct Notch1 mutant alleles are involved in the induction of T-cell leukemia in c-myctransgenicmice[J].Mol Cell Biol,2000,20(11):3831-3842.
[3] Shin HM,Minter LM,Cho OH,et al.Notch-1 augments NF-κB activity by facilitating its nuclear retention[J].EMBO J,2006,25(1):129-138.
[4] García-PeydróM,de Yébenes VG,Toribio ML.Notch1 and IL-7 receptor interplaymaintains proliferation of human thymic progenitors while suppressing non-T cell fates[J].JImmunol,2006,177(6):3711-3720.
[5]Breit S,Stanulla M,Flohr T,et al.Activating NOTCH1 mutations predict favorable early treatment response and longterm outcome in childhood precursor T-cell lymphoblastic leukemia[J].Blood,2006,108(4):1151-1157.
[6]Jundt F,Anagnostopoulos I,Frster R,et al.Activated Notch1 signaling promotes tumor cell proliferation and survival in Hodgkin and anaplastic large cell lymphoma[J].Blood,2002,99(9):3398-3403.
[7] Kochert K,Ullrich K,Kreher S,et al.High-level expression of Mastermindlike 2 contributes to aberrant activation of the NOTCH signaling pathway in human lymphomas[J].Oncogene,2011,30(15):1831-1840.
[8] Rosati E,Sabatini R,Rampino G,et al.Constitutively activated Notch signaling is involved in survival and apoptosis resistance of B-CLL cells[J].Blood,2009,113(4):856-865.
[9] Puente XS,Pinyol M,Quesada V,et al.Whole-genome sequencing identifies recurrentmutations in chronic lymphocytic leukaemia[J].Nature,2011,475(7354):101-105.
[10]Chiang MY,Xu ML,Histen G,et al.Identification of a conserved negative regulatory sequence that influences the leukemogenic activity of NOTCH1[J].Mol Cell Biol,2006,26(16):6261-6271.
[11]Karube K,Martínez D,Royo C,et al.Recurrent mutations of NOTCH genes in follicular lymphoma identify a distinctive subset of tumours[J].JPathol,2014,234(3):423-430.
[12]Tohda S,Sato T,Kogoshi H,et al.Establishment of a novel B-cell lymphoma cell line with suppressed growth by gamma-secretase inhibitors[J].Leuk Res,2006,30(11):1385-1390.
[2015-06-15收稿][2015-08-10修回][编辑阮萃才]
R733.4
A
1674-5671(2015)05-04
10.3969/j.issn.1674-5671.2015.05.09
国家自然科学基金资助项目(30960438;81260342)
李红玲。E-mail:3253389993@qq.com

