对甲苯磺酸掺杂聚吡咯/尼龙6纳米纤维膜作为碱性橙Ⅱ固相萃取介质的研究
李晓晴等


摘 要 通过静电纺丝法和氧化聚合法制备了对甲苯磺酸根离子掺杂的聚吡咯/尼龙6纳米纤维(PTS-PPy/PA6 NFs)膜,通过静态和动态吸附实验考察其对碱性橙Ⅱ吸附性能,探讨其作为固相萃取(Solid phase extraction,SPE)介质的可行性。结果表明,在25℃,溶液pH=9时,PTS-PPy/PA6 NFs膜对碱性橙Ⅱ的静态吸附容量可达372.2 mg/g,吸附动力学和吸附等温线分别符合准二级动力学模型和Freundlich模型;吸附热力学结果表明,吸附是一个自发进行的吸热过程;在最佳动态吸附条件下,0.1 μg/mL 碱性橙Ⅱ样品溶液以3.0 mL/min的流速通过时,仅2.5 mg PTS-PPy/PA6 NFs膜就能实现高效萃取,且能重复使用7次。依此建立了基于PTS-PPy/PA6 NFs膜的SPE法,结合高效液相色谱-二极管阵列检测(HPLC-DAD)印染废水中的碱性橙Ⅱ时,6批样品均被检出含有碱性橙Ⅱ,10 ng/mL加标水平的平均加标回收率为95.6%~119.7%,相对标准偏差(RSD)为4.9%~12.5%(n=3)。
关键词 纳米纤维膜; 聚吡咯; 碱性橙Ⅱ; 吸附; 固相萃取
1 引 言
碱性橙Ⅱ等工业染料普遍应用于纺织、皮革、印刷等行业,据统计,每年约有10%~15%的工业染料未经有效处理而直接随印染废水排放,造成水环境污染[1],摄入后会对人体造成急性或慢性中毒伤害[2],并具有致癌作用[3]。然而,我国《纺织染整工业水污染物排放标准》(GB4287-2012)中仅以色度对印染废水中的染料总量进行限定,并未涉及单种染料的检测及排放限值。
通常,水体中有机污染物成分复杂,工业染料在水体中的浓度较低,样品需经过除杂、净化、富集等预处理。固相萃取(SPE)法是常用的样品预处理技术之一[4],高效的SPE介质是方法的核心。近年来,基于纳米材料的SPE介质因其独特的优越性而备受关注[5,6]。本研究组前期的研究结果已证实纳米纤维(Nanofibers, NFs)是极具潜质的优越SPE介质[7~9]。静电纺丝法(Electrospinning)是制备NFs的通用方法,以电纺NFs膜进行膜式SPE,可克服SPE小柱在淋洗和洗脱时存在反压而难以操作的缺点。聚吡咯(Polypyrrol, PPy)具有非定域的π电子共轭体系,可与目标分子间形成多种形式的作用力[10],且掺杂不同离子的PPy可表现出不同的吸附性能,有利于高效提取极性目标物[11~13]。
本研究以电纺尼龙6(PA6)NFs膜为模板,采用原位氧化法制备对甲苯磺酸根离子掺杂的聚吡咯/尼龙6纳米纤维(PTS-PPy/PA6 NFs)膜,考察其作为SPE介质提取高极性目标物碱性橙Ⅱ的可行性: 通过静态吸附实验,研究其对碱性橙Ⅱ的吸附动力学和吸附热力学行为,探究饱和吸附容量;通过动态吸附实验,考察并优化其吸附水样中痕量碱性橙Ⅱ的影响因素,建立PTS-PPy/PA6 NFs膜的SPE法,结合HPLC-DAD检测,分析印染废水中的碱性橙Ⅱ,验证方法的实际应用的可行性和准确性。
2 实验部分
2.1 仪器与试剂
LC-20AD高效液相色谱仪、DGU-20A3R 脱气装置、SPD-M20A双极阵列管检测器(日本岛津公司);BT-25S微量电子天平(赛多利斯科学仪器(北京)有限公司);Visiprep DL固相萃取仪(美国Supelco公司);S-4800型场发射扫描电子显微镜(SEM,日本日立公司)。
碱性橙Ⅱ标准品(99.8%,Sigma 公司);吡咯单体、间甲基苯酚、FeCl3·6H2O、对甲苯磺酸钠、甲酸,无水乙醇(色谱纯)、甲醇等(国药集团化学试剂有限公司);PA6原料(分子量16000,张家港港荣国际贸易公司)。
2.2 色谱条件
Diamonsil C18色谱柱(250 mm× 4.6 mm, 5 μm);流动相: 甲醇-水(45∶55, V/V);检测波长: 458 nm;柱温: 30℃;进样量: 20 μL。
2.3 标准溶液的配制
碱性橙Ⅱ标准溶液: 准确称取适量碱性橙Ⅱ标准品(精确到0.1 mg),以甲醇配制成1.0 mg/mL的标准储备液,4℃保存。以去离子水逐级稀释标准储备液,得到实验所需浓度的系列标准溶液。
2.4 PTS-PPy/PA6 NFs膜的制备
以文献\[8\]建立的电纺方法制备PA6 NFs膜,将其置于含一定浓度对甲苯磺酸钠和吡咯单体的混合溶液中,室温下浸泡1 h,加入氧化剂FeCl3·6H2O,在室温下氧化聚合24 h后取出,以无水乙醇、水分别淋洗3次,至洗液无色,再用水和甲醇分别超声清洗1 min,洗净后自然晾干,即得PTS-PPy/PA6 NFs膜。
2.5 静态吸附实验
2.5.1 吸附动力学 准确称取PTS-PPy/PA6 NFs膜2.5 mg,置于10 mL具塞锥形瓶中,加入2 μg/mL碱性橙Ⅱ溶液5 mL,分别在298, 308, 318和328 K 时进行静置吸附实验,在10, 20, 30, 45, 60, 120和180 min时分别取溶液50 μL,HPLC-DAD法测定其中碱性橙Ⅱ的含量。每次取出溶液后及时补充等体积空白介质(去离子水)。按式(1)和式(2)分别计算溶液中碱性橙Ⅱ的去除率(Removalratio, RR, %)和PTS-PPy/PA6 NFs膜对碱性橙Ⅱ的吸附量(Qt)[14,15]:
RR(%)=C0-CeC0×100(1)
Qt=V(C0-Ct)/m(2)
其中, C0为碱性橙Ⅱ的初始浓度(μg/mL); Ce为吸附平衡时溶液中剩余碱性橙Ⅱ的浓度(μg/mL); Qt为吸附时间为t时的吸附量(mg/g); Ct为吸附时间为t时溶液中剩余碱性橙Ⅱ的浓度(μg/mL); V为溶液的体积(mL); m为PTS-PPy/PA6 NFs膜的质量(mg)。
2.5.2 吸附热力学 配制不同浓度的碱性橙Ⅱ溶液(1,2,4, 8,12,16和20 μg/mL),各取5 mL,加入2.0 mg PTS-PPy/PA6 NFs膜,分别在298, 308和328 K条件下进行静置吸附实验。待吸附达到平衡后,测定溶液中碱性橙Ⅱ的浓度,计算平衡吸附容量(Qe)[14,15]。
Qe=V(C0-Ce)/m(3)
式中, C0为碱性橙Ⅱ的初始浓度(μg/mL); Ce为吸附平衡时溶液中剩余碱性橙Ⅱ的浓度(μg/mL); V为溶液的体积(mL); m为PTS-PPy/PA6 NFs膜的质量(mg); Qe为平衡吸附容量(mg/g)。
2.6 动态吸附实验
采用本研究组自制的膜萃取装置[8]进行: 上样前先用200 μL去离子水、200 μL甲醇、200 μL 5%氨水依次对PTS-PPy/PA6 NFs膜进行洗涤活化,然后以3 mL/min的流速将样品溶液通过NFs膜,洗脱吸附在膜上的目标物,取20 μL洗脱液进行HPLC-DAD测定。
3 结果与讨论
3.1 PTS-PPy/PA6 NFs膜的表征
采用SEM观察NFs的表面形态。样品观察前真空干燥48 h,喷金120 s,加速电压3.0 kV。SEM图片采用Image J软件进行处理,计算纤维的平均直径。如图1所示, NFs平均直径随吡咯浓度的增加从200 nm增大到250 nm,其中吡咯浓度为0.10 mol/L时NFs表面光滑,且PPy在PA6分布均匀。改变对甲苯磺酸钠的浓度对PTS-PPy/PA6 NFs直径的影响相对较小,可能是因为对甲苯磺酸离子是通过与聚合物链中亚胺原子成键的方式与聚合物主链相连接,而不是以物理堆积的形式覆于纤维膜表面[16]。当对甲苯磺酸的浓度为0.10 mol/L时可获得表面均匀的PTS-PPy/PA6 NFs。
3.2 pH值对吸附的影响
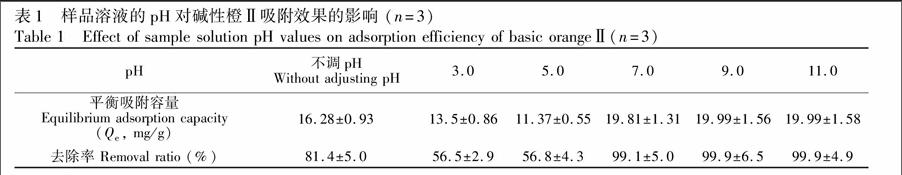
准确称取PTS-PPy/PA6 NFs膜2.5 mg,置于5 mL初始浓度为8.0 μg/mL的碱性橙Ⅱ标准溶液中,调节溶液至pH 3.0~11.0,在298 K恒温静置24 h至吸附平衡,按式(1)和式(3)分别测定去除率和平衡吸附容量,考察最优的pH值。结果如表1所示,碱性条件有利于膜对目标物的吸附。可能的原因是PTS-PPy/PA6 NFs膜中掺杂的对甲苯磺酸基不仅提高了NFs膜的亲水性,还增加了PPy骨架的共轭长度[17],而碱性橙Ⅱ的pKa=5.41,当pH≥7.0时,主要以不带电的分子形式存在于溶液当中[17],此时PTS-PPy/PA6 NFs膜可以通过亲水相互作用和π-π键相互作用对其进行吸附;当pH≤5时,碱性橙Ⅱ在溶液中的主要存在形式是带正电的阳离子,而此时NFs膜的PPy骨架也带正电[11],两者产生静电斥力不利于吸附。故后续实验中所用的溶液在上样前需先调至pH 9。
3.3 静态吸附性能考察
3.3.1 吸附动力学
为了研究该吸附的动力学性质,将实验数据分别用准一级动力学方程(4)和准二级动力学方程(5)进行拟合[14,15\] 。
lg(Qe-Qt) = lgQe-k1t/2.303(4)
t/Qt=1/k2Qe2+t/Qe(5)
其中, Qt为t时刻PTS-PPy/PA6 NFs膜对碱性橙Ⅱ的吸附量(mg/g); Qe为平衡时的吸附量(mg/g); k1为准一级动力学的吸附速率常数, k2为准二级动力学方程的吸附速率常数,单位均为min1。
由表2可知,准二级动力学方程更适合描述PTS-PPy/PA6 NFs膜对碱性橙Ⅱ的吸附过程,提示PTS-PPy/PA6 NFs对碱性橙Ⅱ的吸附是存在饱和位点的反应,当NFs膜表面的吸附位点填满时,吸附容量不再随着溶液中目标物浓度的升高而增加[11]。
3.3.2 吸附等温线 将实验数据分别用Langmuir(6)和Freundlich(7)吸附等温方程进行拟合[14,15]。
CeQe=CeQmax+1[]KLQmax(6)
lgQe=lgKF+1nlgCe(7)
式中, Qmax(mg/g)是饱和吸附量, Ce(μg/mL)是碱性橙Ⅱ吸附平衡时的浓度,Qe(mg/g)是吸附平衡时吸附量,KL (L/mg)为Langmuir方程吸附平衡常数; KF为Freundlich吸附系数, n为吸附常数。结果(见表3)表明,Freundlich模型更适于描述PTS-PPy/PA6 NFs对碱性橙Ⅱ的吸附过程。Freundlich型吸附等温线是基于吸附剂在多相表面上的吸附建立的经验吸附平衡模式,各条件下的n值均大于1,提示吸附剂对目标物具有较好吸附性能[18]。且n值随温度升高而递增,说明吸附反应是一个吸热过程。
3.3.3 吸附热力学
3.3.4 饱和吸附量 碱性橙Ⅱ初始浓度在1.0 ~800 μg/mL的范围,考察了饱和吸附量。发现随着碱性橙Ⅱ初始浓度的增大,PTS-PPy/PA6 NFs膜对碱性橙Ⅱ的吸附量也随之增大,当初始浓度达到400 μg/mL时,吸附量不再增加。计算25℃时的最大吸附量可达372.2 mg/g,较传统吸附材料(如泥炭灰(128 mg/g)[20]、木屑[18](61.5 mg/g)等)在同等条件下获得的碱性橙Ⅱ饱和吸附量更高,且NFs膜在吸附结束后更易收集,不会造成二次污染。
3.4 动态吸附性能考察
3.4.1 洗脱剂的种类及用量的影响 比较了甲醇、5%氨水-甲醇、5%氨水-乙醇、乙酸乙酯、二氯甲烷、乙腈对碱性橙Ⅱ的洗脱效果,实验步骤如2.6节所述,上样溶液的浓度为0.1 μg/mL,上样体积为2 mL,洗脱剂用量为200 μL。结果表明,5%氨水-甲醇洗脱效果最佳。在200~700 μL范围考察5%氨水-甲醇用量对吸附效率的影响,当其用量增加至500 μL时,回收率增至96.84%±3.58%(n=6);继续增加洗脱剂用量,回收率不再增大。故本实验采用500 μL 5%氨水-甲醇进行洗脱。
3.4.2 NFs膜用量的影响 在1.0~3.0 mg范围内对PTS-PPy/PA6 NFs膜用量进行了考察,上样样品为2 mL 0.1 μg/mL碱性橙Ⅱ标准溶液。结果表明,随着吸附剂的用量从1.0 mg增加到2.5 mg,回收率从73.16%±5.45%逐渐增加至99.17%±6.34%(n=3),但NFs膜的用量继续增加时,回收率没有明显增大。表明2.0~2.5 mg的NFs膜已能提供充足的吸附位点。本实验膜用量选择2.5 mg。
3.4.3 突破体积和动态饱和吸附容量 对10~60 mL的样品体积进行了考察,上样样品为0.1 μg/mL 碱性橙Ⅱ标准溶液,膜用量为2.5 mg,每个样品体积平行实验3次。结果表明,样品体积在10~45 mL范围内逐渐增大时,回收率均保持在90.4%±5.7%以上; 当样品体积升至50 mL时,回收率降至79.46%±3.84%,样品体积继续加大至60 mL时,回收率继续下降至70.9%±4.8%。因此PTS-PPy/PA6 NFs膜的突破体积约为45 mL。据此计算PTS-PPy/PA6 NFs膜对碱性橙Ⅱ的动态饱和吸附容量为1.8 mg/g。
3.4.4 NFs膜的重复利用 按2.6节所述进行动态吸附实验后,以1 mL 5%氨水-甲醇、1 mL去离子水对PTS-PPy/PA6 NFs膜进行洗涤,除去上次使用后膜上可能残留的目标物,再进行下一次动态吸附实验,上样样品为2 mL 0.1 μg/mL 碱性橙Ⅱ标准溶液。结果表明,每片PTS-PPy/PA6 NFs膜在前7次使用时回收率可维持在96.86%~104.35%,RSD为4.0%~7.8%(n=3);使用第8次和第9次时回收率则分别降至87.44%±6.38%和74.34%±4.92%。因此认为此材料可高效重复使用7次。
3.5 实际样品的检测
采集6批苏州盛泽某纺织印染厂排放的工业废水样品,以2.6节进行预处理后进行HPLC-DAD检测。同时取10 mL上述各批印染废水样品液作为基底配制加标样品(加标浓度10 ng/mL),分别进行加标回收实验(表5)。结果表明,本方法具有较好的准确度和可靠性。
被检测的6个批次的印染废水样品均检出碱性橙Ⅱ,含量为3.5~16.8 ng/mL,表明碱性橙Ⅱ广泛应用于纺织品染色,建立印染废水中碱性橙Ⅱ的检测方法对于监测评估印染厂所引起的水环境污染具有现实意义。
4 结 论
PTS-PPy/PA6 NFs膜极具优越SPE介质的潜质,可用于碱性橙Ⅱ的样品前处理: 少量(2.5 mg)即可高效吸附目标物,洗脱剂的用量(500 μL)随之减少;洗脱液直接注入分析仪器,不必进行挥干溶剂浓缩和复溶解等操作步骤;NFs膜可直接与商品化的固相萃取仪配合使用,膜式SPE方便处理较大体积样品(45 mL)以获得满意的富集倍数;可重复使用多次,符合经济、环保的要求。
PTS-PPy/PA6 NFs膜对碱性橙Ⅱ的吸附可能是通过亲水和π-π键相互作用,由此可推测其对极性大且分子中含有共轭结构的目标物亦会有较好的吸附效果,可作为此类污染物的SPE介质。
References
1 Fernandez C, Larrechi M S,Callao M P. Trac-Trends Anal. Chem., 2010, 29(10): 1202-1211
2 Puvaneswari N, Muthukrishnan J, Gunasekaran P. Indian Journal of Experimental Biology, 2006, 44(8): 618
3 Piletsky S A, Matuschewski H, Schedler U, Wilpert A, Piletska E V, Thiele T A, Ulbricht M. Macromolecules, 2000, 33(8): 3092-3098
4 Gui W J, Xu Y, Shou L F, Zhu G N, Ren Y P. Food Chem., 2010, 122(4): 1230-1234
5 Augusto F, Hantao L W, Mogollon N G S, Braga S. TRAC-Trends Anal. Chem., 2013, 43: 14-23
6 Tian J Y, Xu J Q, Zhu F, Lu T B, Su C Y, Ouyang G F. J. Chromatogr. A, 2013, 1300: 2-16
7 CAO Yang, YIN Xue-Yan, ZHOU Fang-Qing, QI Fei-Fei, XU Qian. Chinese J. Anal. Chem., 2013, 41(12): 1837-1843
曹 阳, 殷雪琰, 周方晴, 祁菲菲, 许 茜. 分析化学, 2013, 41(12): 1837-1843
8 YIN Xue-Yan, XU Qian, WU Shu-Yan, WANG Min, GU Zhong-Ze. Chem. J. Chinese Universities, 2010, (4): 690-695
殷雪琰, 许 茜, 吴淑燕, 王 敏, 顾忠泽. 高等学校化学学报, 2010, (04): 690-695
9 Xu Q, Wang M, Yu S Q, Tao Q, Tang M. Analyst, 2011, 136(23): 5030-5037
10 Belabed C, Rekhila G, Doulache M, Zitouni B, Trari M. Solar Energy Materials and Solar Cells, 2013. 114: 199-204
11 Yang B Y, Cao Y, Qi F F, Li X Q,Xu Q. Nanoscale Research Letters, 2015, 10
12 Zhang Z M, Zhu L, Ma Y J, Huang Y C, Li G K. Analyst, 2013, 138(4): 1156-1166
13 Mohammadi A, Ameli A, Alizadeh N. Talanta, 2009, 78(3): 1107-1114
14 Matheswaran M, Karunanithi T. Journal of Hazardous Materials, 2007, 145(1-2): 154-161
15 Mittal A, Mittal J, Malviya A, Gupta V K. Journal of Colloid And Interface Science, 2010, 344(2): 497-507
16 Kumar A, Singh R K, Singh H K, Srivastava P, Singh R. Journal of Power Sources, 2014, 246: 800-807
17 Nurchi V M, Crespo-Alonso M, Biesuz R, Alberti G, Pilo M I, Spano N, Sanna G. Arabian Journal of Chemistry, 2014, 7(1): 133-138
18 Taqvi S I H, Hasany S M, Bhanger M Q. Journal of Hazardous Materials, 2007, 141(1): 37-44
19 Ho Y S, McKay G. Can. J. Chem. Engineer., 1998, 76(4): 822-827

