凉州熏醋酿造中高产乙偶姻醋酸菌菌株筛选及其发酵条件优化
赵洪源,贠建民,邵晓庆,齐 丹
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
凉州熏醋酿造中高产乙偶姻醋酸菌菌株筛选及其发酵条件优化
赵洪源,贠建民*,邵晓庆,齐 丹
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
四甲基吡嗪是传统发酵食品中重要风味物质,而乙偶姻(acetoin,ACT)是其生物合成前体。本实验从凉州熏醋醋醅中分离出了200 株产酸菌株,利用Voges-Proskauer(V-P)显色反应法初筛得到了28 株产乙偶姻的菌株,用火焰离子化检测器结合气相色谱(gas chromatograph-fl ame ionization detector,GC-FID)法复筛得到了一株高产乙偶姻的菌株C92,经生理生化和16S rRNA鉴定为巴氏醋酸杆菌(Acetobacter pasteurianus)。在单因素试验基础上使用Design-Expert设计响应面优化试验,得到最佳发酵条件为培养温度31.31 ℃、接种量8.27%、pH 6.55、摇床转速209 r/min,此条件下乙偶姻产量最大,达到19.04 g/L,比原始发酵产量高35.8%,证明C92菌株是一株在食醋酿造过程中具有潜在应用价值的菌株。
凉州熏醋;巴氏醋酸杆菌;乙偶姻;响应面优化
凉州熏醋因其独特的风味而闻名[1],如何增加传统发酵食醋的风味已成为近年来的研究热点[2-3]。前期研究表明,凉州熏醋的特征性风味物质主要为挥发性的四甲基吡嗪,它与其他挥发性成分共同作用,是使凉州熏醋呈现后味厚重悠长特点的物质基础[4]。乙偶姻(acetoin,ACT)又名3-羟基-2-丁酮,是多种微生物糖代谢的中间产物,是传统发酵食品重要香气成分四甲基吡嗪生物合成的前体物质[5-6]。
近年来,有关传统发酵食品中功能性物质的来源及机理已成为本领域研究的重点,如Besson[7]、Larroche[8]等研究发现,通过添加外源的苏氨酸和乙偶姻可以有效提高四甲基吡嗪产量,并对四甲基吡嗪经微生物代谢途径的形成机理进行了研究且两种物质的关联性极大[9]。但外源添加过量乙偶姻,则会导致产物抑制现象和细胞毒性,细胞代谢平衡紊乱[10],导致前体乙偶姻的利用率很低[7]。Zhu Bingfeng等[11]对中国白酒中四甲基吡嗪的微生物产生途径及代谢机理进行了深入研究,验证了中国白酒中四甲基吡嗪产生的主要途径来源于微生物的代谢反应,并非美拉德反应,并证明了乙偶姻和氨是发酵生产四甲基吡嗪的前体物质[12],且二者共同作用发生非酶促反应生成了四甲基吡嗪。
醋酸菌在酿醋过程中发挥着产酸的重要功能,并赋予凉州熏醋特殊的风味物质,在酿醋工业中有着极其重要的作用,而目前关于产高产乙偶姻的醋酸菌的报道较少。Xu Wei等[13]在镇江香醋醋醅中筛选到了1 株产乙偶姻的醋酸菌,Danilo等[14]报道了一株Acetobacter hansenii产乙偶姻量达到8.93 g/L。因此,食醋酿造行业急需开发具有优良风味特性的乙偶姻生产菌株,使其能够利用还原糖代谢产生并内源积累前体乙偶姻,进而实现高产四甲基吡嗪以提高熏醋风味的目标。因此,开发筛选高产乙偶姻的醋酸菌菌株,优化其发酵工艺,对传统酿醋工业的现代化改造过程中风味稳定具有十分重要意义。
1 材料与方法
1.1材料、试剂与培养基
分离材料为甘肃省云晓凉州熏醋传统食醋酿造料醅。
蛋白胨、酵母膏、牛肉膏、琼脂 上海生物工程技术服务有限公司;葡萄糖氧化酶试剂盒 上海执诚生物技术有限公司;2-庚酮、3-羟基-2-丁酮(均为色谱纯) 美国Sigma Aldrich公司;细菌基因组提取试剂盒、普通DNA纯化试剂盒 生工生物工程(上海)有限公司;葡萄糖、肌酸、NaOH、K2HPO4、NaH2PO4均为国产分析纯。
醋酸菌分离培养基:葡萄糖10.0 g/L、酵母膏10.0 g/L、琼脂20.0 g/L、碳酸钙20.0 g/L,121 ℃湿热灭菌30 min,待其冷却为50 ℃后加入3%~5%无水乙醇,分装于无菌培养皿中,制成碳酸钙平板分离培养基。
Voges-Proskauer(V-P)培养基(质量分数):葡萄糖1%、蛋白胨0.5%、KH2PO40.5%,pH值调至7.0,于121 ℃湿热灭菌20 min。
种子培养基(质量分数):葡萄糖2.0%、蛋白胨0.5%、酵母膏1.2%、NaCl 0.05%、MgSO40.15%、MnSO40.02%、KH2PO40.1%、(NH4)2SO40.1%,调pH值至7.0,于121 ℃湿热灭菌20 min。
发酵培养基(质量分数):葡萄糖8.0%、蛋白胨1.0%、酵母膏2%、NaCl 0.05%、MgSO40.15%、MnSO40.02%、KH2PO40.1%、(NH4)2SO40.5%,调pH值至7.0,于 121 ℃湿热灭菌20 min。
1.2仪器与设备
pHS-3C酸度计 上海绿宇精密仪器制造有限公司;HG303-4A电热恒温培养箱 北京市光明医疗仪器厂;CS101-1A型电热鼓风干燥箱 重庆银河试验仪器有限公司;SW-CJ-1FD型单人单面净化工作台 苏州净化设备有限公司;HH-4数显恒温水浴锅 江苏省金坛市荣华仪器制造有限公司;手提式不锈钢蒸汽消毒器上海三申医疗器械有限公司;CP214电子天平 上海奥豪斯仪器有限公司;GC 6890N气相色谱仪、DB-WAX色谱柱 美国Agilent Scientific公司;顶空固相微萃取装置、DVB/CAR/PDMS萃取器 美国Surpelco公司。
1.3方法
1.3.1高产乙偶姻醋酸菌菌株的筛选
1.3.1.1醋酸菌菌株的分离筛选
分离筛选流程:样品采集→取样→梯度稀释→倾注法培养→单菌落分离→醋酸菌定性实验→菌种鉴定→保藏。
称取10 g醋醅样品于已灭菌的装有90 mL无菌生理盐水的500 mL三角瓶中, 30 ℃恒温振荡 30 min,即为10-1稀释菌悬液。取1.0 mL 10-1菌悬液于盛有9 mL无菌水的试管中,依次用无菌水稀释,获得最终稀释倍数为10-2~10-7的培养液。选取3 个合适的稀释度,每个稀释度吸取1 mL菌悬液于灭菌培养皿中,每个稀释度做2 个平行,然后将45 ℃左右的培养基注入平皿中,待琼脂培养基凝固后,倒置于30 ℃恒温培养箱中培养96 h[15]。
1.3.1.2高产乙偶姻菌株的筛选[16]
将以从凉州熏醋醋醅中筛选的醋酸菌株接种于装有50 mL V-P培养基的250 mL摇瓶中,30 ℃条件下150 r/min培养48 h。将发酵液8 000 r/min离心10 min,取上清液加入改良O'Meara试剂,振荡1~2 min,37 ℃条件下反应60 min,观察颜色变化,红色为V-P反应阳性,在最大吸收波长处测定其光密度值,根据光密度值比较初筛菌株的乙偶姻产量。以培养基灭菌后不接种30 ℃培养48 h的样品为对照。选取初筛乙偶姻产量最高的5 株菌株以气相色谱法(gas chromatograph,GC)进行复筛,得到产乙偶姻量最高的醋酸菌菌株。
1.3.2筛出菌株的鉴定[17]
1.3.2.1生理生化鉴定
根据《伯杰氏细菌鉴定手册》[18],对该产酸菌株进行革兰氏染色、芽孢有无、接触酶反应、氧化酶反应、运动性、葡萄糖发酵、乙醇氧化、乙酸氧化、淀粉水解、甘油生酮实验,产葡萄糖酸、产5-酮基葡糖酸盐、GYC产水溶性色素、生二酮葡萄糖酸盐、产γ-吡喃酮实验等生理生化鉴定。
1.3.2.216S rRNA序列分析测定
将提取的基因组DNA委托生工生物工程(上海)有限公司进行16S rRNA基因扩增序列测序。测序结果提交GenBank数据库,将得到的16S rRNA序列通过BLAST程序提交,在NCBI在线数据库中进行同源序列检索[19]。将目标菌株和应用BLAST检索到的与之同源性较高菌株的16S rRNA利用GenBank基因序列作最大同源性比较分析。
1.3.3高产乙偶姻菌株发酵条件优化
1.3.3.1单因素试验优化发酵条件
以初始发酵培养基为基础发酵培养基,在转速为150 r/min的条件下,分别对培养温度、pH值、装液量和接种量(体积分数)进行单因素试验(培养温度分别控制在26、28、30、32、34 ℃;培养基初始pH值分别控制在5.0、6.0、7.0、8.0、9.0;摇床转速分别为90、120、150、180、210 r/min;接种量分别控制在3%、5%、7%、9%、11%),发酵时间为48 h,取样离心,取上清液-20 ℃条件下保存待测。
1.3.3.2响应面优化发酵条件
在单因素条件优化结果的基础上使用Design-Expert对条件因素进行响应面设计,以得到对菌株发酵产乙偶姻有显著影响的因素的最佳组合[20-21]。
1.3.4检测方法
1.3.4.1初筛产乙偶姻的菌株[22]
初筛采用V-P显色配合分光光度计法,将菌株接种于V-P培养基中,在150 r/min条件下,于30 ℃环境中培养48 h,取上清液1 mL,加入1.0 mL改良O'Meara(含0.3%肌酸、0.5%蛋白胨的40% NaOH水溶液)试剂。摇晃2 min,37 ℃条件下反应60 min后观察其颜色变化,反应液呈红色表明有乙偶姻生成。将反应液取出后,摇匀,并测定出反应液在516 nm处具有最大吸收波长。根据516 nm波长处光密 度值的大小判断各菌株代谢葡萄糖生成乙偶姻的能力。
1.3.4.2火焰离子化检测器结合气相色谱(gas chromatograph fl ame ionization detector,GC-FID)复筛高产乙偶姻的菌株
分别配制10、20、40、80、160、320、640 mg/L的乙偶姻标准溶液。分别取5 mL上述溶液,进样GC 6890N气相色谱仪测定。发酵液经离心,取上清液稀释适当倍数,以2-庚酮为内标物,二氯甲烷为萃取剂,进行萃取后通过GC分析定量。气相色谱条件:色谱柱为DB-Wax(15 m×0.25 mm,0.25 μm),进样口与检测器温度均为250 ℃,载气为氮气,流速为2 mL/min,升温程序:80 ℃恒温2 min,再以10 ℃/min的速率升温至200 ℃。
以乙偶姻与内标物响应值之比为纵坐标,乙偶姻质量浓度为横坐标绘制标准曲线,得到回归方程为y=0.006 0x-0.017 2(R2=0.999 2)。
2 结果与分析
2.1菌株筛选结果
2.1.1产酸菌株的筛选结果
通过CaCO3透明圈共从凉州熏醋醋醅中筛选出200 株微生物,将每株菌株进行纯化并保存在斜面中以供使用。
2.1.2V-P反应初筛结果
经V-P反应得到结果呈阳性的醋酸菌菌株28 株,如表1所示,在516 nm波长处测量其光密度值,选取其中OD516nm最大的菌株C92为初筛菌株。

表1 菌株V-P反应初筛结果Table 1 V-P reaction screening of strains
2.1.3GC-FID复筛高产乙偶姻菌株结果
将初筛菌株接种于装有50 mL YPG培养基的250 mL摇瓶中,30 ℃培养48 h。将发酵液8 000 r/min离心10 min,用GC-FID法检测上清液中乙偶姻的含量。以培养基灭菌后不接种30 ℃培养48 h的样品为对照,结果如表2所示,其中C92菌株发酵产乙偶姻的量达到14.02 g/L,高于其他菌株。

表2 GC-FID复筛高产ACT菌株结果Table 2 GC-FID screening of ACT-producing strains
2.2菌株鉴定
2.2.1菌株的生理生化鉴定结果
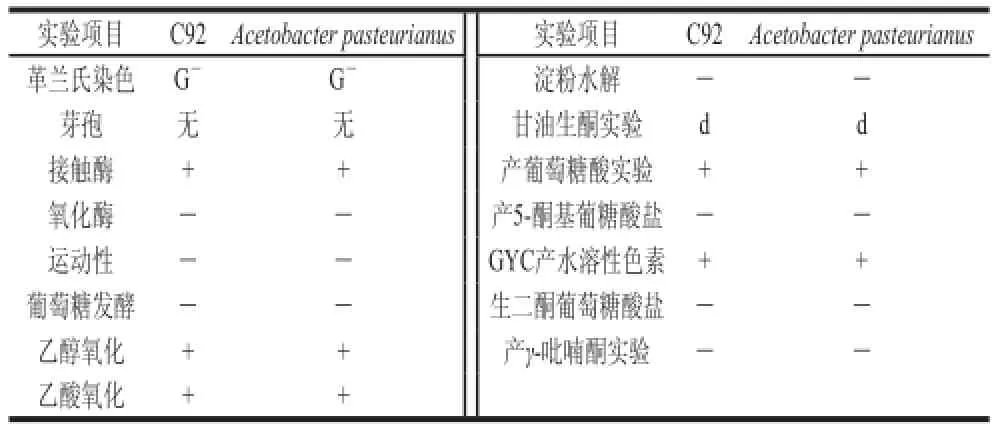
表3 筛出菌株生理生化实验结果Table 3 Physiological and biochemical characteristics of the isolated strain
由表3可知,C92菌株是一株无芽孢、革兰氏阴性、GYC水溶圈阳性的短杆状细菌,通过对比,发现该菌株与Acetobacter pasteurianus特性十分相符。
2.2.2菌株的16S rRNA鉴定结果
对筛出的C92菌株进行16S rRNA基因序列分析鉴定[23],取其基因组DNA进行PCR扩增,对PCR产物进行电泳检测,结果如图1所示。
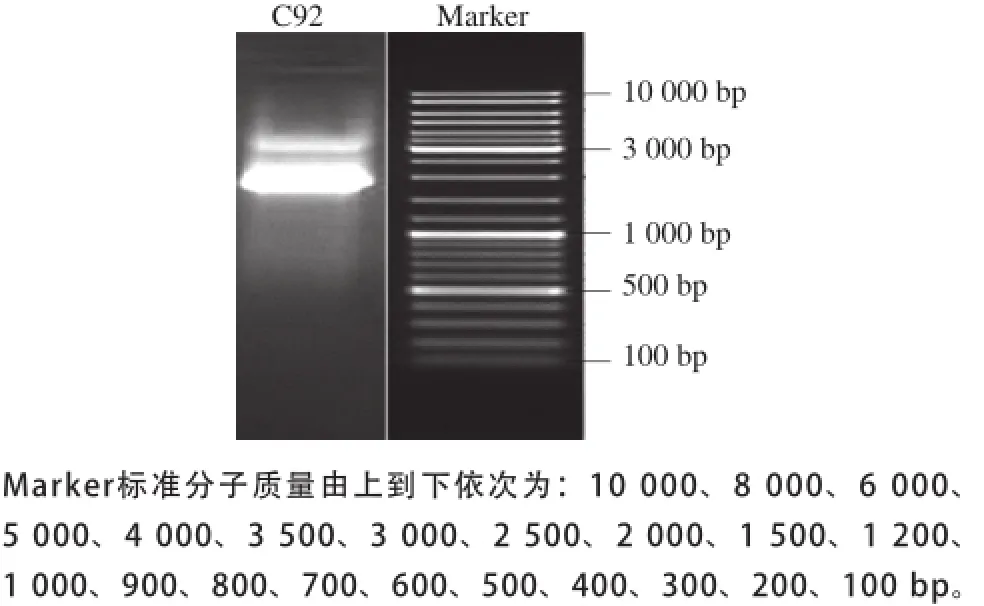
图1 C92菌株的16S rRNA基因序列电泳图Fig.1 Electrophoregram of PCR amplified products of 16S rRNA sequence from strain C92
C92菌株基因组DNA经通用引物扩增和琼脂糖凝胶电泳,在约1 500 bp的位置出现了清晰的条带。将纯化后的PCR产物切胶回收委托生工生物工程(上海)有限公司进行16S rRNA测序,结果显示该条带大小为1 412 bp(GenBank登录号AY883035),提交NCBI数据库进行BLAST序列比对,与巴氏醋酸杆菌(Acetobacter pasteurianus)同源性为99.2%,结合菌落形态和生理生化特征鉴定,确定C92为巴氏醋酸杆菌(Acetobacter pasteurianus)。
2.3产乙偶姻发酵条件的优化
2.3.1单因素试验优化发酵条件

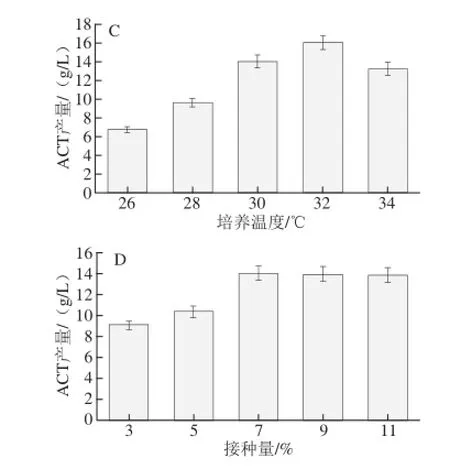
图2 菌株发酵产ACT的单因素试验结果Fig.2 Effects of culture conditions on the yield of ACT
由图2A可知,发酵培养基初始pH值为7.0时,C92菌株产ACT的能力最强,表明稳定的发酵培养基初始pH值有利于C92菌株生长及生成相应的酶,过高或过低的pH值会使得C92菌株代谢异常[24]。由图2B可知,随着摇床转速增大,C92菌株发酵产ACT的量随之增大,在180 r/min达到最大值15.37 g/L,这一结果表明,C92菌株发酵产ACT的量与氧气的供应成正相关,巴氏醋酸杆菌发酵生成ACT为好氧发酵[16]。由图2C可知,当培养温度从26 ℃增加到32 ℃时,ACT产量随之增加,并且在32 ℃时的产量大约是26 ℃产量的2 倍。然而,当培养温度增加到34 ℃时,ACT产量出现下降,这可能是由于细胞调节与代谢异常造成的,随着温度的升高,菌体代谢产生ACT的关键酶活性亦随之提高,但当温度超过32 ℃后,菌体及代谢酶受高温抑制,使ACT产量降低[25]。由图2D可知,ACT的产量随菌株接种量的增大而增加,从3%(9.05 g/L)到7%(14.02 g/L)依次增加,然后保持在稳定的水平不变(9%和11%)。
2.3.2菌株产乙偶姻的响应面设计优化结果
2.3.2.1二次响应面回归模型的建立与分析[26]
根据单因素试验结果,得到菌株在培养温度32 ℃、培养基初始pH 7.0、接种量7%、摇床转速180 r/min时,乙偶姻具有最大产量。采用Design-Expert 8.0软件,选用中心复合模型,对发酵条件做四因素三水平共30 个试验点(5 个中心点)的响应面分析试验,设计方案及结果如表4所示。
经回归拟合后,得到以发酵液中乙偶姻产量为响应值的回归方程为Y=-404.169 4+20.734 2A-1.494 7B+ 15.119 4C+0.496 4D+0.076 5AB+0.645 3AC+ 1.806 3×10-3AD-0.147 3BC-3.304 2×10-3BD-0.016 7CD-0.341 7A2-0.306 2B2-1.414 7C2-7.891 0×10-4D2。

表4 响应面试验设计方案及结果Table 4 Design and results for response surface analysis
用Design Expert 8.0软件对数据进行多元回归分析,其方差分析结果见表5。从表中可以看出,该模型在α=0.01的水平上高度显著,说明模型的预测值和实际值非常吻合,模型成立。各因素中一次项A、B、C、D,交互项AC、BC及二次项A2、B2、C2、D2对乙偶姻产量的影响极显著(P<0.01);交互项 BD 对乙偶姻产量影响显著(P<0.05);而AB、AD、CD的影响不显著。同时回归方程相关系数 R2=0.983 1,模型F=62.33,说明响应值的变化有98.31%来源于所选变量,即培养温度、接种量、培养基初始pH值、摇床转速4 个因素的变化是造成ACT产量不同的主要原因。回归方程失拟项P>0.05,F=1.39,说明未知因素对试验结果干扰很小。因此,该回归方程可以较好地描述各因素与响应值之间的真实关系,可以用其确定最佳发酵条件。
根据表5中各因素对于菌株生产ACT产量影响的F值,可以看出摇床转速对菌株发酵产ACT影响最大,培养温度与培养基初始pH值次之,接种量影响最小。摇床转速影响到培养基中的溶氧情况,对微生物的生长繁殖及代谢产物的生产都有很重要的影响。
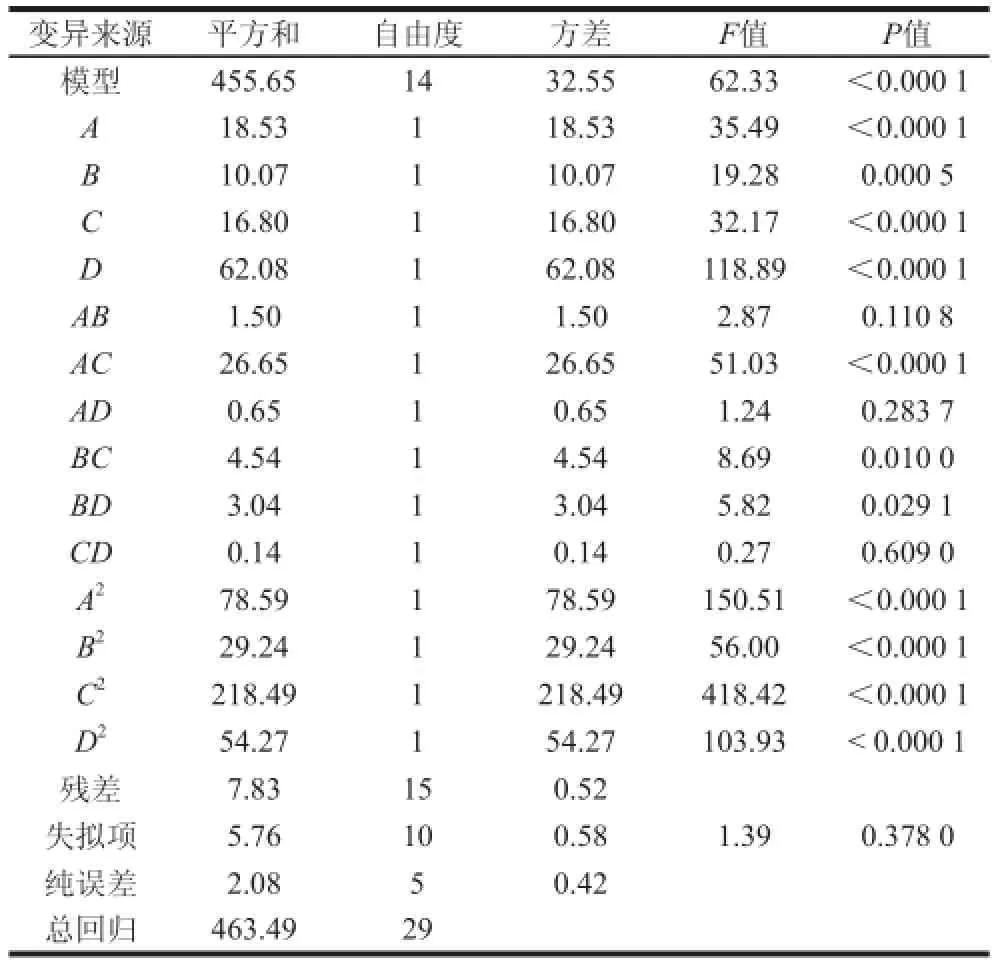
表5 回归模型方差分析Table 5 Analysis of variance (ANOVA) for response surface model
2.3.2.2各因子交互作用对乙偶姻产量影响的分析
响应面法的图形是特定的响应值(Y)与对应的因素A、B、C、D构成的一个三维空间在二维平面上的曲面图,每个响应面对其中两个因素进行分析,另外两个因素固定在零水平。从中可以直观地反映各因素对响应值的影响,从试验所得的响应面分析图上可以找到它们在提取过程中的相互作用,并通过等高线图得最优条件下各试验因子的取值。对培养温度(A)、接种量(B)、培养基初始pH值(C)、摇床转速(D)4 个因素的两两交互作用分析,做出相应的响应曲面图。由培养温度与培养基初始pH值的响应面图(图3a)可知,响应曲面坡度陡峭并且等高线扁而十分密集,说明C92菌株发酵产ACT受到培养温度与培养基初始pH值两因素间交互作用的影响趋势较明显,而由培养基初始pH值与接种量的响应面图(图3b)以及摇床转速与接种量的响应面图(图3c)可知,响应曲面坡度陡峭度降低,等高线密集,说明C92菌株发酵产ACT受该两因素间交互作用的影响,但趋势度降低。该结果与表5的方差分析结果一致。由图3d可知,实际值与预测值的拟合度较高,实验结果真实可靠。
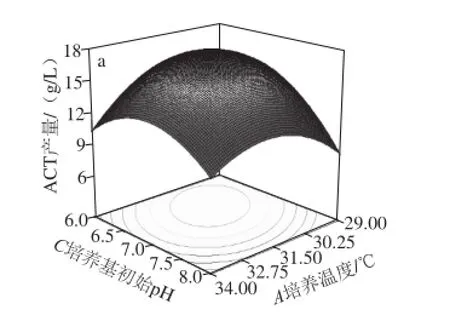
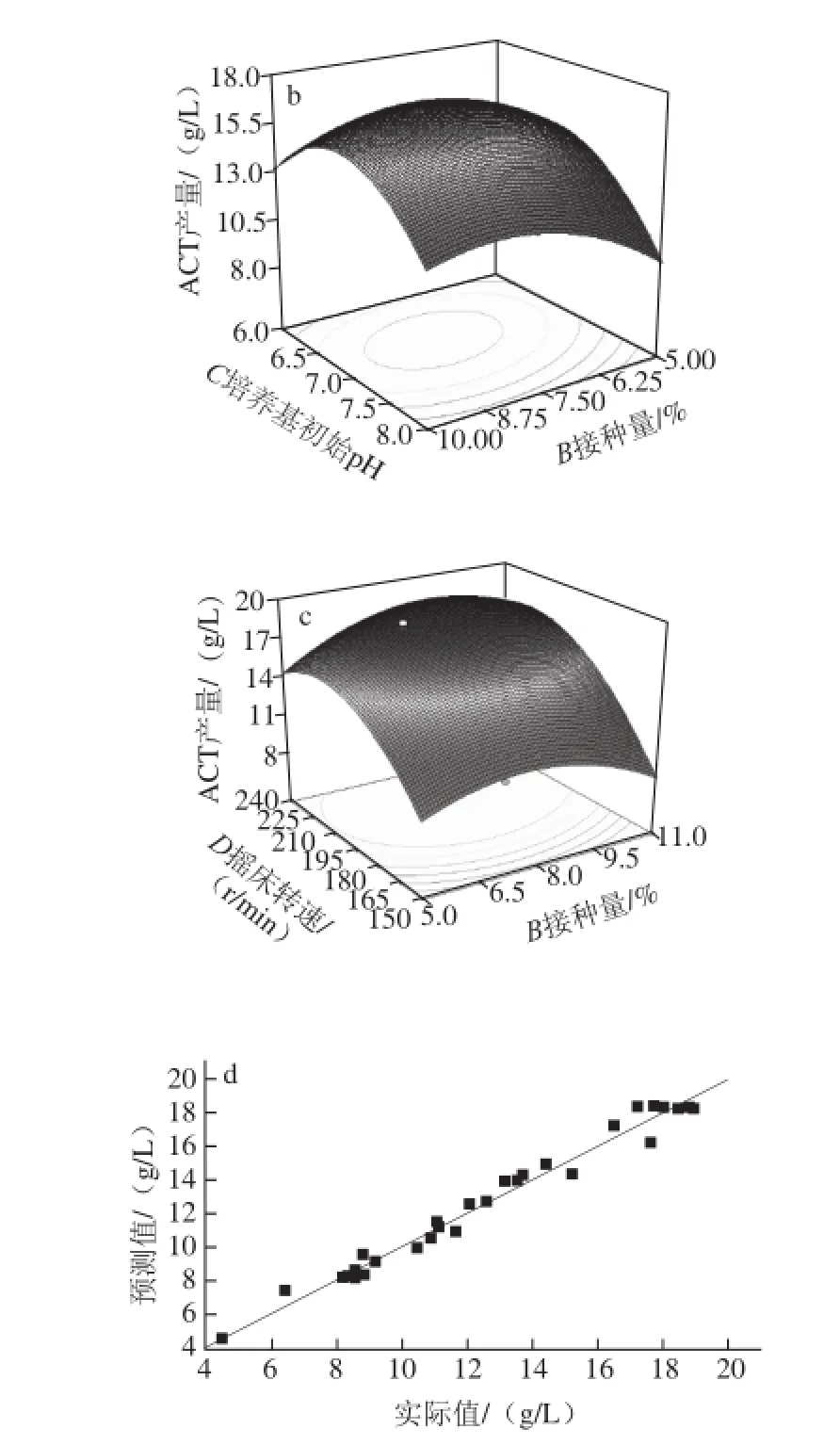
图3 响应面分析因素间交互作用对ACT产量的影响(a~cc)及实际值与预测值的拟合性(dd)Fig.3 Response surface analysis of the effect of interactions among independent variables on ACT yield (a-c) and fitting of actual and predicted values (d)
2.3.2.3最优实验条件产量及验证
通过对回归模型进行方差分析,得 到C92菌株的最佳发酵产ACT条件为:培养温度31.31 ℃、接种量8.27%、培养基初始pH 6.55、摇床转速209 r/min,乙偶姻产量理论值为18.97 g/L。在此条件下,重复3 次实验,得到乙偶姻实际产量为19.04 g/L。与理论预测值相比,其相对误差约为0.36%。而且重复性也很好,说明优化结果可靠。因此,该模型设计合理且结果有效,得到的最佳发酵培养条件可靠,可以为实际生产提供有效的指导。
3 结 论
本实验从凉州熏醋醋醅中分离获得200 株产酸微生物,通过V-P显色反应筛选出28 株可以产生乙偶姻的菌株,使用GC-FID定量检测各菌株产乙偶姻的能力,并对高产菌株进行生理生化及16S rRNA鉴定,确认得到的该高产乙偶姻的菌株为巴氏醋酸菌(Acetobacter pasteurianus)。
在单因素试验的基础上,利用Design Expert 8.0软件设计响应面实验优化A. pasteurianus发酵产乙偶姻的条件。通过方差分析可知,实验中4 个因素对产物产量均有显著影响,A. pasteurianus发酵产乙偶姻的最佳工艺条件为:培养温度31.31 ℃、接种量8.27%、培养基初始pH 6.55、摇床转速209 r/min,此条件下乙偶姻产量最大,达到19.04 g/L,比原始发酵产量高35.8%。因此,本实验分离筛选出的C92菌株具有提高凉州熏醋发酵风味的潜在价值,在食醋生产过程中应用前景广阔。
[1] 陈庆安, 翟丹云. 凉州熏醋的生产技术[J]. 中国调味品, 2001, 26(9):25-26.
[2] 赵良启, 李丽. 我国食醋生产技术的历史、现状与发展趋势(上)[J].中国调味品, 2005, 30(1): 3-6.
[3] 赵良启, 李丽. 我国食醋生产技术的历史、现状与发展趋势(下)[J].中国调味品, 2005, 30(2): 15-17.
[4] 韩庆辉, 贠建民, 宋勇强, 等. 凉州熏醋熏醅前后挥发性成分的变化[J].食品工业科技, 2012, 33(22): 146-151.
[5] ZHU Bingfeng, XU Yan. Production of tetramethylpyrazine by batch culture of Bacillus subtilis with optimal pH control strategy[J]. Journal of Industrial Microbiology & Biotechnology, 2010, 37(8): 815-821.
[6] ZHU Bingfeng, XU Yan. A feeding strategy for tetramethylpyrazine production by Bacillus subtilis based on the stimulating effect of ammonium phosphate[J]. Bioprocess and Biosystems Engineering,2010, 33(8): 953-959.
[7] BESSON I, CREULY C, GROS J B, et al. Pyrazine production by Bacillus subtilis in solid-state fermentation on soybeans[J]. Applied Microbiology and Biotechnology, 1997, 47(5): 489-495.
[8] LARROCHE C, BESSON I, GROS J B. High pyrazine production by Bacillus subtilis in solid substrate fermentation on ground soybeans[J]. Process Biochemistry, 1999, 34(6/7): 667-674.
[9] CHEN Jicheng, CHEN Qihe, GUO Qin, et al. Simultaneous determination of acetoin and tetramethylpyrazine in traditional vinegars by HPLC method[J]. Food Chemistry, 2010, 122(4): 1247-1252.
[10] SCHRADER J. Microbial flavour production[M]//BERGER R G. Flavours and fragrances: chemistry, bioprocessing and sustain-ability. Berlin: Springer, 2007: 507-574.
[11] ZHU Bingfeng, XU Yan, FAN Wenlai. High-yield fermentative preparation of tetramethylpyrazine by Bacillus sp. using an endogenous precursor approach[J]. Journal of Industrial Microbiology and Biotechnology, 2010, 37(2): 179-186.
[12] 徐岩, 范文来, 吴群. 应用内源前体策略提高杆菌发酵制备TTMP的能力[J]. 酿酒科技, 2010(12): 17-22.
[13] XU Wei, HUANG Zhiyong, ZHANG Xiaojun, et al. Monitoring the microbial community during solid-state acetic acid fermentation of Zhenjiang aromatic vinegar[J]. Food Microbiology, 2011, 28(6):1175-1181.
[14] DANILO D F, PAOLO T, FRANCESCO M, et al. Carbon material balances and bioenergetics of 2,3-butanediol bio-oxidation by Acetobacter hansenii[J]. Enzyme and Microbial Technology, 2001,33(5): 708-719.
[15] WU Jiajia, MA Yingkun, ZHANG Fenfen, et al. Biodiversity ofyeasts, lactic acid bacteria and acetic acid bacteria in the fermentation of Shanxi aged vinegar, a traditional Chinese vinegar[J]. Food Microbiology, 2012, 30(1): 289-297.
[16] 齐茂强, 姜兴涛, 刘刚, 等. 利用地衣芽孢杆菌发酵生产3-羟基-2-丁酮初步研究[J]. 食品与生物技术学报, 2010, 29(1): 1673-1689.
[17] 许伟, 张晓君, 许泓瑜. 镇江香醋醋酸发酵过程中细菌群落组成分析[J]. 微生物学通报, 2007, 34(4): 646-649.
[18] BUCHANAN R E, GIBBONS N E. Bergey's manual of determinative bacteriology[M]. Baltimore: Williams and Wilkins Co., 1984:276-278.
[19] HALL T A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT[J]. Nucleic Acids Symposium Series, 1999, 41: 95-98.
[20] AZAMAN S N, RAMANAN R N, TAN J S, et al. Optimization of an induction strategy for improving interferon-alpha 2b production in the periplasm of Escherichia coli using response surface methodology[J]. Biotechnology and Applied Biochemistry, 2010, 56(4): 141-150.
[21] BEZERRA M A, SANTELLI R E, OLIVEIRA E P, et al. Response surface methodology (RSM) as a tool for optimization in analytical chemistry[J]. Talanta, 2008, 76(5): 965-977.
[22] MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry, 1959, 31(3): 426-428.
[23] PRAT C, RUIZ-RUEDA O, TRIAS R, et al. Molecular ☒ngerprinting by PCR-denaturing gradient gel electrophoresis reveals differences in the levels of microbial diversity for musty-earthy tainted corks[J]. Applied and Environmental Microbiology, 2009, 75(7): 1922-1931.
[24] 郝飞, 吴群, 徐岩. 枯草芽孢杆菌(Bacillus subtilis)发酵生产乙偶姻的pH调控策略[J]. 微生物学通报, 2013, 40(6): 921-927.
[25] MOES J, GRIOT M, KELLER J, et al. A microbial culture with oxygen-sensitive product distribution as a potential tool for characterizing bioreactor oxygen-transport[J]. Biotechnology and Bioengineering, 1985, 27(4): 482-489.
[26] 张燎原, 洪欲强, 陈双, 等. 以葡萄糖和木糖为双底物生物合成乙偶姻的条件优化[J]. 化学与生物工程, 2012, 29(7): 30-35.
Isolation of Acetic Acid Bacterium with High Acetoin-Producing Ability from Aerobic Solid-Fermentation Culture of Liangzhou Fumigated Vinegar and Optimization of Its Fermentation Conditions
ZHAO Hongyuan, YUN Jianmin*, SHAO Xiaoqing, QI Dan
(College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)
Acetoin (ACT) is the precursor of tetramethylpyrazine, a popular food flavor found in different traditional fermented foods. In our present study, we isolated approximately 200 pure cultures by forming transparent zone on GYC agar medium, and obtained 28 ACT-producing strains from these isolates by Voges-Prosk auer (V-P ) colorimetric assay and gas chromatograph with fl ame ionization detector (GC-FID). Based on ACT level, C92 strain with the highest yield was selected for further analysis. It was identifi ed as Acetobacter pasteurianus by physiological and biochemical characteristics and 16S rRNA gene sequence similarity. We examined ACT level of C92 strain under different conditions and found that the optimal culture conditions that provided maximum ACT yield of 19.04 g/L were 31.31 ℃, pH 6.55, shaking at 209 r/min,48 h and inoculum size of 8.27%, representing a 35.8% increase compared to that before optimization. Therefore, C92 has a promising potential in the production of vinegar.
Liangzhou fumigated vinegar; Acetobacter pasteurianus; acetoin; response surface optimization
TS264.2
A
1002-6630(2015)15-0098-07
10.7506/spkx1002-6630-201515019
2014-11-19
国家自然科学基金地区科学基金项目(31360405)
赵洪源(1987—),男,硕士,研究方向为食品微生物发酵。E-mail:31593229@163.com
贠建民(1968—),男,教授,博士,研究方向为食品微生物发酵与发酵工程。E-mail:yunjianmin@gsau.edu.cn

