螯合剂对镉在土壤和紫花苜蓿中积累的影响研究∗
任丽娟,柴琳琳,郭昱,李玲
(新疆大学化学化工学院,新疆乌鲁木齐830046)
2014年《全国土壤污染状况调查公报》显示,全国土壤等级为七至十的劣质耕地比例达到27.9%,耕地土壤样品的点位污染超标率达到19.4%[1].其中土壤重金属超标是农耕土壤污染的主要因素.根据《全国土壤环境保护十二五规划》,中央财政计划用于污染土壤修复的专项拨款将达到300亿,由此可见,寻求修复土壤重金属污染解决方法迫在眉睫.目前,国内外用于土壤重金属污染修复的螯合剂主要分为APCAs(氨基多酸类螯合剂)、LMWOAs(生物有机小分子有机酸)两大类.APCAs类如EDTA、DPTA、EGTA是常见的土壤改良剂[2],LMWOAs类有CA(柠檬酸)、GA(没食子酸)等.螯合剂种类不同对植物富集金属的影响效果差别也大,因此要针对重金属种类、土壤环境选择合适的螯合剂[3].王学锋等人的研究表明EDTA投加浓度的提升与Cd活化量的增大有显著相关性(P<0.05)[4],Baylock M J等人的研究发现5.0 mmol/kg EDTA施入100 mg/kg Cd土壤中,能促进印度芥菜体内的Cd富集,且浓度高达2 000 mg/kg[5],但ETDA的投加在促进Cd在向日葵中的富集的同时会导致向日葵等生物量降低、影响植物正常生长[6].柠檬酸(CA)中的羧基与酚醛树脂在螯合重金属方面起到重要作用[7],与对照(CK)相比,20 mmol/kg的有机小分子酸CA能使印度芥菜地上部分Cd富集含量提升2.3倍[8].由于植物根系可释放出GA(没食子酸),与其它螯合剂相比,GA的投加会降低重金属对植物的毒性[9],对环境造成二次污染的可能性将降低.因此,通过投加没食子酸来修复土壤重金属污染的植物修复技术开始受到人们关注.温丽等人近期的研究发现土壤中投加5.0 mmol/kg GA,溧阳苦菜的地上部Cd的富集系数达2.85(超富集植物为>=R1.0),比CK增加了271%[10].这有可能是GA与重金属形成的螯合物可以直接进入植物体内并利于重金属在植物体内的转运[11].
已有的研究表明紫花苜蓿在修复土壤Cd污染方面潜力巨大[12].紫花苜蓿(Alfalfa)适应新疆干旱地区、盐碱土壤生长环境,在新疆许多地区被大面积种植.因此本实验通过采用室内静态吸附和盆栽实验方法,考察了供试土壤中投加螯合剂对紫花苜蓿中Cd富集量的影响,为紫花苜蓿是否可以作为修复土壤Cd污染的植物提供参考.
1 材料与方法
1.1 样品的采集与基本性质
用棋局法采集新疆干旱区某石化污水库周边农田土,取土深度0∼30cm.土壤经自然风干、剔除杂物,过10目、100目筛备用.土壤pH值用电位法测定(水土比=5:1);有机质含量采取重铬酸钾外加热容量法测定;全N含量用全半微量开氏法测定;速效P含量用NaHCO3提取-比色法测定;速效K含量用CH3COONH4浸提-火焰原子吸收法测定.采集的土样基本理化性质如下表1所示.

表1 供试土壤基本性质
1.2 主要试剂及仪器
主要试剂:氯化镉、无水乙醇、冰乙酸、乙酸铵、30%双氧水、无水碳酸钠、盐酸羟胺、氯化镁、氢氧化钠均为分析纯
主要仪器:Rack Mount PC-610 AA7000W火焰原子吸收仪(北京三雄科技公司),TDL-40B台式离心机(上海安亭科学仪器厂),XMTD-204水浴恒温震荡器(江苏金坛市医疗仪器厂),THZ-82B气浴恒温震荡器(江苏金坛市医疗仪器厂),320 pH离子酸度计(梅特勒托利多仪器仪器厂),AB204-N分析天平(Metter-Toledo Group).
1.3 样品分析方法
1.3.1 室内静态吸附
称取1.000 0±0.000 1 g(过100目筛)土样,分别加入1.00 mL浓度分别为5 mg/L、10 mg/L、20 mg/L、30 mg/L的Cd溶液,搅拌均匀,陈化50天,Cd的各个形态按照经典Tessier逐步提取法[13]提取.每个样品均设有三个平行样.
1.3.2 盆栽实验
于封口袋中放置土样0.800±0.001 kg(过10目筛),投加外源Cd使土壤中外源Cd离子浓度达10 mg/kg,陈化50天(期间保持土壤湿度适宜)后开始种植紫花苜蓿.待紫花苜蓿长出三片叶后,留取15株长势较好的小苗,并开始计时.待紫花苜蓿生长60天后,往土壤中投加不同量的螯合剂溶液(0.01、0.05、0.25、0.5、1、5、10、15mmol/kg).继续生长7天,将植株取出洗净,分开根、茎、叶,进行干燥,采用HNO3-HCl-HClO4湿法消解对植物组织消解,原子吸收分光光度法测定Cd浓度.每个样品设有三个平行样.
1.3.3 数据处理
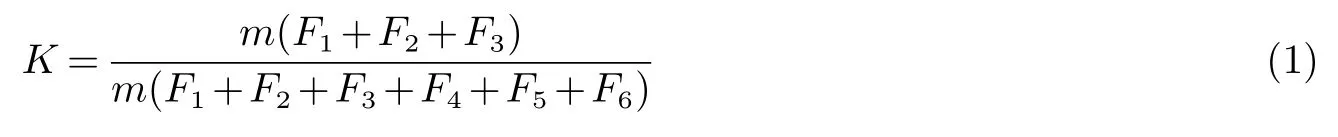
式(1)中:K为生物有效性系数;m为各形态质量;F1为水溶态Cd(mg/kg);F2为可交换态Cd(mg/kg);F3为碳酸盐结合态Cd(mg/kg);F4为铁锰氧化物结合态Cd(mg/kg);F5为有机结合态Cd(mg/kg);F6为残渣态Cd(mg/kg).
转运系数数值等于植株地上组织含Cd总量与植株地下组织含Cd总量的比值.
数据的相关性分析采用软件SPSS 19.0处理,作图采用软件Origin 9.0.
2 结果与分析
2.1 螯合剂对土壤中Cd形态分布及生物有效性的影响
由于土壤中金属的水溶态(F1)、可交换态(F2)、碳酸盐结合态(F3)为金属有效态,其所占比例直接影响到金属在土壤中的迁移性,植物对重金属的富集量也会随之改变.因此,螯合剂对水溶态Cd、碳酸盐结合态Cd、可交换态Cd是金属在土壤中主要被考察的存在形态.

图1 三种螯合剂对土壤中Cd的形态分布影响
如图1所示,随着土壤中EDTA、CA、GA投加量的增大,水溶态Cd含量均有所上升,与CA、GA相比,投加15.0 mmol/kg EDTA时,水溶态Cd达到最大百分比12.77%,与CK相比,水溶态Cd增大了55.17倍(CA:5.46倍,GA:5.38倍).螯合剂投加量的增加对可交换态Cd分布影响不大.与CK相比,投加1.0 mmol/kg的CA,土壤中碳酸盐结合态Cd含量达到最大百分比值29.08%.
重金属的生物有效性系数K是判断金属在土壤中迁移性的重要指标,其数值过大会抑制植物生长,过小时金属与土壤中介质结合稳定,难于被植物吸收、转运[14].图2表明,投加0.05∼1.0 mmol/kg螯合剂时,其对Cd的K值作用大小顺序为EDTA>CA>GA.说明EDTA对Cd的活化效应强于CA、GA;投加(5.0∼15.0 mmol/kg)螯合剂对土壤中Cd的活化度作用大小顺序为:EDTA>GA>CA.
2.2 螯合剂对紫花苜蓿富积Cd及转运能力的影响
螯合剂络合土壤中重金属目的在于提升植物中重金属富集总量,但由于植物种类、土壤性质、螯合剂种类及投加量的综合因素导致螯合剂对植物修复Cd的效果有所差异[15,16],因此土壤中提升的有效态重金属是否可以被植物吸收一直是备受争议.Marschner就认为植物的根不能吸收合成的螯合剂络合物[17].而Blaylock M J则发现土壤中投加10 mmol/kg EGTA后Cd在植物地上部累积量达2 800 mg/kg,是CK的13倍[5].
土壤中螯合剂的投加对紫花苜蓿根富集Cd的影响见图3.由图3可知,紫花苜蓿根中Cd的累积量随着土壤中螯合剂浓度的增大而增大.其中,投加0.01∼1.0 mmol/kg EDTA、CA、GA时,紫花苜蓿根中Cd含量明显增大(与CK相比),增幅分别为45.40%、24.36%、37.87%.投加5.0 mmol/kg EDTA、GA时,紫花苜蓿根中Cd的累积量大小为:EDTA>GA,增幅分别为45.40%、37.87%.当EDTA、GA投加量大于5.0 mmol/kg时,紫花苜蓿根中Cd的累积量变化不大,造成这种结果的原因可能是植物内Cd的螯合物过量存在,致使紫花苜蓿Cd中毒,抑制植物对Cd的富集.与对照相比,考察浓度范围内的CA使紫花苜蓿根富集Cd整体增幅为24.30%,小于EDTA和GA.
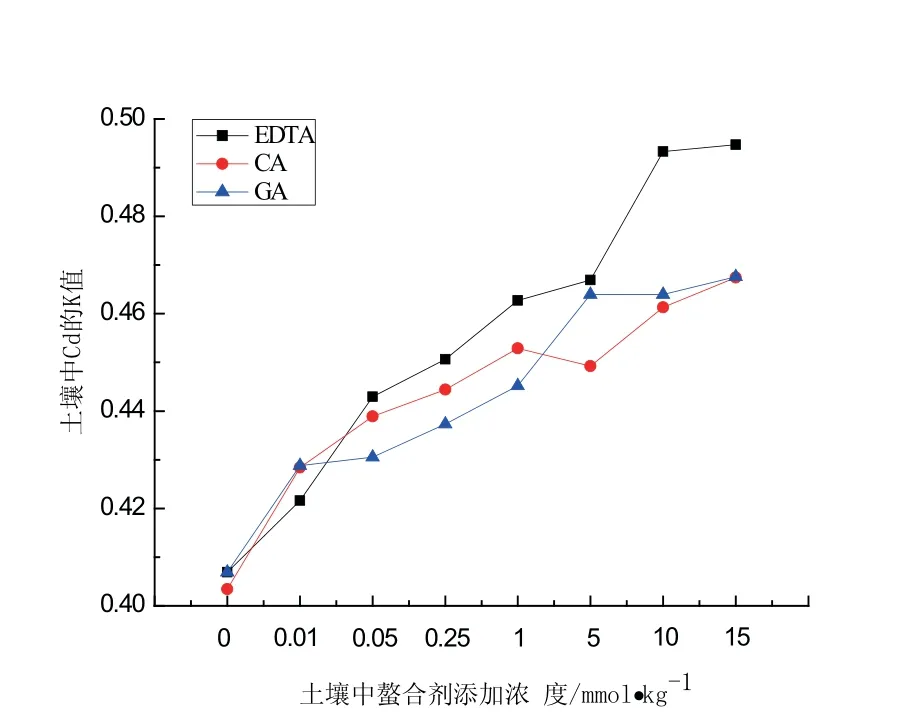
图2 螯合剂的投加对Cd的K值影响
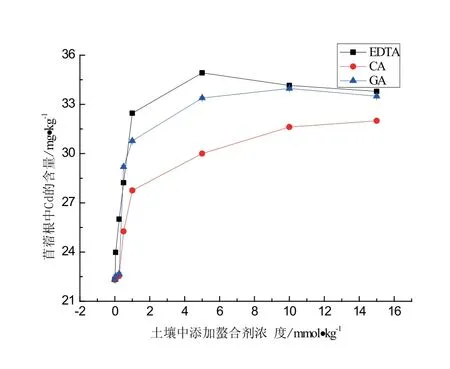
图3 螯合剂对紫花苜蓿根中Cd富集量的影响
植物地上组织重金属富集量大小可判断该植物转运重金属能力.图4表明,土壤中投加1.0 mmol/kg EDTA、GA、CA时,茎对Cd的富集量增幅作用大小为EDTA>GA>CA,其中投加EDTA、GA后的增幅分别达到为31.01%、26.08%(与CK相比).茎中Cd的富集量随CA投加量的上升而增大,但整体增幅小于EDTA、GA.当EDTA、GA投加量大于5.0 mmol/kg时,茎中Cd的积累量结果为:GA>EDTA,表明GA、EDTA投加量大于5.0 mmol/kg时GA对提升茎中Cd的富集量效果强于EDTA.
EDTA、GA、CA的投加均会促进紫花苜蓿叶对Cd的富集(见图5).当螯合剂的投加量在(0∼1.0)mmol/kg时,紫花苜蓿叶中Cd的积累量均随螯合剂浓度的增大呈显著的上升趋势,其增幅大小为:GA(25.58%)﹥EDTA(14.97%)﹥CA(10.79%).投加5.0 mmol/kg EDTA时,紫花苜蓿叶中Cd的积累量达到最大值26.44 mg/kg.
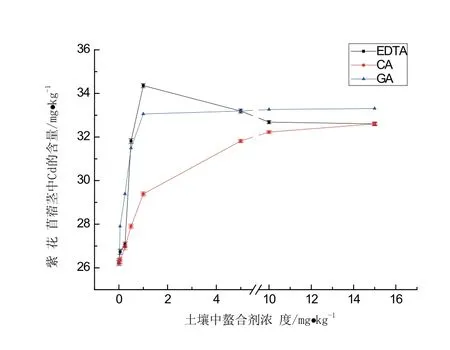
图4 螯合剂对紫花苜蓿茎中Cd富集量的影响
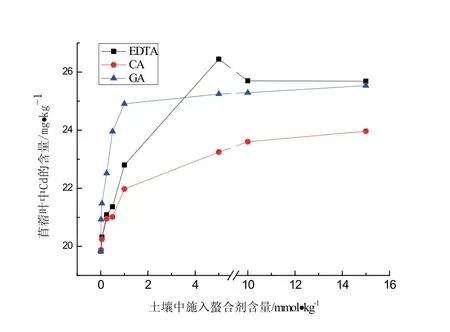
图5 螯合剂对紫花苜蓿叶中Cd富集量的影响
富集系数为植物地上部植物中元素质量分数与土壤中元素质量分数之比,其数值大小表示植物根部将重金属向地上部位转移的能力[18].
图6表明螯合剂的投加均可增大Cd在紫花苜蓿中的富集.由图6-a可知,与CA、GA相比,投加5.0 mmol/kg EDTA时,紫花苜蓿中Cd的富集系数达到较大值1.68;继续添加EDTA,Cd的富集系数开始下降.造成这种结果的原因可能是EDTA与Cd螯合物对紫花苜蓿根部产生了毒副作用,使其向地上部分转运Cd能力下降,从而影响植物的提取效率、影响植物修复土壤中Cd污染的效果[19,20].由图6-b可知,CA投加量在大于0.25 mmol/kg时Cd的富集系数有较明显上升.图6-c说明土壤中投加0∼1.0 mmol/kg GA后,紫花苜蓿中Cd的富集系数呈现明显的上升趋势,大于1 mmol/kg时Cd的富集系数变化不明显.
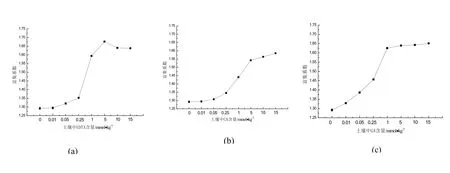
图6 螯合剂对紫花苜蓿中Cd的富集系数影响
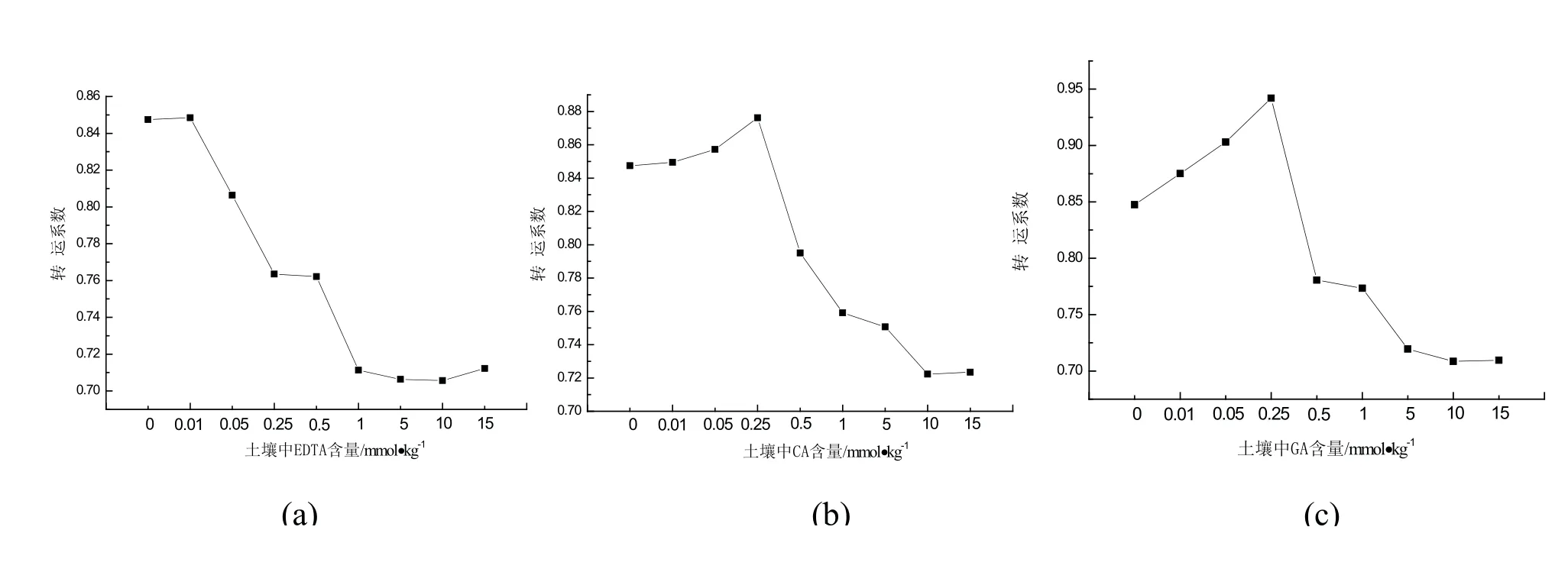
图7 螯合剂对紫花苜蓿转运Cd的系数影响变化
转运系数的数值大小表示根中重金属向地上组织中迁移能力的大小[19].图7-a表明,土壤中EDTA投加量与紫花苜蓿Cd的转运系数呈负的相关性.EDTA的增大抑制紫花苜蓿地上与地下组织中Cd的转运,造成这种结果的原因可能是EDTA与Cd形成螯合物对紫花苜蓿根部产生了毒副作用,使其向地上部分转运Cd能力下降,从而大大影响植物的提取效率,影响植物修复土壤中Cd污染的效果[13,19,20].这与雒焕章的研究即EDTA对杨树根部Cd的累积有抑制作用的结果相似[9].土壤中投加CA、GA,紫花苜蓿Cd的转运系数呈现出先上升后下降的趋势见图7-b与7-c.当CA、GA添加量在0.25 mmol/kg时,转运系数达到最大值分别为0.88、0.94.但当投加量大于0.25 mmol/kg后,转运系数则明显降低.
3 结论
三种螯合剂对新疆干旱区某石化污水库周边农田土中Cd的形态分布有不同影响,且紫花苜蓿对Cd的富集情况也存在较大差异.研究结果表明:
(1)土壤中GA、EDTA投加量为5.0 mmol/kg时,Cd的生物有效性系数较大、活化结果相似.由于EDTA半衰期周期长,易对土壤环境造成二次污染,因此,GA对土壤中Cd的活化效果较好.
(2)在考察浓度范围内,螯合剂投加浓度为0∼1.0 mmol/kg时,紫花苜蓿中Cd的富集量均随螯合剂浓度上升而显著增大.其中,影响紫花苜蓿根、茎中Cd富集量大小为:EDTA>GA>CA,影响叶中Cd富集量大小为:GA>EDTA>CA.
(3)研究表明,与EDTA、CA相比,投加0.25 mmol/kg GA时,紫花苜蓿将Cd从土壤中的转运出的效果较好,转运系数大小为:GA>CA>EDTA.

