刮痧联合放血对热射病大鼠下丘脑HSP-70 mRNA及蛋白的影响*
夏婉 屠文展 程瑞动 何蓉 蒋松鹤△
(1.温州医科大学附属第二医院,浙江温州325027;2.浙江省人民医院,浙江杭州310024)
刮痧联合放血对热射病大鼠下丘脑HSP-70 mRNA及蛋白的影响*
夏婉1屠文展1程瑞动2何蓉1蒋松鹤1△
(1.温州医科大学附属第二医院,浙江温州325027;2.浙江省人民医院,浙江杭州310024)
目的观察背部刮痧结合放血对热射病模型大鼠的影响,检测下丘脑热休克蛋白-70(HSP-70)mRNA及蛋白表达的变化。方法雄性SD大鼠80只,随机分为常温对照组,热应激组,刮痧组,放血组和刮痧结合放血组,每组16只。监测治疗前后动物心率、直肠温度、平均动脉压的动态变化及生存时间。致热休克后20 min后蛋白印迹法和实时荧光定量PCR法观察大鼠下丘脑HSP-70 mRNA及蛋白的表达变化。结果热应激组大鼠存活时间为(23±2)min,刮痧组、放血组及刮痧结合放血组均延长了热应激大鼠的存活时间(P<0.01),以刮痧结合放血组更显著(P<0.01)。与常温对照组比较,热应激后下丘脑HSP-70 mRNA及蛋白表达升高(P<0.01);刮痧组、放血组、刮痧结合放血组后HSP-70 mRNA及蛋白表达均上调,与热应激组比较差异有统计学意义(P<0.01);以刮痧结合放血组HSP-70 mRNA及蛋白的表达上调更显著(P<0.01)。结论对热射病模型进行背区刮痧结合放血治疗可延长生存时间,可能通过上调HSP-70水平,减轻病理损伤而起到治疗作用。
热射病热休克刮痧放血热休克蛋白
热射病俗称中暑,是一种高发病率和高死亡率的急症,主要临床表现为核心体温高于40℃,皮肤干热及中枢神经系统异常,重症患者可出现多器官功能障碍综合征(MODS)[1]。因此,对热射病的预防和治疗非常重要。常用的治疗方法是快速降温和多器官功能支持,降温药物多用氯丙嗪、5-羟色胺激动剂等,但效果并不理想[2]。中医学“中暑”属“痧证”[3],除了中药方剂对中暑有退热和催醒作用外[4-5],针灸、刮痧也是常用的方法。清代《痧胀玉衡》一书指出“其治之大略有两法焉,如痧在肌肤者,刮之而愈;痧在血肉者,放之而愈”[6]。即“痧毒”尚气分者可采用刮痧疗法,重者陷于血分,应当用刺络放血的方法治疗。明·杨继洲《针灸大成》亦指出“卒暴昏沉不省人事……急以三棱针,刺手指十二井穴,当去其恶血”[7]。刮痧和刺络放血法作为一种简便易行的外治法,具有泄热、排毒、祛风的作用。在民间流传不衰,被医家广泛重视[8-9]。但其机制尚不明确,国内外相关研究较少。本课题建立大鼠热射病模型,予刮痧、放血及刮痧联合放血治疗,监测治疗前后心率(HR)、直肠中心温度(Tco)、平均动脉压(MAP)变化,测定各组大鼠生存时间及下丘脑区热休克蛋白(HSP-70)mRNA及蛋白的表达,初步探讨刮痧、放血对热应激大鼠的疗效及相应的病理机制。
1 材料与方法
1.1动物清洁级健康成年雄性SD大鼠80只,体质量(188.1±12.4)g,由温州医科大学实验动物中心提供。
1.2试剂与仪器智能人工气候箱(QHX-150型,上海比朗仪器有限公司),温州医学院公共卫生学院提供;Med-Lab生理记录仪(RM6240C型,成都仪器厂)。兔抗大鼠HSP-70多克隆一抗(美国Millipore公司,AB5895),HRP标记山羊抗兔IgG(H+L)(上海碧云天公司,A0208)。实时荧光定量PCR仪(Applied Biosystems 7500型,美国)。
1.3分组与造模将大鼠随机分为5组,每组16只。各组大鼠造模前予5%水合氯醛(0.6 mL/100 g体质量)腹腔注射麻醉。右股动脉置管,连接Powlab/8 sp生理记录仪,监测心率、直肠温度及中心动脉压变化。常温对照组大鼠置于26℃室温,将其余4组放入43℃仿真热气候动物舱进行热暴露,致热休克后,再置于26℃的室温下,热应激组不予任何治疗。其他3组大鼠备皮后,刮痧组:以牛角刮痧板沿膀胱经背部第一、第二侧线(平风门至肾俞)刮30次至紫;放血组:取前肢十宣穴、大椎穴、委中穴用三棱针各放血5~6滴;刮痧结合放血组:先予上述刮痧后再行放血治疗。
1.4标本采集与检测
1.4.1生理指标记录各组大鼠右股动脉置管,连接Powlab/8 sp生理记录仪实时监测实验动物心率、直肠温度及平均动脉压。参照文献[10-11],以平均动脉压从峰值下降25 mmHg的时刻作为热休克开始,以心率消失或血压为零作为死亡标准。每组8只大鼠记录热休克后至死亡时间作为大鼠生存时间。未死亡者观察截止至480 min。
1.4.2HSP-70检测其余每组8只大鼠热休克后20 min,立即腹腔注射过量10%水合氯醛麻醉,冰上迅速分离出下丘脑。1)蛋白印迹(Western blotting)法检测下丘脑HSP-70蛋白表达。在冰上将下丘脑用组织裂解液研碎,充分裂解,4℃,12000 r/min离心5 min,取上清,BCA法测定蛋白浓度。各样本按60 μg/15 μL蛋白上样,积层胶电泳电压为70 V,分离胶电泳电压为120 V,电泳后300 mA湿转45 min,5%脱脂奶粉室温封闭2 h,TBST漂洗3×5 min,兔抗大鼠HSP-70多克隆一抗(1∶1000)4℃孵育18 h,TBST漂洗3×10 min后室温下HRP标记山羊抗兔二抗(1∶2000)孵育1 h,TBST漂洗3×10 min,滴加ECL显色,DNR MicroChemi化学发光凝胶成像系统成像。用Alpha Ease FC(Fluorchem FC 2)软件进行分析,结果以HSP-70蛋白和内参GAPDH平均光密度值的比值表示该蛋白的相对表达水平。2)实时荧光定量PCR检测下丘脑HSP-70 mRNA的表达。采用Trizol法,按照试剂盒说明书提取下丘脑组织RNA。紫外分光光度计测定提取RNA在260 nm和280 nm的吸光度值(OD),计算RNA的纯度和浓度。用Premier 5.0设计引物,GAPDH引物序列:上游引物5′-ATGGTGGGTA TGGGTAGTCGA-3′,下游引物5′-ACCCTCATA GATGGGCAGAGGCAC-3′。HSP-70引物序列:上游引物5′-CTGACAAGAAGAAGGTGCTGG-3′,下游引物5′-AGCAGCCATCAAGAGTCTGTC-3′。反应体系为20 μL,包括DEPC-H2O 8 μL SYBR Premix Ex TaqTMⅡ(2×)10 μL,上游引物(浓度0.2 μmol/L)0.5 μL,下游引物(浓度0.2 μmol/L)0.5 μL和cDNA模板1 μL。反应体系循环参数为94℃预变性10 s,94℃变性5 s,60℃退火及延伸20 s,共反应40个循环。使用SYBR GreenⅠ进行荧光标记,通过RT-qPCR对HSP-70 mRNA表达量进行测定,GAPDH为内参照,结果使用标准曲线相对定量法进行分析,计算目的基因的相对表达量。
1.5统计学处理采用SPSS19.0统计软件。计量资料以(±s)表示,数据用单因素方差分析后进行LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1大鼠生存时间观察见表1。热应激组大鼠存活时间为21~25 min。刮痧组、放血组及刮痧结合放血组均延长了热应激大鼠的存活时间(P<0.01),以刮痧结合放血组更显著(P<0.01)。
表1 各组大鼠生存时间比较(min,±s)

表1 各组大鼠生存时间比较(min,±s)
与刮痧结合放血组比较,*P<0.01;与热应激组比较,△P<0.01。下同。
组别n生存时间常温对照组8480±3热应激组823±2刮痧组8170±34*△放血组856±17*△刮痧结合放血组8230±22△
2.2各组大鼠心率、直肠温度、MAP变化见图1。造模各组大鼠均在热应激60 min后左右MAP达到峰值,随后急剧下降,以MAP从峰值下降25 mmHg的时刻作为热休克开始,70 min后左右开始出现热休克。随着环境温度的上升,热应激各组大鼠Tco、HR先显著升高,热应激后70 min达到峰值,各组之间差异无统计学意义。热休克组大鼠Tco、HR达峰值后急剧下降,出现循环衰竭。热休克100 min,刮痧组、放血组及刮痧结合放血组MAP、HR下降幅度较热应激组小,刮痧组及刮痧结合放血组Tco下降幅度较热应激组快,差异有统计学意义(P<0.01)。
2.3各组大鼠下丘脑HSP-70蛋白的表达见图2,表2。各组中均观察到在分子量72 kDa处有免疫阳性条带,与已知的HSP-70蛋白相对分子量符合。与常温对照组比较,热应激后大鼠下丘脑HSP-70蛋白表达均上调(P<0.01)。刮痧组、放血组及刮痧结合放血与热应激组比较HSP-70蛋白表达均增强,差异有统计学意义(P<0.01)。与刮痧组及放血组相比,刮痧结合放血组HSP-70蛋白表达最高,差异有统计学意义(P<0.01)。
2.4各组大鼠下丘脑HSP-70mRNA的表达见表3。实时荧光定量PCR定量显示热应激后20 min各组大鼠下丘脑HSP-70 mRNA表达明显高于常温对照组(P<0.01);与热应激组比较,刮痧组、放血组和刮痧结合放血组大鼠HSP-70 mRNA表达均增强,差异有统计学意义(P<0.01)。与刮痧组及放血组相比,刮痧结合放血组HSP-70mRNA表达最高,差异有统计学意义(P<0.01)。
3 讨论
刮痧是在中医经络腧穴理论指导下,用特制的器具,在体表进行相应的手法刮拭,出现皮肤潮红或暗红色的血斑、血泡等出痧变化,达到活血透痧、防治疾病等的一种外治法[12]。刮痧出痧的过程是一种血管扩张渐至毛细血管破裂,即自体溶血,形成一种新的刺激素,能加强局部的新陈代谢[13]。刮痧施术部位在经络皮部,刮痧出痧过程与络脉密切相关[14]。躯干背部膀胱经是刮痧疗法的常用部位,此处血供主要来自肌皮穿支。刮痧出痧时,穿动脉的分支扩张破裂,血液外溢,由于背区体被组织厚而致密,易产生一个延缓的良性刺激过程[15-16]。刮痧可使血管神经受到刺激使血管扩张,血流及淋巴液增快,加快热量散发。
明代张景岳的《景岳全书·杂证谟》写道“针灸法,刺委中穴出血,或刺十指头出血,皆是良法。今东南人有括沙之法,以治心腹急痛。盖使寒随血聚,则邪达于外而脏起始安,此亦出血之意也”。放血有泄热作用[17],热射病最主要的治疗就是迅速降低核心体温,降温速度与热射病的死亡率直接相关[18]。本实验结果显示,刮痧联合放血组大鼠降温速度明显快于其余各组,可能是由于两种治疗结合有促进作用。
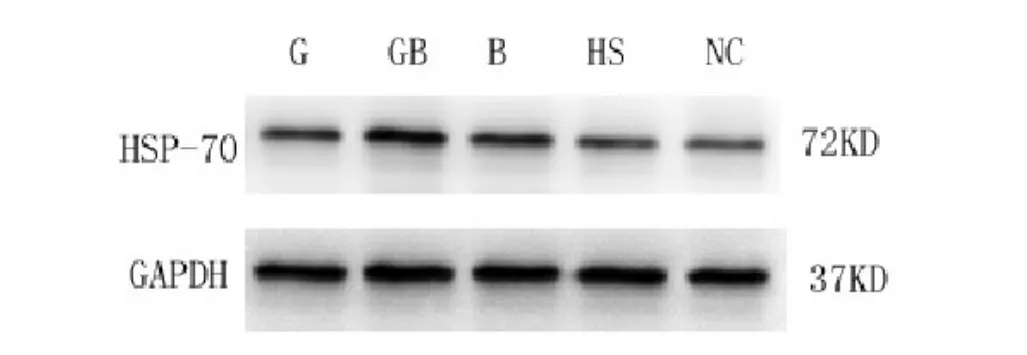
图2 Western blotting法检测大鼠下丘脑HSP-70蛋白的表达
表2 各组大鼠下丘脑HSP-70蛋白表达(相对光密度值,±s)

表2 各组大鼠下丘脑HSP-70蛋白表达(相对光密度值,±s)
组别nHSP-70蛋白常温对照组80.181±0.064热应激组80.352±0.044刮痧组80.735±0.102*△放血组80.790±0.069*△刮痧结合放血组80.912±0.106△
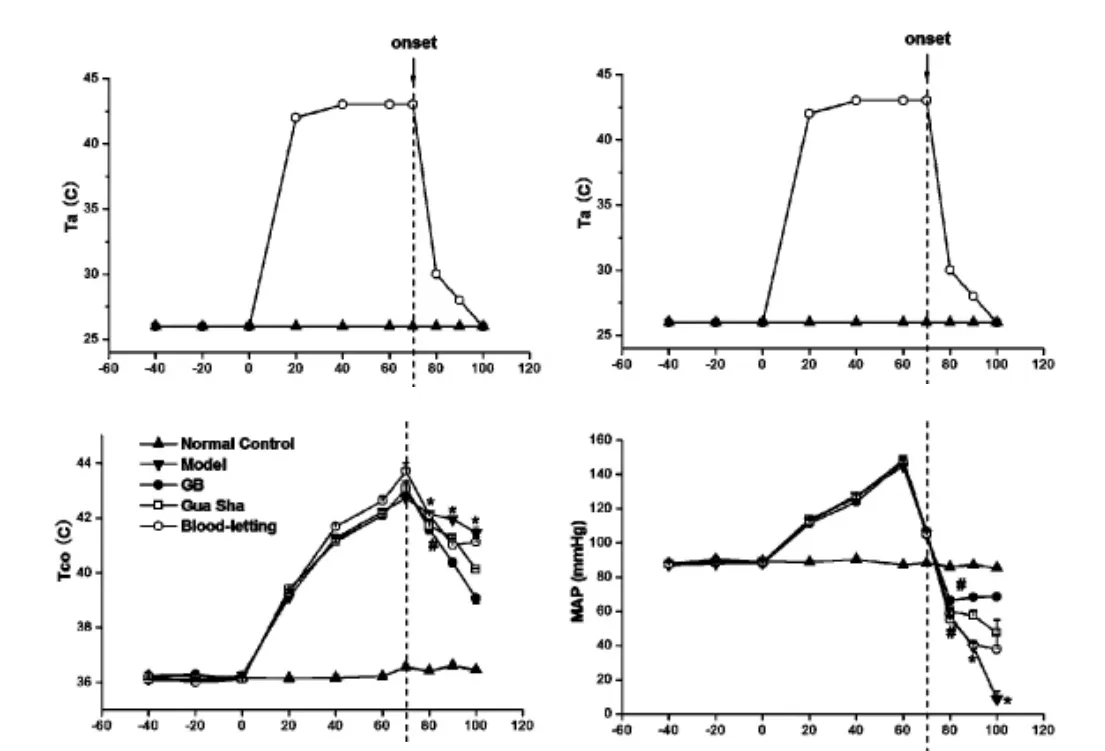
图1 环境温度与各组大鼠心率、直肠温度、中心动脉压变化
表3 各组大鼠下丘脑HSP-70 mRNA表达(相对表达量值,s)
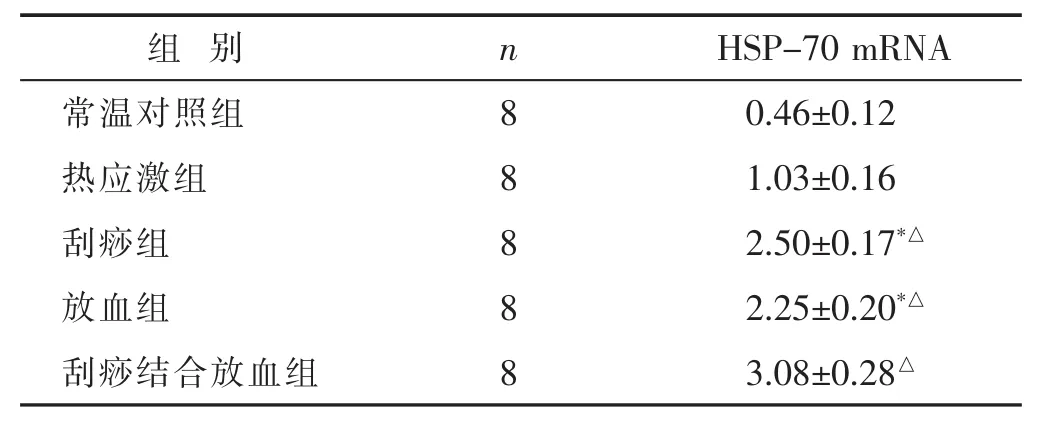
表3 各组大鼠下丘脑HSP-70 mRNA表达(相对表达量值,s)
组别nHSP-70 mRNA常温对照组80.46±0.12热应激组81.03±0.16刮痧组82.50±0.17*△放血组82.25±0.20*△刮痧结合放血组83.08±0.28△
机体受到热应激能够合成或增加合成热休克蛋白。热应激引起蛋白质结构损伤,暴露出与热休克蛋白结合位点,热休克蛋白与受损蛋白结合释放游离的热休克转录因子,启动热休克蛋白的转录合成,热休克蛋白对细胞产生“分子伴侣”作用[19-20]。增多的热休克蛋白可以帮助蛋白质正确折叠、移位、维持和降解,促进受损蛋白质的修复和移除,避免细胞遭受高温、缺血缺氧、内毒素、炎性细胞因子等的破坏。如果机体内热应激蛋白水平在应激状态下不能迅速显著升高,就会发生中暑[21]。
热休克蛋白按相对分子量大小分为以下几个家族:HSP-100、HSP-90、HSP-70、HSP-60、小分子HSP和泛素,其中HSP-70是热应激蛋白家族中含量最丰富的一种。在高温或强辐射热等条件下,HSP-70基因被激活,HSP-70的表达水平升高,缓解内毒素造成的血管通透性改变,抑制炎症介质TNF-α的释放[22-23]。
本实验结果显示,热损伤后给予刮痧联合放血处理可能抑制HSP-70蛋白的表达,从而可能通过调节中暑时的急性病理生理改变、炎症反应及发挥分子伴侣功能、抗氧化功能及抗凋亡作用而减轻高温对大鼠的热损伤,因而延长大鼠热损伤后在室温环境中的存活时间。热应激后予背区刮痧结合放血治疗可延长生存时间,可能通过上调HSP-70水平,减轻病理损伤而起到治疗作用。
[1]Hsiao SH,Chang CP,Chiu TH,et al.Resuscitation from experimental heatstroke by brain cooling therapy[J].Resuscitation,2007,73(3):437-445.
[2]陈旭,周欣.中暑防治研究进展[J].中国药业,2011,20(16):91-92.
[3]赵树新,杜桂琴.醒脑静注射液治疗重症中暑38例[J].中国中西医结合急救杂志,2000,7(4):293-295.
[4]汪克敏.清开灵注射液在急症抢救中的应用近况[J].中国中西医结合急救杂志,2002,9(3):178-179.
[5]荣鹏,孟建中,陈宇.热射病的发病机制及防治策略的研究新进展[J].生物医学工程研究,2010,29(4):287-292.
[6]郭志邃.《痧胀玉衡·玉衡要语·治痧三法》卷上.清康熙十四年乙卯刻本.
[7]阮志强,崔悦宁.中暑的刮痧疗法[J].宁德师专学报:自然科学版,2005,17(4):410-412.
[8]王凤玲.十宣穴放血为主抢救急性中暑2例[J].针灸临床杂志,2002,18(8):49.
[9]辛克平,徐瑞祥.中医疗法治疗中暑高热60例疗效观察[J].广西中医药,2007,30(2):18-20.
[10]Yang TH,Shih MF,Wen YS,et al.Attenuation of circulatory shock and cerebral ischemia injury in heat stroke by combinationtreatmentwithdexamethasoneandhydroxyethyl starch[J].Experimental&Translational Stroke Medicine,2010,2(1):19.
[11]Yang CY,Lin MT.Oxidative stress in rats with heatstroke-induced cerebral ischemia[J].Stroke,2002,33(3):790-794.
[12]杨金生,王莹莹.“痧”的基本概念与刮痧的历史沿革[J].中国中医基础医学杂志,2007,13(2):104-106.
[13]徐青燕,杨金生,杨莉,等.委中穴区刮痧对本经同侧经脉线上皮肤微循环血流灌注量的影响[J].针刺研究,2013,38(1):52-56.
[14]杨金生,赵美丽,王莹莹,等.痧胀玉衡痧症辨证论治研究[J].中华医史杂志,2007,37(2):76-79.
[15]余汝堂,楼新法,唐茂林,等.躯干背区刮痧的血管解剖学研究[J].温州医学院学报,2008,38(2):151-153.
[16]Nielsen A,Knoblauch NT,Dobos GJ,et al.The effect of Gua Sha treatment on the microcirculation of surface tissue:a pilot study in healthy subjects[J].Explore(NY),2007,3(5):456-466.
[17]Ahmed SM,Madbouly NH,Maklad SS,et al.Immunomodulatory effects of blood letting cupping therapy in patients with rheumatoid arthritis[J].Egypt J Immunol,2005,12(2):39-51.
[18]Zhih-Cherng Chen,Wen-Shian Wu,Mao-Tsun Lin,et al. Protective effect of transgenic expression of porcine heat shock protein 70 on hypothalamic ischemic and oxidative damage in a mouse model of heatstroke[J].BMC Neuroscience,2009,10:111.
[19]Kobba S,Kim SC,Chen L,et al.The heat shock paradox and cardiac myocytes:role of heat shock factor[J].Shock,2011,35(5):478-484.
[20]李锐,李润玖,张彧,等.热休克蛋白70在大鼠肾缺血/再灌注损伤中的表达及血必净注射液干预作用的研究[J].中国中西医结合急救杂志,2008,15(5):293-295.
[21]Lam KK,Cheng PY,Lee YM,et al.The role of heat shock protein 70 in the protective effect of YC-1 on heat stroke rats[J].Eur J Pharmacol,2013,15(1-3):67-73.
[22]Liebelt B,Papapetrou P,Ali A,et al.Exercise preconditioning reduces neuronal apoptosis in stroke by up-regulating heat shock protein-70(heat shock protein-72)and extracellularsignal-regulated-kinase 1/2[J].Neuroscience,2010,166(4):1091-1100.
[23]Wang LC,Chang CP,Chio CC,et al.Hypobaric hypoxia preconditioning attenuates experimental heatstroke syndromes via preinduction of heat shock protein 70[J].Am J Med Sci,2012,344(5):383-390.
Effect of Combination Treatment with Guasha and Blood-letting on the Expression of HSP-70 in the Hy-pothalamus of Rats during Heat Stroke
XIA Wan,TU Wenzhan,CHENG Ruidong,et al.The Second Affiliated Hospital of Wenzhou Medical University,Zhejiang,Wenzhou 325027,China
Objective:To assess the therapeutic effect of Guasha on the back combined with blood-letting at EX-UE11(shixuanon)on heat stroke.Methods:80 male SD rats,immediately after the onset of heatstroke,were divided into 5 groups:the control group,the heat stress group,the Guasha group,the blood letting group and the combination group of Guasha and blood-letting,with 16 rats in each.The dynamic changes of heart rate,rectal temperature,mean arterial pressure and survival time were detected before and after treatment.20 minutes after heat stoke,the expressed variation of HSP-70 protein were detected by Western blotting and measured by RT-qPCR.Results:In the heat stress group,their survival time was found to be 21 to 25 minutes.The survive time was also extended in the the Guasha group,the blood letting group and the combination group of Guasha and blood-letting,especially in the combination group of Guasha and blood-letting.Compared with the control group,there were increased expressions of HSP-70 gene and protein in the other 4 groups(P<0.01).There was significant difference among the other 4 groups in the expressions of HSP-70 gene and protein(P<0.01).Conclusion:The results indicate that the resuscitation of Guasha combined with blood-letting at the time point of onset of heat stroke may improve survival.The expressions of HSP-70 gene and protein in the hypothalamus of rats are closely related to the pathologic development of heat stroke.
Heat stroke;Heat shock;Guasha;Blood-letting;Heat shock protein
R245
A
1004-745X(2015)11-1902-04
10.3969/j.issn.1004-745X.2015.11.007
2015-07-07)
浙江省中医药科技计划项目(2009YB023)
(电子邮箱:jshwz@126.com)

