颅咽管瘤鸡胚绒毛尿囊膜移植瘤模型的建立☆
颜小荣 康德智 林元相 潘军 吴喜跃 周杰 江常震 漆松涛
颅咽管瘤鸡胚绒毛尿囊膜移植瘤模型的建立☆
颜小荣*康德智*林元相*潘军△吴喜跃*周杰※江常震*漆松涛△
目的 初步建立颅咽管瘤鸡胚绒毛尿囊膜(chorioallantoic membrane CAM)移植瘤模型,并评估移植瘤血管生成能力及细胞增殖能力。方法利用术中所得颅咽管瘤组织,异种移植到鸡胚CAM表面,建立移植瘤模型。对移植瘤瘤体周围CAM血管进行测定,评估移植瘤CAM血管生成能力,同时利用免疫组化法以CD34标记移植瘤微血管密度(microvessel density,MVD),以PCNA检测移植瘤细胞增殖活性。结果 成功建立颅咽管瘤CAM移植瘤模型,造釉细胞型颅咽管瘤成瘤率为47.14%,鳞状上皮型颅咽管瘤成瘤率为43.33%,两者无显著差异(χ2=0.123,P=0.726);造釉细胞型移植瘤瘤周CAM血管生成能力,微血管密度及细胞增殖活性均高于鳞状上皮型移植瘤。移植瘤PCNA的表达与MVD(Pearson r=0.639,P<0.001)及CAM血管评分(Spearman r=0.490,P= 0.001)呈正相关。结论 采用异位异种移植的方法可在鸡胚CAM上建立颅咽管瘤移植瘤模型。移植瘤可不同程度地刺激CAM上血管生成,移植瘤自身可建立微循环,具有一定的增殖能力。
颅咽管瘤 鸡胚绒毛尿囊膜 血管生成 增殖
颅咽管瘤(craniopharyngioma,CP)是儿童颅内最常见的先天性肿瘤之一,多好发于鞍区,占颅内肿瘤的3%左右[1],在所有儿童颅内肿瘤中约占5%~15%[2]。颅咽管瘤属于良性肿瘤,但其临床治疗效果不佳,术后常伴有严重的并发症,且易复发。目前,颅咽管瘤科研工作中尚缺乏稳定的永生细胞系作为研究载体,已有动物模型主要是利用原代细胞接种于裸鼠皮下进行成瘤,但其仍存在成瘤率相对较低等缺陷。因此进一步探索发展可靠实用的动物模型对颅咽管瘤相关基础研究的突破具有重要意义。鸡胚绒毛尿囊膜(chorioallantoic membrane,CAM)是鸡胚进行气体交换的重要媒介。在鸡胚开始孵育后的4~5d,来源于尿膜的中胚层外层上皮与来源于外胚层的绒毛膜上皮融合,形成CAM[3]。由于在CAM的发展过程中,伴随着旺盛的新生血管的产生及动静脉血管网形成,因此CAM模型是血管生成及抑制相关研究的理想模型。在本研究中,我们将颅咽管瘤组织移植到CAM上,通过体式显微镜下连续观察移植瘤的生长,对移植瘤刺激CAM血管生成的能力进行观察和半定量分析;同时采用免疫组化法以CD34标记移植瘤微血管密度(microvessel density,MVD),以PCNA检测肿瘤细胞增殖活性。
1 材料与方法
1.1肿瘤组织的准备 10例CP均取自南方医院神经外科颅咽管瘤手术新鲜标本,经术后病理证实,7例为造釉细胞型(adamantinomatous craniopharyngioma,ACP),3例为鳞状上皮型(squamous papillary craniopharyngioma,SPCP)。手术切取CP后迅速投入含有100U/mL青霉素和100U/mL链霉素的磷酸盐缓冲液(phosphate buffered saline,PBS)当中。在超净台中将CP剪成约1.5mm×1.5mm×1.5mm大小的组织块4℃保存备用,每例肿瘤标本拟接种于10枚鸡胚蛋中。
1.2鸡胚的准备及肿瘤的接种 实验所用胚蛋购自广州市粤禽育种有限公司,均为孵育7d龄粤黄鸡受精鸡蛋,进行操作前用新洁尔灭浸泡胚蛋10min后,放置于孵育箱内,温度保持在37℃,湿度70%~80%。实验时将胚蛋置于操作蛋架上,使胚蛋钝端朝上,用锉在钝端最高处锉出一小口后,用眼科镊将蛋壳及外层壳膜去除,形成一个1cm× 1cm大小缺口,暴露气室,用洗耳球将掉落在气室内壳膜上的蛋壳碎片吹出。滴少许生理盐水于气室底面的内层壳膜,待生理盐水渗入内层壳膜与CAM之间后,以显微镊轻挑壳膜褶皱处,将壳膜撕开,剪除,暴露CAM。将CP组织接种于CAM上血管丰富处。用灭菌透明胶布封闭蛋壳开口,放置于37℃孵育箱内进行孵育。
1.3移植瘤大体观察及CAM血管生成测定 在体式显微镜下,对移植瘤的生长及瘤体周围CAM血管生成情况进行连续观察并拍摄,在移植瘤接种后第5天(鸡胚孵育第12天)周围血管生长达到高峰时期时进行血管生成评分;评分标准参考Vu MT及Folkman J团队的研究[4,5]。根据移植瘤周围CAM血管生成情况按逐级递增原则,对所观察样本给予0-4分的评分:0分,移植瘤周围CAM血管维持原始树杈分枝状,与植入时相比未见明显与移植瘤有直接生发关系的血管增生;1分,移植瘤周围发出少许细微血管;2分,移植瘤周围血管较多,开始出现以瘤体为中心呈放射状生长的血管;3分,放射状血管生长更加明显,少部分血管呈充血状。4分,以移植瘤为中心出现大量充血的辐射状血管,形成车轮状辐射血管及其分支交织而成的血管网络[5,6]。
1.4组织学观察移植瘤接种后第10天(鸡胚孵育第17天),于体式显微镜下取下生长于CAM上的移植瘤(图1)。4%福尔马林固定24h,常规石蜡包埋处理后进行切片(厚度4μm)行HE染色,观察肿瘤组织学特点。
1.5MVD及增殖活性检测免疫组化二步法检测CD34及PCNA的表达。以CD34单克隆抗体(1:50,ZM-0046,中衫金桥)及PCNA单克隆抗体(1: 400,ZM-0213,中杉金桥)标记CD34蛋白及PNCA蛋白。采用奥林巴斯BX-51显微镜下装配DP-71照相机在同一设置下对切片进行摄像。以IMAGE-PRO PLUS 6.0专业图像分析软件对移植瘤蛋白表达进行积分光密度(integrated option density,IOD)的分析。每个标本选取3个连续切片进行评分,每张切片选取5个连续高倍镜视野进行拍摄,取IOD平均值作为该样本的最后评分。
1.6统计学方法采用SPSS13.0分析实验结果,ACP及SPCP成瘤率比较采用χ2检验,两种病理类型间移植瘤CAM血管评分采用Wilcoxon W检验,MVD及PCNA表达强度比较采用Student-t检验,PCNA与MVD和CAM血管评分相关性分别采用Pearson及Spearman相关性分析。检测水准α= 0.05。
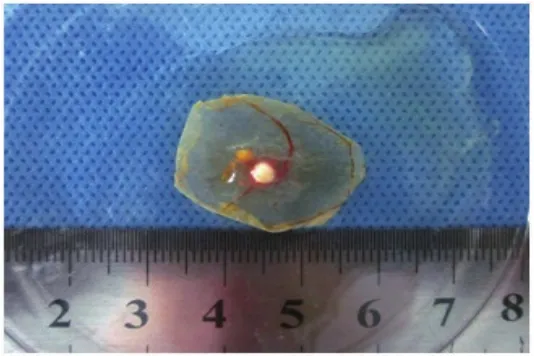
图1 移植瘤接种后第10天(鸡胚孵育第17天)连膜剪下的移植瘤
2 结果
2.1移植瘤观察移植后第1天(24h,鸡胚孵育第8天)可见肿瘤贴附于CAM上生长,肿瘤表面较不平整,周围少许血管生成(图2A);移植后第3天(72h,鸡胚孵育第10天)肿瘤表面开始变得平整,稍隆起,显示肿瘤瘤体开始生长。肿瘤周围血管较前增加,并开始呈辐射状生长(图2B),部分移植瘤周围可见新鲜出血点,此系鸡胚胎体活动,牵拉致使肿瘤血管破裂引起。移植后第5天(120h,鸡胚孵育第12天),瘤体表面圆钝,饱满,整体隆起呈半圆球形;移植瘤周围CAM血管生长达到高峰,常见血管充血,呈车轮状向外辐射生长(图2C)。此后瘤体及周围血管均不再发生明显变化,维持稳态。

图2 体式显微镜下同一移植瘤连续观察A:移植后24h:未见与移植瘤有明显直接关系的血管生成;B:移植后72h:移植瘤体积较前增大,出现少量发至移植瘤的放射状生长的血管;C:移植后120h:移植瘤体积明显增大,呈半球形,出现以移植瘤为中心出现大量放射状充血血管(×20)
2.2HE染色ACP移植瘤光镜下可见典型栅栏状排列细胞及内层星网状细胞层,部分移植瘤可见角质,钙化成分,但少见典型漩涡状细胞及胆固醇结晶结构,未见炎性细胞浸润。同时可见内含有鸡有核红细胞的血管生长于肿瘤周围(图3 A,B)。SPCP主要以排列较为紧密的成熟鳞状上皮为主,与绒毛膜分界较为清楚,局部可见坏死灶(图3 B)。
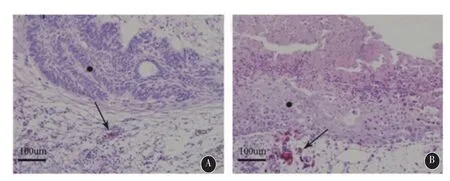
图3 A:ACP移植瘤HE染色,可见典型栅栏状细胞层(星号)及其内层星网状细胞,肿瘤周围可见丰富的CAM血管的生成(箭头);B:SPCP移植瘤HE染色,可见成熟鳞状上皮层(星号)及肿瘤周围CAM血管(箭头)(×400)
2.3移植瘤微血管密度及增殖活性测定 以CD34单克隆抗体标记移植瘤MVD(图4)。免疫组化结果显示ACP的肿瘤实质部分及间质部分均可见有微血管生成,SPCP的染色主要出现在肿瘤间质,肿瘤实质中少见新生血管染色。
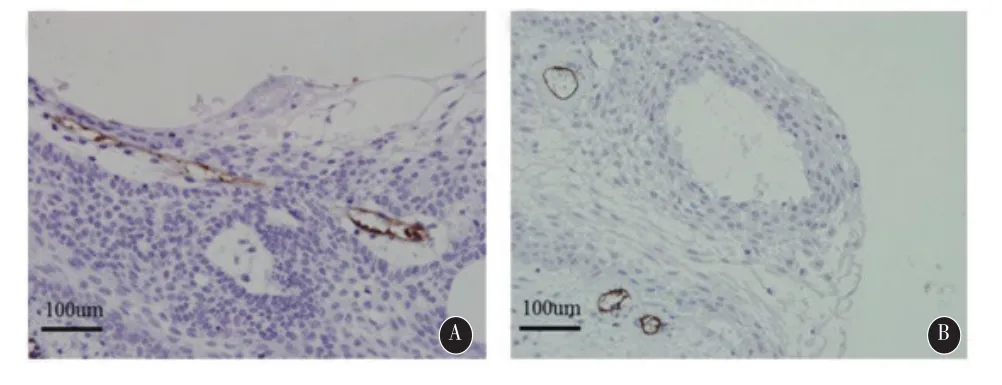
图4 A:ACP移植瘤中CD34的表达;B:SPCP移植瘤中CD34的表达(×400)
PCNA为细胞核染色,ACP移植瘤中,PCNA主要强表达于栅栏状细胞,该层细胞常处于移植瘤的最外层(图5A);SPCP中PCNA强表达区也位于与CAM胶原层交界的乳头状上皮区域,而在其内层的上皮中PCNA的表达则相对较弱(图5B)。
2.4CAM瘤周血管评分 在移植后第5天(鸡胚孵育第12天)移植瘤表面CAM血管生长达到高峰,血管生成分析显示ACP移植瘤周围CAM血管评分 3.0(3.0,4.0)明 显 高 于 SPCP2.0(1.5,2.0)(Z=-3.862,P<0.001)。
2.5移植瘤存活率、MVD及增殖活性比较 ACP移植瘤存活率47.14%(33/70),SPCP移植瘤存活率43.33%(13/30),二者无统计学差异(χ2=0.123,P= 0.726);ACP的血管活性指标CD34(MVD)及增殖活性指标PCNA的表达均高于SPCP(tCD34=4.809;tPCNA=5.470,P<0.001,表1)。相关性分析结果表明移植瘤PCNA的表达与MVD(Pearsonr=0.639,P<0.001)及CAM血管评分 (Spearmanr=0.490,P= 0.001)呈正相关。
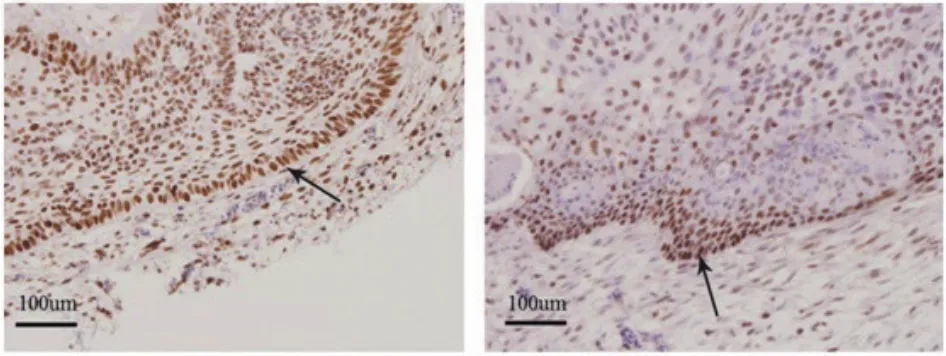
图5 A:ACP中PCNA强表达于外围栅栏状细胞层(箭头);B:SPCP中PCNA强表达于交界区的乳头状上皮(箭头)(×400)
3 讨论
3.1移植瘤大体观察及组织学特点 本实验中我们将7例ACP及3例SPCP接种于CAM上,每例标本接种于10枚鸡胚蛋中,ACP移植瘤存活率47.14%(33/70),SPCP移植瘤存活率43.33%(13/ 30)。组织学上,ACP基本保持了其原有的特点,光镜下可见典型的栅栏样细胞排列及内层星网状细胞,但少见典型的旋涡状结构,这可能与肿瘤接种时间较短细胞未及分化到该阶段有关。SPCP则基本维持了其成熟复层鳞状上皮为主的结构,常见的坏死灶可能是由于SPCP移植瘤中新生血管的生成较少导致肿瘤得不到充足养分所致。
我们对移植瘤的生长情况进行连续观察及并对瘤周CAM血管生成进行连续拍摄。在移植24h之后,肿瘤周围CAM表面可见少许细微的血管生成,显示此时的瘤体可能已经初步与CAM建立血供关系。此后几天,随着肿瘤周的血管生成的不断增加,肿瘤的体积亦开始增大,表面逐渐由移植初期的不规则状态变得较为平整。到移植后的第4~5 d(鸡胚周期第11~12 d)移植瘤体积较前明显增大,表面变得光滑,圆钝,常呈半球形突出于CAM表面。同时移植瘤周围CAM表面血管增殖达到高峰,之后不再明显增加,这与鸡胚CAM在自然条件下的血管网成熟时间是一致的。
3.2移植瘤MVD及增殖活性分析 肿瘤的血管生成能力是衡量肿瘤生长的重要指标。Vidal S等[6]研究表明颅咽管瘤的血管生成能力与其预后之间存在密切的联系。本实验中我们利用对CAM表面血管增生能力进行的测定及并检测移植瘤MVD,对颅咽管瘤移植瘤宏观和微观的血管形成能力做综合的分析。
有研究发现包括血管内皮生长因子(vascular endothelial growth factor,VEGF),纤维母细胞生长因子(basic fibroblast growth factor,FGF),肿瘤坏死因子α(tumor necrosis factor-α TNF-α)等在内的多种外源性促血管生成因子可刺激CAM表面血管的增生[7,8]。本实验中,随着肿瘤的生长,移植瘤周围的CAM血管亦随之出现不同程度的增生,统计结果显示ACP的CAM血管生成评分高于SPCP。这说明CP移植瘤可能通过释放某些促血管生的因子促进了CAM表面血管的生长,并且这种能力在不同类型CP之间存在差异。在CD34抗体标记移植瘤MVD实验中我们发现ACP的MVD高于SPCP,表明ACP移植瘤微循环构建能力强于SPCP。这与Xu等[9]通过检测常规组织病理切片发现ACP的MVD高于SPCP的结论是一致的。
PCNA是一种细胞增殖抗原,可作为检测细胞增殖活性的指标[10]。本研究中,ACP的PCNA表达要高于SPCP,且在两个病理亚型中PCNA的强表达区域都是位于肿瘤最外层与CAM胶原层的交界区,而位于肿瘤内部的细胞表达则相对较弱,显示肿瘤外围的细胞的增殖活性更强,这与我课题组之前的研究中发现PCNA强表达于颅咽管瘤外围乳头状细胞层及漩涡状细胞中而肿瘤内层细胞表达相对较弱的结果相同,说明在CAM上生长的CP移植瘤的增殖性状未发生明显改变[11]。同时,统计结果显示移植瘤PCNA与MVD的表达和CAM血管评分呈正相关,推测可能是由于肿瘤细胞生长越活跃,其分泌促血管生长因子的能力也越强,血管生成丰富反过来又可进一步促进肿瘤的生长。

表1 ACP与SPCP之间,MVD及PCNA检测的差异比较
3.3CAM移植瘤模型特点分析 CAM模型是研究肿瘤生物学性状尤其是血管生成能力的重要模型之一。其主要的优点有:①与传统的裸鼠模型相比,鸡胚CAM模型可在不终止移植瘤生长的情况下,对肿瘤瘤体的生长情况进行连续观察并对移植瘤周围血管生成进行半定量评估;②颅咽管瘤属于良性肿瘤(WHO,Ⅰ级),目前尚无永生的细胞系,这可能与其生长对周围微环境的要求较高有关,鸡胚的天然低免疫性为其提供了一个合适的生存平台,同时CAM表面血管网密集,血供极为丰富,保证了颅咽管瘤移植瘤具有较高的存活率;③CAM的内外两层皆为复层鳞状上皮细胞层,与人体内某些生物膜的性状具有一定的相似性,相比其他模型其结构简单明了,可以较为直观地从组织学角度上判断肿瘤与生物膜之间的关系,远期此模型有望用于肿瘤侵袭或迁徙相关研究;④由于CAM模型的载体成本远比裸鼠来的低,且具有试验周期短,可重复性强的特点,因此比传统的动物模型更适用于肿瘤样本的大规模筛查实验。当然这一模型也存在一定的缺陷,由于鸡胚孵育的17d开始具有较强的自身免疫能力,可能不利于肿瘤的生长,因此研究周期较短,这也是本实验中,我们于孵育17d时取下移植瘤进行组织学分析的原因;CAM血管的增生有一定的限度,在孵育12d以后CAM血管增殖达到顶峰,移植瘤的生长也因此进入相对缓慢的状态,我们在研究中发现SPCP移植瘤局部常可见坏死灶,推测可能由于SPCP移植瘤对血供要求较高,CAM血管增殖达到平台期后不能继续满足肿瘤快速生长所致。
本实验首次利用鸡胚CAM,成功建立了颅咽管瘤异体移植瘤模型,移植瘤具有一定的增殖活性,基本保持了原有的组织学特点。该模型便于对移植瘤的生长情况进行连续地直接观察,能利用CAM表面血管生成的半定量分析和MVD检测对移植瘤血管生成能力进行综合分析,且操作简单,成本较低,是一种可作为颅咽管瘤相关基础研究的理想模型。
[1]漆松涛,潘军,黄胜平,等.大型颅咽管瘤生长方向及侵袭特征与手术效果探讨[J].中国神经精神疾病杂志,2002,28(4): 268-272.
[2]Muller H L.Childhood craniopharyngioma--current concepts in diagnosis,therapy and follow-up[J].Nat Rev Endocrinol,2010,6(11):609-618.
[3]Kleibeuker E A,Schulkens I A,Castricum K C,et al.Examination of the role of galectins during in vivo angiogenesis using the chickchorioallantoic membrane assay[J].Methods Mol Biol,2015,1207:305-315.
[4]Folkman J,Cotran R.Relation of vascular proliferation to tumor growth[J].Int Rev Exp Pathol,1976,16:207-248.
[5]Vu M T,Smith C F,Burger P C,et al.An evaluation of methods to quantitate the chick chorioallantoic membrane assay in angiogenesis[J].Lab Invest,1985,53(4):499-508.
[6]Vidal S,Kovacs K,Lloyd R V,et al.Angiogenesis in patients with craniopharyngiomas:correlation with treatment and outcome[J].Cancer,2002,94(3):738-745.
[7]Huang K F,Huang X P,Xiao G Q,et al.Kallistatin,a novel anti-angiogenesis agent,inhibits angiogenesis via inhibition of the NF-kappaB signaling pathway[J].Biomed Pharmacother,2014,68(4):455-461.
[8]Sudhakaran P R,Binu S,Soumya S J.Effect of sarcosine on endothelial function relevant to angiogenesis[J].J Cancer Res Ther,2014,10(3):603-610.
[9]徐建国,游潮,王晓洁,等.MVD及VEGF在颅咽管瘤中的表达及其与预后的关系[J].中国神经肿瘤杂志,2005(04): 252-257.
[10]Lv X J,Zhao L J,Hao Y Q,et al.Schisandrin B inhibits the proliferation of human lung adenocarcinoma A549 cells by inducing cycle arrest and apoptosis[J].Int J Clin Exp Med,2015,8(5): 6926-6936.
[11]潘军,漆松涛,邓永键,等.颅咽管瘤增殖细胞核抗原表达与肿瘤复发的关系[J].第一军医大学学报,2002,22(4):363-365.
The establisment of human craniopharyngioma xenografts in chick chorioallantoic membrane.
YANXiaorong,KANG Dezhi,LIN Yuanxiang,PAN Jun,WU Xiyue,ZHOU Jie,JIANG Changzhen,QI Songtao.Department of Neurosurgery,Nanfang Hospital,Southern Medical University,1838#Guangzhou Road Guangzhou City,Guangzhou 510515,China.Tel:020-61641801.
Objective To establish the xenotransplanted tumor model of Craniopharyngioma in chick chorioallantoic membrane(CAM)and detect the angiogenesis ability,microvessel density(MVD)and cell proliferation of the xenograft.Method Craniopharyngioma tissues from surgical craniopharyngioma patients were transplanted on the CAM.Angiogenesis assay was performed and the MVD and PCNA were evaluated using immunohistochemistry following the transplantation.Results The tumor formation rate of adamantinomatous craniopharyngioma(ACP)and squamous papillary craniopharyngioma(SPCP)was 47.14%and 43.33%,respectively.There was no significant difference in tumor formation rate between ACP and SPCP(χ2=0.123,P=0.726).The CAM angiogenesis,MVD and expression of PCNA were higher in ACP than in SPCP.The expression of PCNA was positively correlated with MVD(Pearson r=0.639,P<0.001)and CAM assay score(Spearman r=0.490,P=0.001)in CP.Conclusion The model of human craniopharyngioma can be established in the CAM.The angiogenesis of the xenograft in the CAM can be evaluated and the craniopharyngioma xenograft of CAM possesses a new blood circulation and cell proliferation ability.
Craniopharyngioma Chick chorioallantoic membrane Angiogenesis Proliferation
R739.41
A
2015-08-20)
(责任编辑:甘章平)
10.3969/j.issn.1002-0152.2015.11.003
☆ 福建省卫计委青年科研项目(编号:2014-2-21);福建省自然科学基金(编号:2015J05150)
*福建医科大学附属第一医院神经外科(福州 350005)
△南方医院神经外科
※四川医科大学附属第一医院神经外科

