化学修饰提高谷氨酰胺转胺酶活性与热稳定性
刘松,堵国成*,陈坚
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学生物工程学院,江苏无锡214122)
化学修饰提高谷氨酰胺转胺酶活性与热稳定性
刘松1,2,堵国成*1,2,陈坚1,2
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学生物工程学院,江苏无锡214122)
谷氨酰胺转氨酶(EC 2.3.2.13,简称TGase)是一种催化转酰基反应,导致蛋白质分子间发生交联的酶,广泛应用于食品、纺织、皮革、医药等领域。为提高TGase比活力与热稳定性,作者以邻苯二甲酸酐为修饰剂,对重组吸水链霉菌(Streptomyces hygroscopicus)TGase分子赖氨酸残基进行化学修饰。确定最佳修饰条件为:pH 8.0、20℃修饰反应2 h、TGase表面氨基与PA摩尔比为1∶2。无胱胺(TGase的竞争性抑制剂)存在时,PA修饰使TGase比活力提高48.3%;10 mmol/L胱胺存在时,PA修饰使TGase热稳定性提高31.3%。晶体模拟结构显示,21个赖氨酸残基位于S.hygroscopicus TGase分子表面,其中5个位于催化活性中心附近区域。表面疏水性分析发现,不同条件的PA修饰使TGase分子表面疏水度降低9.46%~21.13%。因此,PA可能通过改变TGase分子不同区域的疏水性来提高其比活力和热稳定性的。上述结果表明,PA修饰是一种改进TGase酶学性质的有效策略,为其后续的分子改造提供了一定的理论参考。
谷氨酰胺转胺酶;邻苯二甲酸酐;比活力;热稳定性;表面疏水度
谷氨酰胺转胺酶(EC 2.3.2.13,简称TGase)是一种可以催化转酰基反应,从而导致蛋白质(或多肽)之间发生共价交联的酶。由于TGase具有独特的催化功能,已在众多领域得到应用。其中TGase在食品加工领域中的应用最为广泛,少量添加即可显著提高肉制品、水产品和豆制品等食品的感观品质或营养价值[1-2]。近年来,TGase在一些非食品加工领域也具有很大的应用前景,包括组织工程、纺织与皮革加工和蛋白质工程等,成为羊毛纤维强化、皮革填充和组织工程的关键用酶[3]。基于应用性能和生产成本的优势,微生物发酵(如链霉菌等)是TG工业化生产的首选方法。随着应用领域的拓展,各种应用环境对TGase酶分子稳定性和催化活性不断提出新的要求[3]。如何获得高稳定性、高催化的TGase成为国外研究者关注的热点。
一系列分子改策略已应用于TGase热稳定性和催化活性的改造,如基于分子柔性区域分析的定点突变、基于水接触表面热点区域的定点突变、基于易错PCR的定向进化技术等[4]。通过上述分子改造,链霉菌TGase的热稳定性和催化活性获得不同程度的提高。然而,基于基因工程的酶分子改造策略仅能使关键氨基酸位点产生20种主要的氨基酸更替,修饰程度有限。酸酐等化学修饰剂对蛋白质中氨基酸侧链的修饰,可引入几乎无限种的基团,被广泛用于酶分子稳定性、底物亲和性、催化效率和底物选择性的改进[5]。因此,化学修饰可能是一种提高TGase热稳定性和催化活性的有效策略。
在前期研究中,作者将吸水链霉菌(Streptomyces hygroscopicus)TGase成功表达于大肠杆菌[6],为发酵法制备TGase提供了高效生产菌株。为进一步提高S.hygroscopicus TGase的应用性能,作者将重组S.hygroscopicus TGase纯化后,考察了常用氨基修饰剂——邻苯二甲酸酐(PA)对其比酶活力及热稳定性的影响,并探讨了其作用机制。
1 材料与方法
1.1材料
1.1.1菌株与质粒菌株E.coli(pET-22b/sprostg)为作者所在实验室保藏,用于发酵生产重组S.hygroscopicus TGase[7]。
1.1.2主要试剂N-carboxybenzoyl-L-glutaminylglycine(N-CBZ-Gln-Gly)和L-谷氨酸-γ-单羟胺酸:购自Sigma-Aldrich公司(上海);谷胱甘肽(还原型):购自华美生物工程有限公司;标准相对分子质量蛋白质、蛋白质上样缓冲液、制胶试剂:均购自碧云天公司;胰蛋白胨和酵母粉:购自Oxoid(英国)公司;其它试剂均为国产或进口分装。
1.1.3培养基
1)LB培养基:10 g/L蛋白胨、5 g/L酵母提取物、10 g/LNaCl,高压蒸汽灭菌。
2)TB培养基:12 g/L蛋白胨、24 g/L酵母提取物、10 g/L甘油;磷酸盐缓冲液:17mmo/L KH2PO4、72mmol/L K2HPO4。将前三者按比例配好后,高压蒸汽灭菌,与经高压蒸汽灭菌后的磷酸盐缓冲液按10∶1比例混合。
1.2方法
1.2.1重组TGase的制备
1)重组TGase粗酶液制备:根据前期研究中的产酶条件[7],对E.coli(pET-22b/spro-stg)进行摇瓶发酵。取E.coli BL21(DE3)(pET-22b/spro-stg)发酵液于4℃、10 000 r/min离心10min收集菌体。每克湿菌体用10 m L结合缓冲液(pH 7.4,20 mmol/L Na2HPO4,200 mmol/L NaCl,20mmol/L咪唑)重悬,超声破碎至菌体完全裂解。裂解液于4℃、10 000 r/min离心10min,取上清液过0.22μm膜制成粗酶液。
2)亲和层析:将样品注入经结合缓冲液平衡的亲合层析柱(HisTrapTMFF crude,GE),并用结合缓冲液洗去未结合蛋白;随后以0~500mmol/L咪唑溶液进行梯度洗脱,流速为1.0 m L/min,收集含有TGase催化活性的部分。
3)凝胶过滤:用pH 7.0、50 mmol/L磷酸缓冲液平衡凝胶柱,将亲和纯化后的样品注入凝胶柱(Superdex 75 10/300 GL,GE),用平衡缓冲液洗脱,流速0.5 mL/min,收集含有TGase催化活性的部分。1.2.2重组TGase的化学修饰分别在含10 mmol/L胱胺和不含胱胺的情况下,按照修饰剂邻苯二甲酸酐(PA)与TGase表面氨基1∶1、2∶1和5∶1的比例向2 mL TGase酶液(质量浓度1 mg/mL,含100mmol/L硼酸盐,pH 8.0)中添加PA,20℃反应2 h,并将反应产物在50 mmol/L Tris-HCl(pH 7.0)缓冲液中透析过夜。
1.2.3TGase温度稳定性的测定将酶液在不同温度下保温不同时间,迅速冷却,pH 6.0、37℃测定残余TGase酶活,以未保温的酶活力为相对酶活100%,计算相对酶活力。
1.2.4酶分子表面疏水度测定采用疏水性荧光探头1-苯胺基-8-萘黄酸(ANS)测定蛋白质表面疏水度[8]。将TGase酶液(1 mg/mL)稀释至0.5~0.005 mg/mL,每3 mL TGase稀释液中添加40μL 8.0 mmol/L ANS溶液(0.1 mol/L、pH 7.0磷酸缓冲溶液)。在365 nm(激发)和484 nm(发射)下测定样品的荧光吸收强度。荧光强度对蛋白质浓度的初始斜率(通过线性回归计算)作为酶蛋白表疏水度指数。
1.2.5酶分子表面氨基修饰度的测定采用三硝基苯磺酸(TNBS)显色法测定TGase分子表面自由氨基的修饰度[9]。将0.5mL(0.5mg/mL)样品溶液加至0.5mL硼砂-NaOH缓冲液中,再加入20μL(1.8 mol/L TNBS),并迅速混合。反应5 min后,加2 mL终止液终止反应,于420 nm下测定吸光值。吸光值对应TGase分子表面残余的自由氨基数量,天然TGase在420 nm吸光值对应23个氨基。化学修饰度以修饰后酶分子表面残余自由氨基数目表示。
1.2.6蛋白质浓度与SDS-PAGE电泳检测采用Bradford法测定蛋白质浓度[10]。SDS-PAGE电泳凝胶采用碧云天试剂盒制备,具体操作参考产品说明书和文献[11]。使用浓缩胶质量浓度为5 g/dL,分离胶质量浓度为12 g/dL,以0.1%考马斯亮蓝R-250进行染色。
1.2.7TGase酶活测定比色法测定酶活[12]。用α-N-CBZ-Gln-Gly为作用底物,L-谷氨酸-γ-单羟胺酸做标准曲线。1个单位TGase酶活定义为:37℃每分钟催化底物形成1μmol L-谷氨酸-γ-单羟胺酸的酶量(U/mL)。酶活测定条件:37℃条件下反应10min。
2 结果与分析
2.1重组S.hygroscopicus TG的制备
E.coli BL21(DE3)(pET-22b/protg)重组菌经离心、破壁、膜过滤等预处理后,进行亲和层析和凝胶过滤纯化。SDS-PAGE分析见图1,纯化后重组TGase的相对分子质量为38 000,与S.hygroscopicus天然TGase基本一致[13]。重组TGase的比酶活从0.57 U/mg提高到19.1 U/mg,纯化33.8倍,回收率为32%。
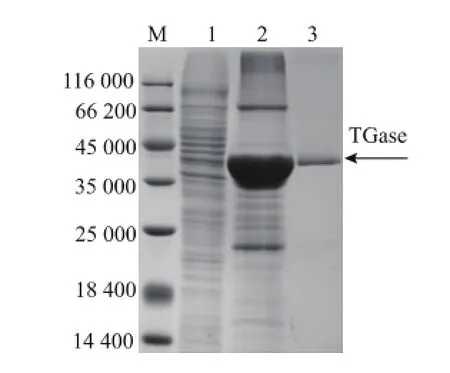
图1 重组S.hygroscopicus TGase的SDS-PAGE电泳分析Fig.1 SDS-PAGE analysis of the purified recombinant TGase
2.2PA修饰反应条件的确定
PA修饰反应条件包括反应pH、温度和时间等,见图2。为确保蛋白质分子表面氨基不带电荷,修饰反应体系的pH值不能偏低。结合S.hygroscopicus TGase的最适反应pH和pH稳定范围[13],确定PA修饰反应体系的pH值为8.0。在pH 8.0、PA与TGase表面氨基比例为2∶1(摩尔比)时,PA修饰反应温度和时间对TGase活力的影响见图3。修饰温度较低时(10℃),TGase活力变化较小;修饰温度较高时(37℃),TGase活力下降;过长的修饰时间(120min)同样导致TGase活力降低。因此,确定PA修饰TGase的条件:pH 8.0、20℃修饰2 h。
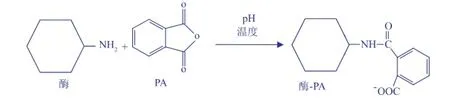
图2 PA修饰酶分子自由氨基Fig.2 Chem icalmodification of free am ino-group of enzyme by phthalic anhydride
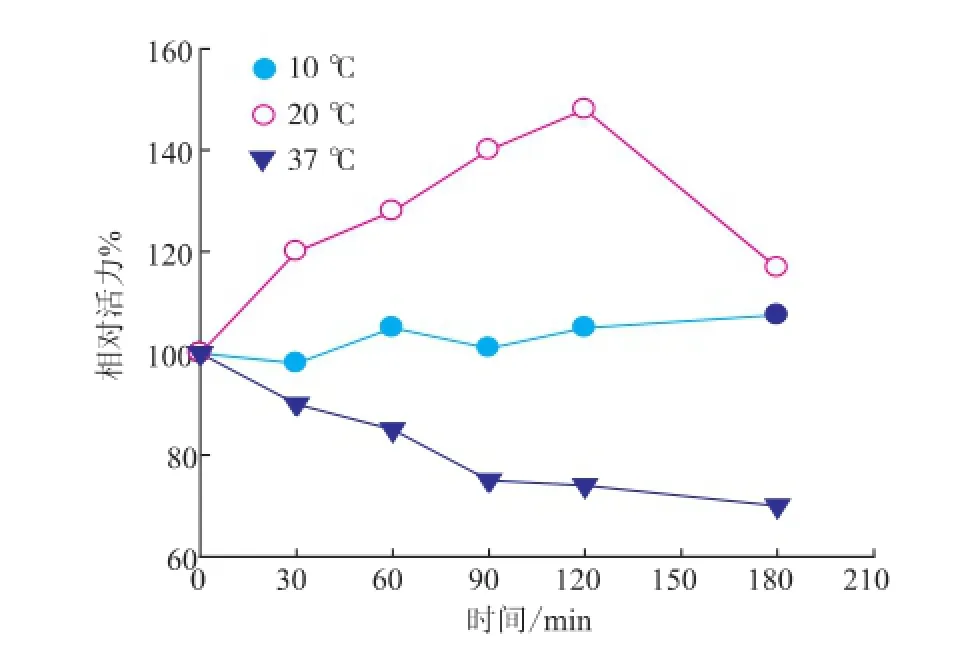
图3 PA修饰时间和温度对TGase活力的影响Fig.3 Effects of PA modification time and temperature on TGase activity
2.3PA对TGase酶学性质的影响
选取三个浓度的PA对TGase分子进行修饰。胱胺是TGase的竞争性抑制剂[14],其与TGase的结合可能影响PA对酶活性中心附近氨基的修饰。因此,考察了胱胺对PA修饰TGase的影响。结果显示,无胱胺存在时,经PA修饰TGase的比酶活力有明显提高,且热稳定性也略有提高;其中,TGase表面氨基与PA摩尔比为1∶2时,TGase比活力较天然酶提高48.3%,见图4(a)。存在10 mmol/L胱胺时,PA修饰使TGase的热稳定性有不同程度的提高;TGase表面氨基与PA摩尔比为1∶2时热稳定性提高31.3%,见图4(b)。
2.4PA修饰的作用机制解析
S.hygroscopicus TGase的模拟结构显示,其催化活性基团Cys65位于酶分子裂缝底部,5个赖氨酸残基(Lys295、Lys 270、Lys328、Lys38、Lys217和Lys237)位于裂缝附近的分子表面,见图5。在S.mobaraensis TGase分子中,将其裂缝表面的氨基酸残基突变为疏水性氨基酸残基(Ser299Phe等)可提高酶对含苯环底物CBZ-Gln-Gly的催化活性[15],暗示裂缝表面是TGase的底物结合位点。PA对裂缝表面赖氨酸残基的修饰同样增加了疏水性的苯环,该区域疏水性提高显然有利于其与CBZ-Gln-Gly的结合,最终使TGase催化活性提高。然而,胱胺与TGase催化活性中心的结合可能阻碍了PA对该区域的修饰,因此TGase催化活性变化较小。
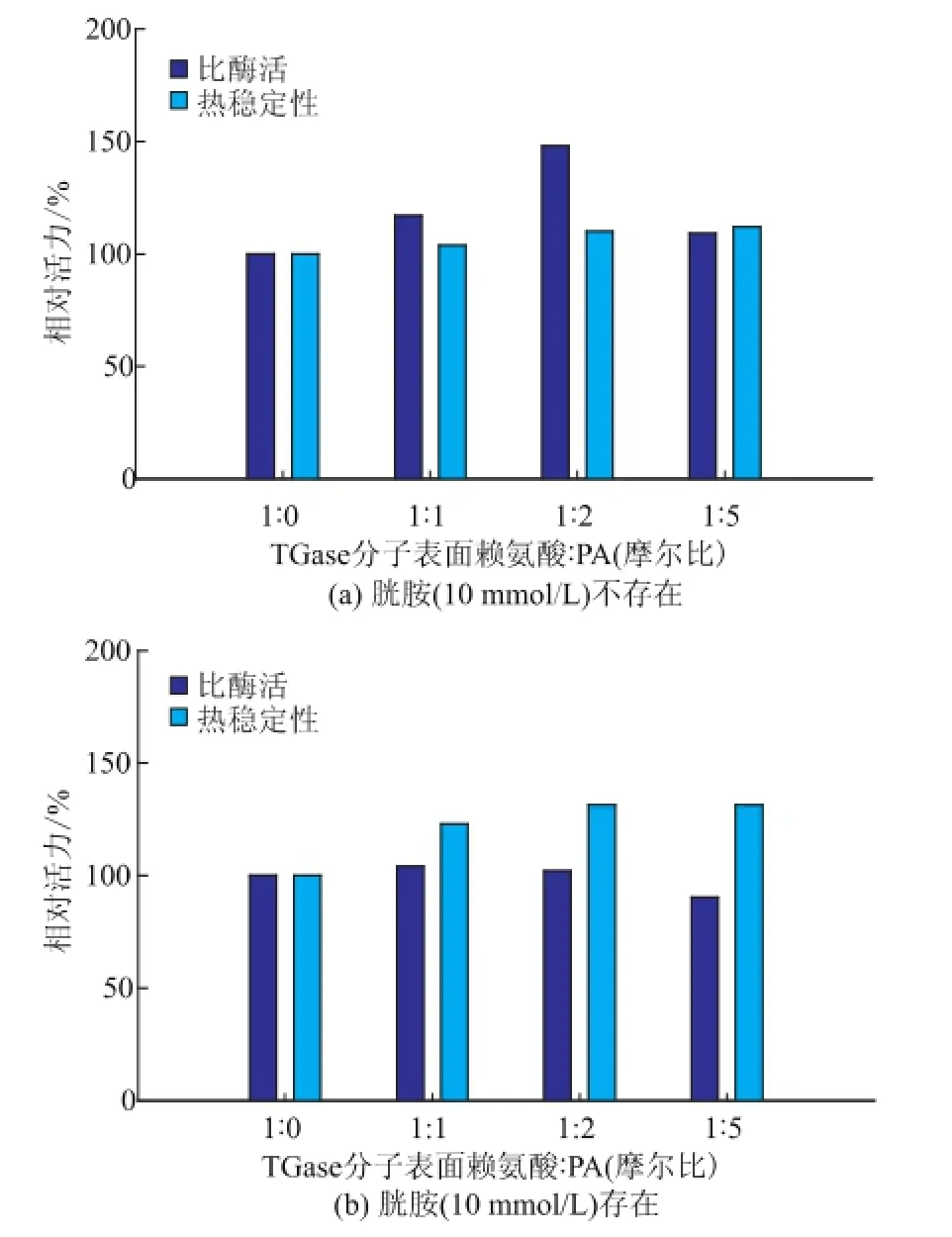
图4 胱胺(10 mmol/L)不存在(a)或存在(b)时PA修饰对TGase催化活力及热稳定性的影响Fig.4 Effects of phthalic anhydride modification on TGase activity and thermal stability in the absence(a)or presence(b)of cystam ine(10 mmol/L)
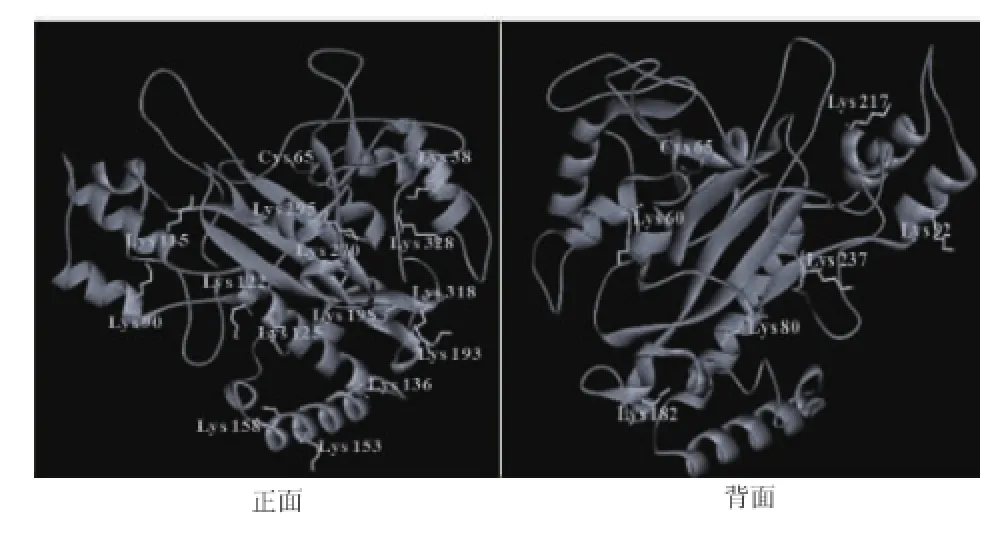
图5 位于S.hygroscopicus TGase分子表面(模拟结构)的赖氨酸残基Fig.5 Lysine residues on surface of S.hygroscopicus TGase(modeling structure)
PA修饰对酶分子热稳定的提高一般基于两个方面的原因:1)PA修饰引入的苯甲酸基团易于与其基团形成氢键,使分子结构稳定性提高[16];2)PA修饰带入的电荷可增强酶分子间的静电斥力,抑制高温条件下酶分子的聚集[17]。此外,分子表面疏水性的降低也有可能促进酶热稳定性的提高[18]。表1显示,无论胱胺是否存在,PA修饰均可提高TGase分子表面亲水性。胱胺不存在时,TGase表面氨基与PA摩尔比为1∶1、1∶2和1∶5时,PA修饰度随PA比例的提高而增加,相应TGase分子分表面疏水度下降了9.46%、17.74%和21.13%;在含10 mmol/L胱胺的体系中,TGase表面氨基与PA摩尔比为1∶1、1∶2和1∶5时,PA修饰度随PA比例的提高同样增加,相应TGase分子分表面疏水度分别下降了15.01%、19.67%和21.38%。结果表明,PA修饰后对TGase热稳定性的提高可能与其表面亲水性的增加有关。值得注意的是,随着酶分子表面疏水度的下降,TGase在无胱胺存在时热稳定性提高并不明显。这可能是由于,在无胱胺存在时PA对TGase催化活性中心的修饰降低了酶分子的热稳定性,从而一定程度上抵消了表面疏水下降引起的热稳定性增量。
3 结语
1989年,日本味之素公司首次在土壤中分离到TGase生产菌株,Streptoverticillium mobaraense S-8112[19]。此后,研究者不断分离到新的TGase生产株菌,包括Sv.ladakanum[20],Streptomyceshygroscopicus[21],Bacillus circulans[22],Bacillus subtilis[23]等,生产周期短、成本优势明显的微生物发酵成为TGase的主要来源。随着应用成本的下降,TGase应用领域不断拓展,包括食品、纺织、皮革、医药等领域。如何提高热稳定性、比酶活力等应用性能,成为TGase研究的重要方向。本研究首次采用PA对重组S.hygroscopicus TGase氨基进行化学修饰,使其比活力和热稳定性分别提高48.3%和31.3%,表明化学修饰是一种改进TGase酶学性质的有效策略。目前,已有多种酸酐类化学修饰剂(如柠康酐、琥珀酸酐、马来酐等)用于辣根过氧化物酶[24]、木瓜蛋白酶[25]等酶的耐有机环境性能、pH稳定和热稳定性等酶学性质的改造,获得了较好的研究结果。因此,全面考察柠康酐、琥珀酸酐、马来酐等修饰剂对TGase酶学性质的影响,可能进一步获得多种酶学性质改良的TGase酶。作者还发现了表面亲水性与TGase的正相关性,将为TGase分子的理性改造提供明确耙点。基于此,可采用定点突变的策略将TGase分子表面赖氨酸残基突变为其它亲水性更强的氨基酸残基(如谷氨酸残基),以提高酶的热稳定性。
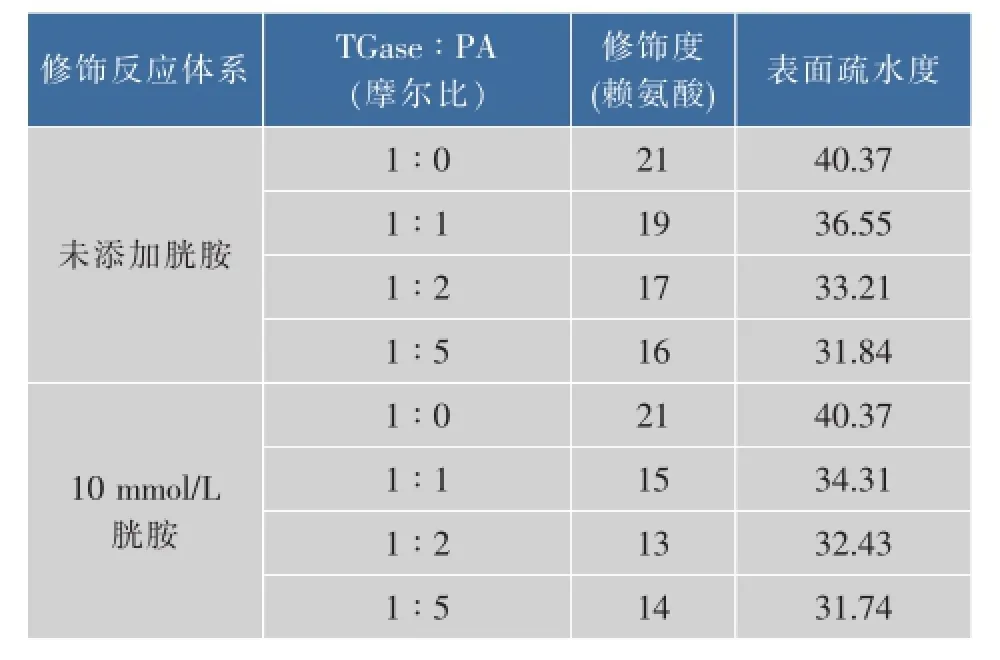
表1 PA对TGase分子表面疏水度的影响Table 1 Effect of PA modification on the surface hydrophobicity of TGasemolecule
[1]MotokiM,Seguro K.Transglutaminaseand itsuse for food processing[J].Trends in Food Science and Technology,1998,9:204-210.
[2]SantosM,Torne JM.Recent patents on transglutaminase production and applications:a brief review[J].Recent Patents on Biotechnology,2009,3(3):166-174.
[3]Zhu Y,Tramper J.Novel applications form icrobial transglutaminase beyond food processing[J].Trends in Biotechnology,2008,26(10):559-565.
[4]刘松,张东旭,堵国成,等.微生物谷氨酰胺转胺酶的表达及分子改造研究进展[J].生物工程学报,2011,27(12):1681-1689.
[5]Davis BG.Chemicalmodification ofbiocatalysts[J].Current Opinion in Biotechnology,2003,14(4):379-386.
[6]Liu S,Zhang D X,Wang M,et al.The pro-region of Streptomyces hygroscopicus transglutam inase affects its secretion by Escherichia coli[J].FEM SM icrobiology Letters,2011,324(2):98-105.
[7]Liu S,Zhang D X,Wang M,et al.The order of expression is a key factor in the production of active transglutaminase in Escherichia coli by co-expressionw ith itspro-peptide[J].M icrobial Cell Factories,2011,10:112.
[8]Kato A,Nakai S.Hydrophobicity determined by a fluorescence probemethod and its correlation with surface properties of proteins[J].Biochim ica et Biophysica Acta,1980,624(1):13-20.
[9]Habeeb A F.Determ ination of free am ino groups in proteins by trinitrobenzenesulfonic acid[J].Analytical Biochem istry,1966,14(3):328-336.
[10]Bradford M M.A rapid and sensitivemethod for the quantitation ofm icrogram quantities of protein utilizing the principle of protein-dyebinding[J].Analytical Biochem istry,1976,72:248-254.
[11]Walker JM,The Protein ProtocolsHandbook[M].Hatfield:Humana Press,2002.
[12]Grossowicz N,Wainfan E,Borek E,et al.The enzymatic formation of hydroxam ic acids from glutamine and asparagine[J]. Journal of Biological Chem istry,1950,187(1):111-125.
[13]Cui L,Du G C,Zhang D X,et al.Purification and characterization of transglutaminase from a new ly isolated Streptomyces hygroscopicus[J].Food Chem istry,2007,105(2):612-618.
[14]Hsu T C,Huang C Y,Chiang SY,etal.Transglutam inase inhibitor cystam ine alleviates the abnormality in liver from NZB/W F1 mice[J].European Journal of Pharmacology,2008,579(1-3):382-389.
[15]Yokoyama K,Utsum iH,Nakamura T,etal.Screening for improved activity of a transglutaminase from Streptomycesmobaraensis created by a novel rationalmutagenesis and random mutagenesis[J].App lied M icrobiology and Biotechnology,2010,87(6):2087-2096.
[16]GoudaM D,Singh SA,Rao A G,etal.Thermal inactivation of glucose oxidase.mechanism and stabilization using additives[J]. Journal of Biological Chem istry,2003,278(27):24324-24333.
[17]Sangeetha K,Abraham TE.Chem icalmodification of papain foruse in alkalinemedium[J].Journal of Molecular Catalysis B Enzymatic,2006,38(3-6):171-177.
[18]Pakula A A,Sauer R T.Reverse hydrophobic effects relieved by am ino-acid substitutions at a protein surface[J].Nature,1990,344(6264):363-364.
[19]Ando H,AdachiM,Umeda K,etal.Purification and characteristicsof anovel transglutaminase derived from microorganisms[J]. Agricultural and Biological Chem istry,1989,53(10):2613-2617.
[20]Lin Y S,Chao M L,Liu C H,etal.Cloning and expression of the transglutam inase gene from Streptoverticillium ladakanum in Streptomyces lividans[J].Process Biochem istry,2004,39(5):591-598.
[21]Cui L,Du G,Zhang D,et al.Thermal stability and conformational changes of transglutaminase from a new ly isolated Streptomyces hygroscopicus[J].Bioresource Technology,2008,99(9):3794-3800.
[22]de Barros Soares LH,Assmann F,Zachia Ayub MA.Purification and properties of a transglutam inase produced by a Bacillus circulans strain isolated from the Amazon environment[J].Biotechnology and App lied Biochem istry,2003,37(3):295-299.
[23]SuzukiS,Izawa Y,KobayashiK,etal.Purification and characterization ofnovel transglutam inase from Bacillus subtilis spores[J]. Bioscience Biotechnology and Biochem istry,2000,64(11):2344-2351.
[24]Liu JZ,Wang T L,Huang M T,et al.Increased thermal and organic solvent tolerance ofmodified horseradish peroxidase[J]. Protein Engineering,Design&Selection,2006,19(4):169-173.
[25]Sangeetha K,Abraham T E.Chem icalmodification of papain foruse in alkalinemedium[J].Jou rnal of M olecular Catalysis B:Enzymatic,2006,38:171-177.
Chemical Modification of Transglutaminase for Improving Specific Activity and Thermal Stability
LIU Song1,2,DU Guocheng*1,2,CHEN Jian1,2
(1.Key Laboratory of Industrial Biotechnology,M inistry of Education,Jiangnan University,Wuxi214122,China;2.Schoolof Biotechnology,Jiangnan University,Wuxi214122,China)
Transglutam inase(EC 2.3.2.13,TGase)can catalyze the acyl transfer reaction and leads to the crosslinking among proteins.It has been w idely used in food,textile,leather,and pharmaceutical industry.In order to improve the specific activity and thermal stability,a recombinant Streptomyces hygroscopicus TGase chem ically wasmodified by phthalic anhydride(PA)in this study.The optimalmodification condition of the cultivation was at pH 8.0,20℃for 2 h,and the molar ratio of surface-am ine to phthalic anhydride 1∶2.In the presence of 10mmol/L of cystam ine,which is a competitive inhibitor of the TGase,the thermal stability of TGase was increased 31.3%after the PA modification,whereas specific activity of the TGase increased 48.3%in the absence of the cystam ine.The modeling crystal structure showed that 21 lysine residues existed in surface of S.hygroscopicus TGase,and five of them located at region close the active site.The analysis of surface hydrophobicity indicated that PA modification reduced the surface hydrophobicity from 9.46%to 21.13%.Thus,PA may improve the specific activity and thermal stability of TGase by modifying the surface hydrophobicity at different regions.These results suggested that PA modification was an effective way to improve the catalytic properties of TGase,which provided a theoretical reference formolecularmodification.
transglutam inase,phthalic anhydride,specific activity,thermal stability,surface hydrophobicity
Q 814
A
1673—1689(2015)11—1135—06
2014-06-07
国家自然科学基金项目(31171639);江苏省自然科学基金项目(BK20130132)。
刘松(1981—),男,湖南永州人,工学博士,主要从事发酵工程方面的研究。E-mail:liusong@jiangnan.edu.cn
堵国成(1965—),男,江苏常州人,工学博士,教授,博士研究生导师,主要从事代谢工程、发酵过程优化与控制等方面的研究。E-mail:gcdu@jiangnan.edu.cn

