Tim-3对B16F10细胞共培养的小鼠脾淋巴细胞增殖的影响
吕雅琳周晓伟,2胡 彬曾学思刘 毅,2*孙建方,2*
Tim-3对B16F10细胞共培养的小鼠脾淋巴细胞增殖的影响
吕雅琳1周晓伟1,2胡 彬1曾学思1刘 毅1,2*孙建方1,2*
目的: 明确T细胞免疫球蛋白黏蛋白-3(Tim-3)对B16F10细胞共培养的小鼠脾淋巴细胞增殖的影响。方法: 构建Tim-3真核表达载体后,CCK-8法检测Tim-3融合蛋白对B16F10共培养的小鼠脾淋巴细胞的增殖。结果: Tim-3融合蛋白转染组淋巴细胞增殖活力低于未转染组和转染空载体组,差异有统计学意义(P<0.05)。结论: Tim-3融合蛋白抑制B16F10共培养的小鼠脾淋巴细胞的增殖。
T细胞免疫球蛋白黏蛋白; 真核表达; 小鼠
Tim-3属于T细胞免疫球蛋白黏蛋白(T cell immunoglobulin and mucin domain,Tim)家族,该基因家族由McIntire等于2001年发现,1位于鼠11号染色体上,编码一类具有共同基序的跨膜糖蛋白,基本结构包括一个信号肽、免疫球蛋白区、黏蛋白区、跨膜区和有磷酸化位点的细胞内区2。小鼠Tim-3基因编码含有281个氨基酸的I型膜蛋白,其蛋白分子的细胞外区含有1个免疫球蛋白V区,1个富含丝氨酸和苏氨酸残基的黏蛋白区。小鼠Tim-3有膜结合型Tim-3(full-length membrane-anchored form of Tim-3,flTim -3)和可溶型Tim-3(soluble form of Tim-3,sTim-3)两种形式。flTim-3含有信号肽、免疫球蛋白V区、黏蛋白区、跨膜区和胞浆区。sTim-3仅含有信号肽、免疫球蛋白V区和胞浆区。Tim-3被认为特异性表达于CD4+Th1和CD8+Tc1细胞,3凝集素家族中β-半乳糖苷结合凝集素-9(galectin-9)是Tim-3的主要配体,在组织内分布广泛,二者结合后,给T细胞提供了一种负性共刺激信号,下调免疫反应,抑制Th1介导的自身免疫反应和同种免疫反应,促进免疫耐受。4,5越来越多的研究证明,Tim-3表达于多种肿瘤相关的免疫细胞,在多细胞水平上参与肿瘤免疫。本研究构建小鼠Tim-3基因真核表达载体并进行表达,探讨Tim-3融合蛋白对与B16F10细胞共培养的小鼠脾淋巴细胞增殖的影响。为今后探索Tim-3在黑素瘤免疫治疗中的作用提供研究基础。
1 材料和方法
1.1材料 pcDNA3.1(+)真核表达载体购自南京海普乐生物科技有限公司;PMD18-T载体、DH5α感受态细胞购自大连TAKARA公司;转染腺病毒E1A基因的人肾上皮细胞293T细胞购自中科院上海细胞所,并在中国医学科学院皮肤病研究所江苏省皮肤病与性病分子生物学重点实验室传代保藏。DMEM高糖培养基、Opti-MEM、胎牛血清购自Gibco公司;脂质体LipofectamineTM2000购自Life公司;Trizol Rea-gent购自Invitrogen公司;PVDF膜购自Millipore新增试剂公司;PCR试剂盒、ECL曝光底物、CCK-8 Cell Counting Kit购自南京诺唯赞生物有限公司;DNA Marker、蛋白质预染Marker购自TAKARA公司;PM Western Midview Marker购自北京康为世纪生物有限公司;EndoFree Plasmid Maxi Kit购自Qiagen公司;小鼠淋巴细胞分离液购自深圳达科为生物技术有限公司;PHA购自Sigma公司;丝裂霉素购自江苏泰诺源生物技术有限公司。
1.2主要实验仪器与设备 美国Thermo Scientific公司的CO2细胞培养箱、低温离心机、医用超低温冷冻箱;苏州净化仪器厂的SW-CT-TF型超净工作台;美国Bio-Rad公司的PCR仪、凝胶成像及分析装置、聚丙烯酰胺凝胶电泳仪、聚丙烯酰胺凝胶垂直电泳槽、半干转微型转膜仪;OLYMPUS公司的FV1000激光共聚焦显微镜;美国Millipore公司的超纯水仪;中国上海精宏实验设备有限公司的电热恒温水槽;中国宁波格兰特制冷设备制造有限公司制冰机;美国Beckman公司DU640核酸蛋白定量分析仪。
1.3真核表达载体克隆策略的设计 EcoR I--Kozak sequence--ATG--Signal Peptide-Tim-3-TEV protease cleavage site-GFP-6xHis--stop codon--BamH I
1.3.1小鼠Tim-3胞外域预测及引物的设计与合成
在线检索Tim-3蛋白质氨基酸序列及开放读码框ORF,并通过BLAST比对由ORF得到的氨基酸序列和核酸序列。通过TMPRED预测Tim-3可能的跨膜区域,同时参照Uniprot蛋白数据库检索结果确定Tim -3胞外域。根据其胞外域结构及相应的 ORF用Primer premier5设计引物,并在NCBI上验证,由上海捷瑞生物工程有限公司合成。
1.3.2小鼠Tim3基因合成及真核表达载体的构建、验证 在预实验过程中,发现从小鼠组织中RT-PCR直接获得的原始序列构建到载体上的表达量很低,后分析发现从组织中获得的原始序列有7个稀有密码子,影响小鼠Tim-3的体外表达,所以优化基因表达序列,并送至上海捷瑞生物工程有限公司合成。合成的序列先连接到PMD18-T载体上,导入DH5α感受态细胞保藏在中国医学科学院皮研所江苏省皮肤病与性病分子生物学重点实验室。将目的序列从PMD18-T-Tim3-EGFP重组质粒上切下之后,连接到pcDNA3.1(+)真核表达载体上,酶切验证并测序比对。pcDNA3.1(+)-Tim3-EGFP导入DH5α感受态细胞保藏,并用Qiagen公司的EndoFree Plasmid Maxi Kit大量抽提,验证低内毒素后定量至1μg/μL备用。
293T细胞培养及转染 293T细胞常规培养于含10%FBS的DMEM培养基中,37℃、5%CO2饱和湿度培养箱中培养,定期更换培养液,将状态良好、处于对数生长期的细胞用0.25%胰酶消化,用完全培养基悬浮成单细胞悬液,细胞计数后,按1×106细胞/孔的浓度接种2 mL培养皿,混匀后于37℃、5%CO2培养24 h。将5μL浓度为1μg/μL的pcDNA3.1(+)-Tim3-EGFP质粒和等量的pcDNA3.1(+)空载体质粒分别与LipofectamineTM2000混匀后各自转染293T细胞(每组各3个重复),转染程序按LipofectamineTM2000操作说明进行;于转染24 h、48 h、72 h后,分离上清及细胞,上清进行Western blot检测,细胞进行激光共聚焦观察。
1.4Western blot及激光共聚焦显微镜检测小鼠Tim -3融合蛋白的表达 将转染24 h、48 h、72 h后的上清进行蛋白印迹检测[转染空载体pcDNA3.1(+)组只收集72 h时的上清]。将25μL样品上样SDSPAGE蛋白胶,300 mA 1 h转印后5%牛奶封闭2 h,1∶1000鼠抗His单抗室温孵育2 h,1∶1000山羊抗鼠二抗室温孵育2 h,ECL曝光。
将转染24 h、48 h、72 h后的细胞分别在激光共聚焦显微镜下观察Tim-3融合蛋白表达情况。分6组:转染pcDNA3.1(+)-Tim3-EGFP重组质粒24 h、48 h、72 h的细胞,转染pcDNA3.1(+)空质粒24 h、48 h、72 h的细胞。
1.5小鼠黑素瘤B16F10细胞与C57BL/6小鼠脾淋巴细胞共培养 断颈处死C57BL/6小鼠,取脾脏,参照小鼠淋巴细胞分离液操作说明提取脾淋巴细胞,将提取的脾淋巴细胞按照2×106/mL浓度接种于含10%FBS的RPMI-1640培养基中,加入10μg/m L的PHA,在37℃、5%CO2的细胞培养箱中培养5 d。培养过程中进行B1610细胞的传代与培养,用终浓度25μg/mL的丝裂霉素处理B16F10细胞,完全洗净丝裂霉素后与前述体外培养5 d后的脾淋巴细胞于96孔板共培养:B16F10细胞每孔终浓度2×105/mL,脾淋巴细胞每孔终浓度2×106/mL。
1.6CCK-8法检测 Tim3-EGFP融合蛋白对与B16F10共培养的小鼠脾淋巴细胞增殖的影响 在上述B16F10与脾淋巴细胞共培养体系中分别加入转染空质粒和重组质粒的293T细胞培养48 h上清,并进行分组。空白组:丝裂霉素处理的B16F10细胞、293T细胞培养48 h上清空,空白对照组:丝裂霉素处理的B16F10细胞、脾淋巴细胞、293T细胞培养48 h上清。阴性对照组:丝裂霉素处理的B16F10细胞、脾淋巴细胞、转染空质粒293T细胞培养48 h上清。Tim-3融合蛋白组:丝裂霉素处理的B16F10细胞、脾淋巴细胞、转染重组质粒293T细胞培养48 h上清。
每组设3个复孔,用含10%胎牛血清的RPMI-1640培养基或者上清调整每孔最终总体积为100μL,于37℃,5%CO2培养箱中培养,分别于24 h和48 h参照CCK-8 Cell Counting Kit操作说明检测450 nm的OD值并进行结果分析:
细胞活力%=(实验组细胞OD值-空白组OD值)/(空白对照组细胞OD值-空白组OD值)×100%
48 h淋巴细胞相对24 h增殖倍数=(实验组细胞48 h OD值-空白组OD值)/(实验组细胞24 h OD值-空白组OD值)
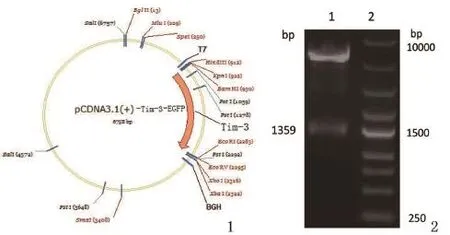
图1 pcDNA3.1(+)-Tim3-EGFP重组质粒结构图 图2 酶切验证pcDNA 3.1(+)-Tim3-EGFP重组质粒 1:pcDNA3.1(+)-Tim3-EGFP;2:marker
2 结果
2.1Tim-3胞外域序列及引物 小鼠Tim-3蛋白包含281个氨基酸,预测其中1-19位为信号肽,20-193为胞外域,194-214位为跨膜区。根据克隆策略设计引物扩增优化后的Tim3-EGFP融合蛋白的核酸序列,上游引物(包含BamHI酶切位点)5'-GAATTCGCCGCCACCATG-3',下游引物(包含EcoRI酶切位点)5'-GGATCCTCAATGATGATG-3'。
2.2Tim-3真核表达载体的构建及验证 将含1359 bp的目的片段连接至 pcDNA3.1(+)载体上,得到pcDNA3.1(+)-Tim3-EGFP重组质粒(图1),对重组质粒进行酶切验证(图2),得到1500 bp左右的片段,进行测序验证,结果与目标序列一致。
按照Qiagen公司的EndoFree Plasmid Maxi Kit说明书,大量抽提E.coli DH5中的pcDNA3.1(+)-Tim3 -EGFP重组质粒和pcDNA3.1(+)空质粒,并在荧光分度仪测得质粒浓度,最终定量1μg/μL。
2.3蛋白印迹检测转染Tim3-EGFP细胞的表达
转染重组质粒24 h、48 h、72 h的3组细胞,分别收集上清,上清处理后Western-blot分析(图3),在小于60 kDa处有目的蛋白,与预计50 kDa大小相符。

图3 Western-blot分析Tim3-EGFP重组蛋白
2.4激光共聚焦显微镜检测Tim3-EGFP蛋白表达激光共聚焦观察细胞显示,转染重组质粒pcDNA3.1(+)-Tim3-EGFP 24 h、48 h、72 h的细胞均表达融合蛋白,并且转染72 h的细胞EGFP的表达量最多,荧光最强(图4)。
2.5小鼠黑素瘤B16F10细胞与C57BL/6小鼠脾淋巴细胞共培养 光镜观察体外培养的脾淋巴细胞随培养时间延长,逐渐出现集落性增殖,部分细胞体积增大、胞浆丰富(图5)。
光镜观察与丝裂霉素处理B16F10细胞共培养的脾淋巴细胞发现,随共培养时间延长,部分脾淋巴细胞体积增大、胞浆丰富,并出现向B16F10细胞聚集的现象(图6)。
Tim-3融合蛋白对与B16F10共培养的小鼠脾淋巴细胞增殖的影响24 h、48 h时Tim-3融合蛋白组淋巴细胞活力低于空白对照组和阴性对照组(P<0.05)。见表1。

表1 CCK-8法检测24 h和48 h各组淋巴细胞活力%(¯x±s)
Tim-3融合蛋白组48 h相对24 h淋巴细胞增殖倍数与空白对照组和阴性对照组相比无显著性差异(P<0.05)。见表2。

表2 CCK-8法检测各组48 h相对24 h淋巴细胞增殖倍数 (¯x±s)
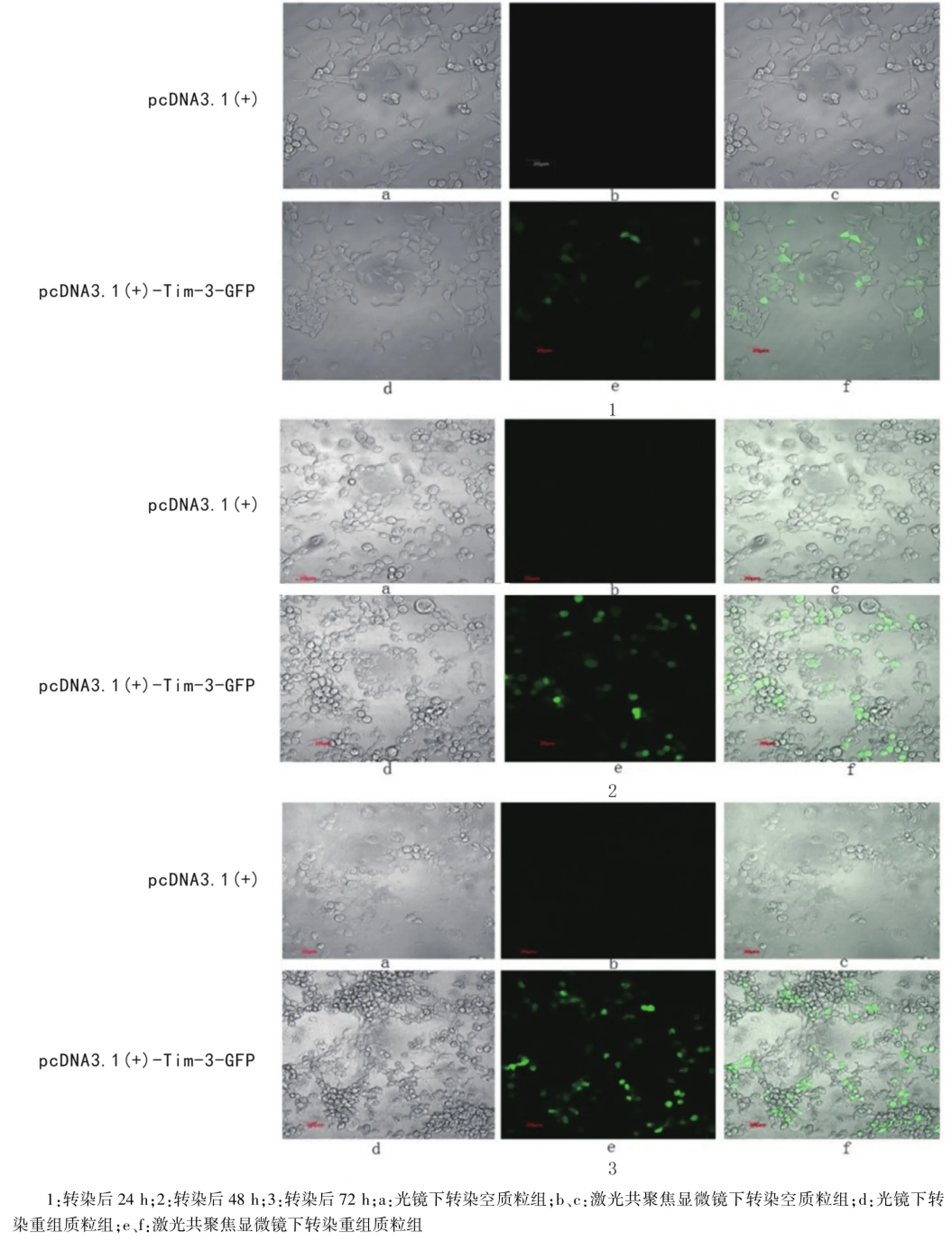
图4 激光共聚焦观察小鼠Tim3-EGFP的蛋白表达(×100)
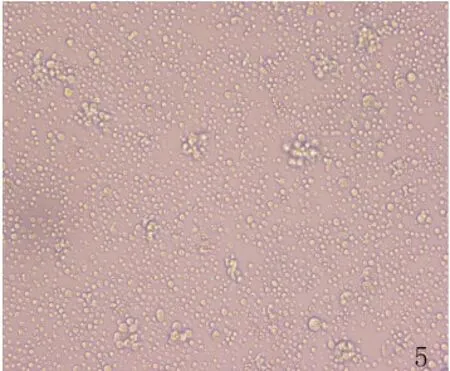
图5 脾淋巴细胞体外培养5 d(×100)
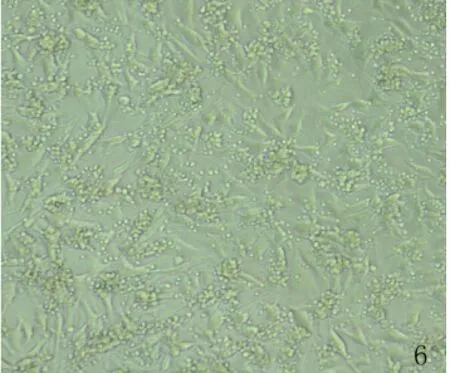
图6 B16F10细胞与脾淋巴细胞共培养24 h(×100)
3 讨论
Tim-3最先被发现其表达于终末分化的Thl细胞上,是区分Thl和Th2细胞的表面标志。近年来研究表明Tim-3还表达于Th17细胞、Treg、单核巨噬细胞、NK细胞、树突状细胞、肥大细胞和某些肿瘤细胞。6,7以往Tim-3病理生理学意义研究主要集中在以HIV为代表的病毒感染性疾病和以多发性硬化为代表的自身免疫性疾病,8与肿瘤的相关性研究不多。现在越来越多的研究证明,Tim-3表达于多种肿瘤相关的免疫细胞,并对细胞因子分泌起着重要的调节作用,从而在多细胞水平上参与肿瘤免疫:与T细胞功能耗竭有关,参与肿瘤免疫中T细胞应答的负性调控;促进髓系来源抑制细胞(myeloid-derived suppressor cells,MDSCs)的扩增,使肿瘤发生免疫逃逸,促进肿瘤发展;也可能促进DC的成熟和激活NK细胞增强肿瘤免疫应答。新近发现:在晚期恶性黑素瘤患者体内,部分PD-1+NY-ESO-1-特异性CD8+T细胞上Tim-3显著上调,并且Tim-3+PD-1+NY-ESO-1-特异性CD8+T细胞的功能显著低于Tim-3-PD-1+和Tim-3-PD-1-者,提示Tim-3与黑素瘤患者的CTL功能耗竭密切相关。9并且,应用抗Tim-3封闭性单抗阻断该通路后其细胞分泌和增殖功能显著增强。此外,内皮细胞表达的膜型Tim-3还参与黑素瘤的淋巴转移。10深入研究Tim-3在黑素瘤肿瘤免疫中的作用,为黑素瘤的免疫治疗提供新的靶点具有重要意义。
本研究成功构建小鼠Tim-3真核表达载体,转染293T细胞后,经Western blot和激光共聚焦检测到Tim-3融合蛋白表达。Western blot结果显示转染重组质粒293T细胞培养48 h上清蛋白含量高于24 h和72 h,所以选用转染48 h后上清进行后续试验。CCK-8法检测淋巴细胞增殖情况显示:Tim-3融合蛋白对与B16F10共培养的小鼠脾淋巴细胞增殖起抑制作用。
我们课题组一直致力于黑素瘤免疫治疗方面的研究,并取得一定成果,本实验成功构建了小鼠Tim-3基因的真核表达载体pcDNA3.1(+)-Tim-3-EGFP并表达,初步探讨Tim-3融合蛋白对与B16F10共培养的小鼠脾淋巴细胞增殖的影响,为进一步研究Tim -3在黑素瘤免疫治疗中的作用奠定了基础。
1Mc Intire JJ,Umetsu SE,AkbariO,et al.Identification of Tapr(an air-way hyperreactivity regulatory locus)and the linked Tim gene family.Nat Immunol,2001,2(12):1109-1116.
2Monney L,Sabatos CA,Gaglia JL,etal.Th1-specific cell surface protein Tim-3 regulatesmacrophage activation and severity of an autoimmune disease.Nature,2002,415:536-541.
3 Sakuishi K,Jayaraman P,Behar SM,et al.Emerging Tim-3 functions in antimicrobial and tumor immunity.Trends Immunol,2011,32(8):345-349.
4 Zhu C,Anderson AC,Kuchroo VK.TIM-3 and its regulatory role in immune responses.Curr Top Microbiol Immunol,2011,350:1-15.
5Norling LV,Perretti M,Cooper D.Endogenous galectins and the control of the host inflammatory response.J Endocrinol,2009,201(2):169-184.
6 Anderson AC,Anderson DE,Bregoli L,et al.Promotion of tissue inflammation by the immune receptor Tim-3 expressed on innate immune cells.Science,2007,318(5853):1141-1143.
7Wang F,He W,Zhou H,et al.The Tim-3 ligand galectin-9 negtively regulates CD8+alloreactive T cell and prolongs survival of skin graft.Cell Immunol,2007,250(1/2):68-74.
8McMahan RH,Golden-Mason L,Nishimura MI,et al.Tim-3 expression on PD-1+HCV-specific human CTLs is associated with viral persistence,and its blockade restores hepatocyte-directed in vitro cytotoxicity.JClin Invest,2010,120(12):4546-4557.
9 Fourcade J,Sun Z,Benallaoua M,et al.Upregulation of Tim-3 and PD-1 expression is associated with tumor antigen-specific CD8+T cell dysfunction in melanoma patients.J Exp Med,2010,207(10):2175-2186.
10Wu FH,Yuan Y,Li D,et al.Endothelial cell-expressed Tim -3 facilitatesmetastasis ofmelanoma cells by activating the NF -kappaB pathway.Oncol Rep,2010,24(3):693-699.
(收稿:2015-03-04 修回:2015-06-03)
Effect of Tim-3 on the proliferation ofm ouse sp lenic lym phocytes co-cultured w ith B16F10
LV Ya-lin,ZHOU Xiao-wei,HU Bin,et al.Institute of Dermatology,CAMS and PUMC,Nanjing,210042
Objective:To determine the effect of T cell immunoglobulinmucin 3(Tim-3)on the proliferation ofmouse splenic lymphocytes co-cultured with B16F10 cells.M ethods:After eukaryotic expression vector was constructed successfully,the proliferation of splenic lymphocytes co-cultured with B16F10 cells was detected by Cell Counting Kit-8(CCK-8)method.Results:The proliferation activity of splenic lymphocytes co-cultured with B16F10 cells was lower in the trans-infection group than in the non-trans-infection and mock-vehicle groups(P<0.05).Conclusion:Tim-3 can inhibite the proliferation of splenic lymphocytes co -cultured with B16F10 cells.
T cell immunoglobulin and mucin domain 3;eukaryotic expression;mouse
国家自然科学基金面上项目(编号:81171513)
江苏省自然科学基金面上项目(编号:BK20131063)
江苏省自然科学基金面上项目(编号:BK2012507)
2012高等学校博士学科点专项科研基金(编号:20121106110040)
1中国医学科学院北京协和医学院皮肤病医院,南京,210042
2江苏省皮肤病与性病分子生物学重点实验室,南京,210042

