氨基酸对葡萄糖、半乳糖模型产生呋喃的影响
洪 涛,张雅楠,申明月,*,谢明勇,聂少平,刘 倩,蒋玉洁,向 霞
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.中国农业科学院油料作物研究所,油料脂质化学与营养湖北省重点实验室,湖北 武汉 430062)
氨基酸对葡萄糖、半乳糖模型产生呋喃的影响
洪涛1,张雅楠1,申明月1,*,谢明勇1,聂少平1,刘倩1,蒋玉洁1,向霞2
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌330047;2.中国农业科学院油料作物研究所,油料脂质化学与营养湖北省重点实验室,湖北 武汉430062)
为研究氨基酸对葡萄糖和半乳糖模型产生呋喃的影响,通过向葡萄糖模型和半乳糖模型中加入不同含量的甘氨酸、丝氨酸、苏氨酸、谷氨酸,模拟密封罐装食品的灭菌条件(121 ℃条件下油浴30 min),采用顶空气相色谱-质谱(headspace-gas chromatography-mass spectrometry,HS-GC-MS)法检测呋喃的含量。结果表明:低含量(≤5 mg)的甘氨酸、极低含量(1 mg)的丝氨酸、高含量(50 mg)的苏氨酸和谷氨酸的添加能够明显促进葡萄糖模型产生呋喃,而对于半乳糖模型,所有高含量(50 mg)氨基酸的添加都能够导致呋喃的大量产生。苏氨酸对葡萄糖模型产生呋喃的促进作用明显强于其余3 种氨基酸(P<0.05);对于半乳糖模型,甘氨酸、苏氨酸对其产生呋喃的促进作用最强,且它们之间无明显差异。
呋喃;氨基酸;葡萄糖;半乳糖;美拉德反应;顶空气相色谱-质谱
呋喃(C4H4O)是一种无色、易挥发(沸点为31 ℃)、具有芳香特性的杂环化合物[1-2]。自从国际癌症研究机构(International Agency for Research on Cancer, IARC)将呋喃归类为可能使人类致癌物质的2B组后[3],这种在许多热加工食品中都能够被检出的食品污染物才开始引起人们的广泛关注。虽然目前呋喃导致肿瘤产生的机制并未阐明,但呋喃的毒理学研究显示,呋喃能够引起大鼠和小鼠肝癌的产生,且其致癌效果具有明显的浓度依赖性[4-6]。欧洲食品安全局(European Food Safety Authority,EFSA)在2004—2010年间对欧盟各国总计5 050 份食品样品中的呋喃含量进行了测定[7],发现在咖啡和密封的罐装食品中能够检出高含量的呋喃。同时EFSA还估算了欧盟各国的呋喃暴露水平,欧洲成年人的呋喃暴露值为0.290~1.170 μg/(kg·d),欧洲婴儿的呋喃暴露值为0.270~1.010 μg/(kg·d)。WU Sijia等[8]对我国的呋喃暴露水平进行估算,得到中国成年人的呋喃暴露值为0.093 μg/(kg·d),婴儿的呋喃暴露值为0.333 μg/(kg·d)。
近年来,研究人员对食品中呋喃产生的机理进行了大量研究。最早在食品中发现呋喃存在的Maga[9]认为食品中的呋喃主要来源于食品中有机组分尤其是碳水化合物的热降解或重排。大量研究结果表明,食品中的呋喃主要通过以下几个途径形成:1)还原糖单独存在时的热降解或与氨基酸发生美拉德反应[10-11];2)部分氨基酸的热降解[12];3)抗坏血酸、多不饱和脂肪酸和类胡萝卜素的热氧化[13-15]。根据大量文献报道[10,14-19],不同前体物质生成呋喃的各种途径如图1所示。
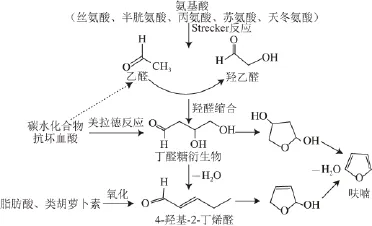
图1 呋喃形成的不同途径Fig.1 Different pathways of furan formation
由于食品中存在大量的碳水化合物和氨基酸,而在食品的热加工过程中,还原糖和氨基酸极易发生美拉德反应[20]。美拉德反应在食品加工过程中起着十分重要的作用,它不仅能够影响产品的色泽,还能够在反应过程中生成大量的呈香物质从而影响食品的香味,同时美拉德反应产物中的某些物质还能够起到一定的抗氧化作用[21-23]。然而,在美拉德反应过程中还会产生一些有害物质,例如丙烯酰胺、呋喃等[24]。因此,有必要对热加工过程中的美拉德反应进行深入研究。本研究拟建立两个碳水化合物模型——葡萄糖模型和半乳糖模型,模拟密封罐装食品的灭菌条件,121 ℃条件下油浴30 min,研究向模型中加入不同含量的甘氨酸、丝氨酸、苏氨酸、谷氨酸对其产生呋喃的影响。探索灭菌过程中氨基酸与还原糖发生美拉德反应时呋喃的生成机制,有利于美拉德反应中呋喃产生的控制,有助于优化热加工食品生产配方,为食品生产者挑选合适的、低呋喃产生量的食品原料提供理论参考,为食品安全提供保障。
1 材料与方法
1.1材料与试剂
D-葡萄糖(纯度≥99%)、半乳糖(纯度≥99%)美国Sigma公司;丝氨酸(纯度≥99%)、甘氨酸(纯度≥99%)、谷氨酸(纯度≥99%)、苏氨酸(纯度≥98%)、呋喃(纯度>99%)、D4-呋喃(纯度>99%)美国Sigma-Aldrich公司;甲醇(色谱纯)北京迪马科技有限公司;NaH2PO4、Na2HPO4均为分析纯上海永大试剂有限公司。
1.2仪器与设备
Agilent 7890A-7000B三重串联四极杆气相色谱质谱联用仪(配有Agilent G1888A自动顶空进样器和Version B.03.01 Masshunter工作站)、20 mL顶空瓶、HP-PLOT Q石英毛细管色谱柱(30 m×0.32 mm,20 μm)美国Agilent公司;Milli-Q Gradient超纯水仪美国Millipore公司;AL104电子天平、精密pH计瑞士梅特勒-托利多公司;DF 101-S恒温磁力式搅拌器江苏晓阳电子仪器厂。
1.3方法
1.3.1氨基酸溶液的配制
用50 g/L的NaH2PO4和Na2HPO4溶液配制pH 7.0的磷酸盐缓冲液。准确称量10 g甘氨酸于100 mL容量瓶中,用磷酸盐缓冲液定容至刻度,摇匀,便可得到质量浓度为100 mg/mL的甘氨酸溶液。
丝氨酸、苏氨酸、谷氨酸溶液的配制方法同上。
1.3.2葡萄糖和半乳糖模型溶液的配制
准确称量9 g葡萄糖于250 mL容量瓶中,用磷酸盐缓冲液定容至刻度,摇匀,即可得到质量浓度为36 mg/mL的葡萄糖模型溶液。
半乳糖模型溶液的配制方法同上。
1.3.3氨基酸对葡萄糖和半乳糖模型产生呋喃的影响测定
准确吸取5 mL的葡萄糖模型溶液于顶空瓶中,分别加入10、20、50、100、500 μL氨基酸溶液。在121 ℃条件下油浴30 min,立即取出冰水浴冷却,加入40 μL 2.5 μg/mL的D4-呋喃内标液,更换顶空瓶盖,通过采用顶空气相色谱-质谱法(headspace-gas chromatography-mass spectrometry,HS-GC-MS)检测分析呋喃含量[25]。
半乳糖模型同上。
1.3.4HS-GC-MS法检测呋喃的条件[20]
顶空条件:顶空瓶温度70 ℃,样品压力(顶空瓶的瓶内压)103.4 kPa,加压时间0.5 min,充气时间0.5 min,进样时间1 min,进样定量环温度110 ℃,填充定量环时间0.5 min,循环时间30 min,传输线温度130 ℃,样品平衡时间30 min。
色谱条件:色谱柱为HP-PLOT Q石英毛细管色谱柱(30 m×0.32 mm,20 μm),进样口温度200 ℃,质谱接口温度250 ℃;分流比为3∶1;升温程序:起始温度50 ℃,保持1 min,以10 ℃/min的速率升至200 ℃,保持10 min。载气为高纯氦气(纯度≥99.999%),载气流速:1 mL/min(恒流模式)。
MS条件:电子电离(electron ionization,EI)离子源,电子轰击能量:70 eV;离子源温度230 ℃,四极杆温度150 ℃;溶剂延迟:10 min;扫描方式:采用选择离子监测(MS1 SIM)检测呋喃分子离子m/z 68和碎片离子m/z 39,以及D4-呋喃分子离子m/z 72和碎片离子m/z 42。
1.4数据统计分析
实验数据经过SPSS 19.0软件处理,使用Duncan's检验分析显著性,P<0.05表示差异显著。
2 结果与分析
2.1HS-GC-MS法检测样品结果
采用1.3.4节方法对反应后的样品进行检测,得到的样品的总离子流图、呋喃和D4-呋喃的提取离子色谱图和质谱图如图2~4所示(图中选择的样品为与50 mg苏氨酸反应后的葡萄糖模型溶液)。
图2 呋喃的总离子流图Fig.2 Total ion chromatogram of furan from real sample

图3 呋喃(a)和D4-呋喃(b)的提取离子色谱图Fig.3 Extracted ion chromatograms of furan (a) and D4-furan (b)from real sample

图4 呋喃和D4-呋喃的质谱图Fig.4 Mass spectrum of furan and D4-furan from real sample
2.2甘氨酸添加量对葡萄糖和半乳糖模型产生呋喃的影响
添加不同含量的甘氨酸对葡萄糖模型和半乳糖模型生成呋喃的影响见图5。当甘氨酸添加量≤5 mg时,能大幅促进葡萄糖模型产生呋喃,而当甘氨酸添加量>5 mg时,则对葡萄糖模型产生呋喃含量影响不大。这可能是由于添加低质量浓度的甘氨酸时,甘氨酸与葡萄糖通过美拉德反应途径大量生成呋喃,而当添加高质量浓度的甘氨酸时,大量葡萄糖与甘氨酸反应生成其他美拉德反应产物。

图5 甘氨酸添加量对葡萄糖和半乳糖模型生成呋喃的影响Fig.5 Effect of glycine on furan formation from glucose and galactose model systems
而对于半乳糖模型,当甘氨酸添加量低于2 mg时,半乳糖模型产生呋喃的量反而减少。而当甘氨酸添加量≥5 mg时,半乳糖模型产生呋喃量大幅提高,尤其是添加了50 mg甘氨酸后,半乳糖模型产生的呋喃量与未添加甘氨酸时相比提高了19 倍。这可能是由于向半乳糖模型中加入低质量浓度的甘氨酸后,半乳糖与甘氨酸发生美拉德反应生成其他产物,使得呋喃生成量降低,而添加高质量浓度的甘氨酸与半乳糖通过美拉德反应途径生成大量呋喃。
2.3丝氨酸添加量对葡萄糖和半乳糖模型产生呋喃的影响
添加不同含量的丝氨酸对葡萄糖模型和半乳糖模型生成呋喃的影响见图6。当丝氨酸添加量为1 mg时,葡萄糖模型产生呋喃的量达到最大,随着丝氨酸添加量增加,葡萄糖模型产生呋喃的量都是呈下降的趋势。尤其是当丝氨酸添加量≥5 mg时,葡萄糖模型产生呋喃量相较于未添加丝氨酸时并无很大差别。丝氨酸在单独存在时能够发生Strecker反应,生成乙醇醛和乙醛,通过羟醛缩合生成丁醛糖衍生物,从而生成呋喃。但在葡萄糖模型中,低质量浓度丝氨酸的添加能够明显促进模型产生呋喃,而高质量浓度丝氨酸的添加反而对呋喃产生的作用不明显,这可能是由于高质量浓度的丝氨酸与葡萄糖发生美拉德反应主要生成其他美拉德反应产物,而未大量生成呋喃。
对于半乳糖模型,其产生呋喃的量随着丝氨酸添加量的增加而增长。具体来说,向半乳糖模型中添加了50 mg丝氨酸后,半乳糖模型产生呋喃的量为未添加丝氨酸时的13.5 倍。由此可见,丝氨酸的添加对半乳糖模型产生呋喃具有促进作用,且随着丝氨酸添加量的增加,其促进作用增大。这可能是由于丝氨酸通过与半乳糖发生美拉德反应从而大量生成呋喃。

图6 丝氨酸添加量对葡萄糖和半乳糖模型生成呋喃的影响Fig.6 Effect of serine on furan formation from glucose and galactose model systems
2.4苏氨酸添加量对葡萄糖和半乳糖模型产生呋喃的影响
添加不同含量的苏氨酸对葡萄糖模型和半乳糖模型生成呋喃的影响见图7。当苏氨酸添加量≤5 mg时,葡萄糖模型产生呋喃的量只略有增加;而当苏氨酸添加量>5 mg时,葡萄糖模型产生呋喃的量大幅提高,尤其是添加了50 mg苏氨酸后,葡萄糖模型产生呋喃的量为未添加苏氨酸时的13 倍。同丝氨酸一样,苏氨酸也能在单独存在时发生Strecker反应,生成乙醇醛和乙醛,通过羟醛缩合生成丁醛糖衍生物从而生成呋喃。同时,高质量浓度的苏氨酸能够与葡萄糖模型通过美拉德反应途径大量生成呋喃,从而明显促进葡萄糖模型产生呋喃。
对于半乳糖模型,当苏氨酸添加量≤5 mg时,半乳糖模型产生呋喃的量有一定的增加;而当苏氨酸添加量>5 mg时,半乳糖模型产生呋喃的量大幅提高,尤其是添加了50 mg苏氨酸后,半乳糖模型产生呋喃的量为未添加苏氨酸时的19 倍。同样,高质量浓度的苏氨酸能够与葡萄糖模型通过美拉德反应途径大量生成呋喃,从而明显促进葡萄糖模型产生呋喃,且苏氨酸质量浓度越高,促进作用越明显。
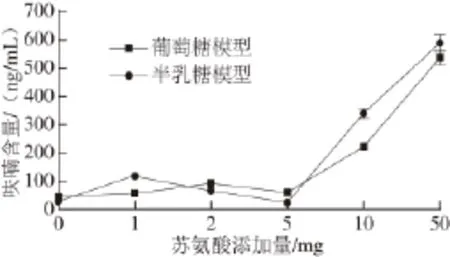
图7 苏氨酸添加量对葡萄糖和半乳糖模型生成呋喃的影响Fig.7 Effect of threonine on furan formation from glucose and galactose model systems
2.5谷氨酸添加量对葡萄糖和半乳糖模型产生呋喃的影响
添加不同含量的谷氨酸对葡萄糖模型和半乳糖模型生成呋喃的影响见图8。随着谷氨酸的添加量从0 mg增长到50 mg,促进了葡萄糖模型产生呋喃。具体来说,添加50 mg谷氨酸,葡萄糖模型产生呋喃量为未添加谷氨酸时的7 倍。这表明高质量浓度的谷氨酸也能够与葡萄糖模型通过美拉德反应途径大量生成呋喃,从而明显促进葡萄糖模型产生呋喃。
同样,随着谷氨酸的添加量从0 mg增长到50 mg,半乳糖模型产生呋喃的量呈上升趋势。具体来说,添加了50 mg谷氨酸,半乳糖模型为未添加谷氨酸时的7 倍。这表明高质量浓度的谷氨酸也能够与半乳糖模型通过美拉德反应途径大 量生成呋喃,明显促进葡萄糖模型产生呋喃,且谷氨酸质量浓度越高,促进作用越强。
2.6不同氨基 酸对葡萄糖和半乳糖模型产生呋喃的比较
对于葡萄糖模型,低质量浓度的甘氨酸、极低质量浓度的丝氨酸和高质量浓度的苏氨酸和谷氨酸的添加能够促进其大量产生呋喃,分别为添加5 mg甘氨酸、1 mg丝氨酸、50 mg苏氨酸和50 mg谷氨酸时产生的呋喃最多,选取这4 个添加条件下葡萄糖模型产生呋喃的含量进行显著性分析,结果如表1所示。

表1 4 种氨基酸对葡萄糖模型产生呋喃作用的比较(x =3)Table 1 Significance test for the effects of amino acids on the generation of furan in glucose model system (x , n = 3)
由表1可知,甘氨酸、丝氨酸、谷氨酸对葡萄糖模型产生呋喃的促进作用并无明显差异,而苏氨酸对葡萄糖模型产生呋喃的促进作用明显强于其余3 种氨基酸(P<0.05)。
对于半乳糖模型,则均是添加高质量浓度的甘氨酸、丝氨酸、苏氨酸和谷氨酸能够促进其大量产生呋喃,50 mg的甘氨酸、丝氨酸、苏氨酸和谷氨酸的添加使得半乳糖模型产生的呋喃最多,对这4 个添加条件下半乳糖模型产生呋喃的含量进行显著性分析,结果如表2所示。

表2 4 种氨基酸对半乳糖模型产生呋喃作用的比较(x ±s,n=3)=3Table 2 Significance test for the effects of amino acids on the generation of furan in galactose model system (x ± s, n n = 3)= 3
由表2可知,谷氨酸对半乳糖模型产生呋喃的促进作用明显弱于其他3 种氨基酸(P<0.05),而甘氨酸、苏氨酸对半乳糖模型产生呋喃的促进作用最强,且它们之间并无明显差异。
3 结 论
本研究通过建立葡萄糖模型和半乳糖模型,模拟密封罐装食品的灭菌条件,121 ℃条件下油浴30 min,研究向模型中加入不同含量的甘氨酸、丝氨酸、苏氨酸、谷氨酸对模型产生呋喃的影响。结果表明,对于葡萄糖模型,低含量(≤5 mg)的甘氨酸、极低含量(1 mg)的丝氨酸、高含量(50 mg)的苏氨酸和谷氨酸的添加能够明显促进其产生呋喃;而对于半乳糖模型,高含量(50 mg)的氨基酸的添加对其产生呋喃的促进作用最明显。对4 种氨基酸促进葡萄糖模型和半乳糖模型产生呋喃的能力进行比较,结果显示,苏氨酸对葡萄糖模型产生呋喃的促进作用明显强于其余3 种氨基酸(P<0.05),对于半乳糖模型,甘氨酸、苏氨酸产生呋喃的促进作用最强,且两者之间无明显差异。
上述实验结果能够应用于美拉德反应中呋喃产生的控制,有助于优化热加工食品的生产配方,为食品生产者挑选合适的、低呋喃产生量的原料提供理论参考,在保证食品色、香、味的同时,尽可能地减少食品中呋喃的产生,保障食品质量安全和公众饮食健康。
[1]MARIOTTI M S, GRANBY K, ROZOWSKI J, et al. Furan: a critical heat induced dietary contaminant[J]. Food & Function, 2013, 4(7):1001-1015.
[2]谢明勇, 黄军根, 聂少平. 热加工食品中呋喃的研究进展[J]. 食品与生物技术学报, 2010, 29(1): 1-8.
[3]IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, International Agency for Research on Cancer, World Health Organization. Dry cleaning, some chlorinated solvents and other industrial chemicals[R]. Lyon: World Health Organization, 1995.
[4]National Toxicology Program. Toxicology and Carcinogenesis Studies of Furan (CAS No. 110-00-9) in F344 rats and B6C3F1 mice (Gavage Studies)[J]. National Toxicology Program Technical Report Series,1993, 402: 1-286.
[5]MOSER G J, FOLEY J, BUMETT M, et al. Furan-induced doseresponse relationships for liver cytotoxicity, cell proliferation, and tumorigenicity (furan-induced liver tumorigenicity)[J]. Experimental and Toxicologic Pathology, 2009, 61(2): 101-111.
[6]BAKHIYA N, APPEL K E. Toxicity and carcinogenicity of furan in human diet[J]. Archives of Toxicology, 2010, 84(7): 563-578.
[7]European Food Safety Authority (EFSA). Update on furan levels in food from monitoring years 2004-2010 and exposure assessment[R]. Parma: EFSA, 2011.
[8]WU Sijia, WANG Enting, YUAN Yuan. Detection of furan levels in select Chinese foods by solid phase microextraction-gas chromatography/mass spectrometry method and dietary exposure estimation of furan in the Chinese population[J]. Food and Chemical Toxicology, 2014, 64: 34-40.
[9]MAGA J A. Furan in foods[J]. Critical Reviews in Food Science and Nutrition, 1979, 11(4): 355-400.
[10] PEREZ-LOCAS C, YAYLAYAN V A. Origin and mechanistic pathways of formation of the parent furan a food toxicant[J]. Journal of Agricultural and Food Chemistry, 2004, 52(22): 6830-6836.
[11] LIMACHER A, KERLER J, DAVIDEK T, et al. Formation of furan and methylfuran by Maillard-type reactions in model systems and food[J]. Journal of Agricultural and Food Chemistry, 2008, 56(10):3639-3647.
[12] BECALSKI A, SEAMAN S. Furan precursors in food: a model study and development of a simple headspace method for determination of furan[J]. Journal of AOAC International, 2005, 88(1): 102-106.
[13] LIMACHER A, KERLER J, CONDE-PETIT B, et al. Formation of furan and methylfuran from ascorbic acid in model systems and food[J]. Food Additives and Contaminants, 2007, 24(Suppl 1): 122-135.
[14] OWCZAREK-FENDOR A, de MEULENAER B, SCHOLL G, et al. Importance of fat oxidation in starch-based emulsions in the generation of the process contaminant furan[J]. Journal of Agricultural and Food Chemistry, 2010, 58(17): 9579-9586.
[15] YAYLAYAN V A. Precursors, formation and determination of furan in food[J]. Journal für Verbraucherschutz und Lebensmittelsicherheit,2006, 1(1): 5-9.
[16] CREWS C, CASTLE L. A review of the occurrence, formation and analysis of furan in heat-processed foods[J]. Trends in Food Science & Technology, 2007, 18(7): 365-372.
[17] MARK J, POLLIEN P, LINDINGER C, et al. Quantitation of furan and methylfuran formed in different precursor systems by proton transfer reaction mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2006, 54(7): 2786-2793.
[18] VRANOVA J, CIESAROVA Z. Furan in food: a review[J]. Czech Journal of Food Sciences, 2009, 27(1): 1-10.
[19] MORO S, CHIPMAN J K, WEGENER J, et al. Furan in heat-treated foods: formation, exposure, toxicity, and aspects of risk assessment[J]. Molecular Nutrition & Food Research, 2012, 56(8): 1197-1211.
[20] 李亚丽, 刘晓徐, 郑培华, 等. 美拉德反应研究进展[J]. 食品科技,2012, 37(9): 82-87.
[21] 王旭, 冯涛, 庄海宁. 氨基酸对美拉德反应产物呈香特性的研究进展[J]. 中国调味品, 2013, 38(7): 1-5.
[22] FINOT P. The Maillard reaction in food processing, human nutrition and physiology[M]. 4th ed. Basel: Birkhauser, 2013: 157-170.
[23] WANG Heya, QIAN He, YAO Weirong. Melanoidins produced by the Maillard reaction: structure and biological activity[J]. Food Chemistry,2011, 128(3): 573-584.
[24] 曾稳稳, 刘玉环, 阮榕生, 等. 美拉德反应所引起的食品安全问题的研究进展[J]. 食品工业科技, 2011, 32(7): 447-450.
[25] 张雅楠, 黄军根, 聂少平, 等. 顶空气相色谱-质谱法检测市售热加工食品中的呋喃[J]. 南昌大学学报: 工科版, 2012, 34(2): 107-110; 119.
Effect of Amino Acids on the Formation of Furan in Glucose and Galactose Model Systems
HONG Tao1, ZHANG Yanan1, SHEN Mingyue1,*, XIE Mingyong1, NIE Shaoping1, LIU Qian1, JIANG Yujie1, XIANG Xia2
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang330047, China;2. Hubei Key Laboratory of Lipid Chemistry and Nutrition, Oilcrops Research Institute, Chinese Academy of Agricultural Sciences,Wuhan430062, China)
Furan is a food contaminant that can be detected in a number of heated foods, especially in canned foods. Carbohydrates can generate furan by thermal degradation or Maillard reaction with amino acids. In order to explore the effects of different amino acids on the generation of furan in glucose and galactose model systems, a series of amino acids(glycine, serine, threonine and glutamic acid) were added to these model systems, which were afterwards heated in oil bath at 121 ℃ for 30 min to simulate the sterilization of canned foods. Headspace-gas chromatography-mass spectrometry(HS-GC-MS) was applied to detect the content of furan. The results demonstrated that the addition of a small amount of glycine (≤ 5 mg), an extremely amount of serine (1 mg), and a large amount of threonine and glutamic acid (50 mg) could significantly increase the formation of furan in glucose model system, while for the galactose model system, the addition of all examined amino acids at large amounts (50 mg) showed promotion effect on the generation of furan. Among four examined amino acids, threonine showed the most significant promotion effect on the generation of furan in glucose model system (P < 0.05). As for galactose model system, both glycine and threonine could significantly increase the formation of furan.
furan; amino acid; glucose; galactose; Maillard reaction; headspace-gas chromatography-mass spectrometry(HS-GC-MS)
TS201.6
A
1002-6630(2015)23-0058-06
10.7506/spkx1002-6630-201523012
2015-06-23
“十二五”国家科技支撑计划项目(2014BAD04B03);国家重点基础研究发展计划(973计划)项目(2012CB720805);教育部“新世纪优秀人才支持计划”项目(NCET-12-0749);油料脂质化学与营养湖北省重点实验室开放基金项目(201502)
洪涛(1994—),男,硕士研究生,研究方向为食品质量与安全。E-mail:13732909218@163.com
申明月(1984—),女,助理研究员,硕士,研究方向为食品化学与分析技术。E-mail:shenmingyue1107@163.com

