超声局部效应对咖啡酸稳定性及抗氧化性的影响
朱攀攀,马亚琴*,窦华亭*,韩 智,李 申
(西南大学柑桔研究所,国家柑桔工程技术研究中心,重庆 400712)
超声局部效应对咖啡酸稳定性及抗氧化性的影响
朱攀攀,马亚琴*,窦华亭*,韩智,李申
(西南大学柑桔研究所,国家柑桔工程技术研究中心,重庆400712)
将超声区域定位划分成高低两个超声辐射面和5 个不同超声位置(P1、P2、P3、P4、P5),对比研究低超声辐射面与高超声辐射面、超声位置、提取溶剂对咖啡酸稳定性及其抗氧化性的影响。结果表明,低超声辐射面能造成咖啡酸显著降解(P<0.05);高超声辐射面、超声能量对咖啡酸稳定性的影响不显著。溶剂类型是影响咖啡酸稳定性的主要因素之一,其中体积分数80%乙醇是咖啡酸理想的提取溶剂。超声槽不同位置上,超声能量的分布是不均一和动态变化的,咖啡酸在P4或P5位置时降解较为显著(P<0.05)。此外,超声处理同样能显著影响咖啡酸的抗氧化性,1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)法、铁离子还原力(ferric reducing antioxidant potential assay,FRAP)法及2,2'-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-amino-di)3-ethyl-benzothiazoline 6-sulphonic acid) ammonium salt,ABTS)法3 种方法测定的咖啡酸抗氧化性的变化规律存在一定差异性。DPPH法与FRAP法同时得到P5位置是影响咖啡酸抗氧化性最显著的位置,该位置咖啡酸降解产物的抗氧化性高于咖啡酸自身的。不同超声辐射面上,ABTS法测定咖啡酸的抗氧化性与其含量成正相关,而DPPH自由基清除能力与其含量成负相关。以上表明低超声辐射面,有效的超声能量能显著影响咖啡酸的稳定性和增加其抗氧化性。
超声辐射面;超声波位置;咖啡酸;抗氧化
咖啡酸及其类似物广泛存在于水果和蔬菜中,具有抗菌[1-2]、抗氧化[3]、抗肿瘤[4-5]等生物活性,其分子结构中含有两个羟基、碳碳双键及羧基,易发生聚合、氧化、加成等反应,是肉桂酸型酚酸中最易降解的一种单酸[6-7]。
近年来,超声波技术己广泛应用于各种天然活性物质的提取,与传统的提取方法比较,具有低温、快速、高效、环保等优势。20世纪50年代,超声波技术已在实验室开始应用于增强提取效率的研究。随后,超声强化提取逐渐得到认可并开始迅猛发展。Paniwnyk等[8]从槐树花芽中超声强化提取芦丁,发现不当的超声处理导致提取量的下降。Ma Yaqin等[9]研究了利用超声波辅助同时提取柑橘皮渣中的7 种酚酸,发现不同酚酸的超声条件存在差别,超声温度对提取结果影响最显著,超过40 ℃易造成咖啡酸降解。Khan等[10]同样也利用超声波辅助从柑橘皮渣中提取酚酸,并用中心组合试验设计法对提取工艺进行了优化。Qiao Liping等[11]在模拟体系中研究了超声处理对酚酸的影响,得出了溶剂和温度是影响酚酸降解最重要的因素,酚酸的降解动力学符合零级动力学模型,其降解是因为发生了分解和聚合反应等。同时,Sun Yujing等[12]研究了超声处理引起咖啡酸降解的机理,得出与Qiao Liping等[11]相似的结论,并用红外光谱等方法分析了降解产物是其脱羧产物或二聚体。因此,不当的超声处理易引起酚酸的降解,一方面是归于酚酸自身结构的不稳定性及物理化学性质差异;另一方面,超声场具有不均一性,整个超声场中超声能量是动态变化的,而超声能量动态变化的定量检测是目前研究的难点和热点。Ma Yaqin等[13]利用超声波从椪柑皮中提取橙皮苷发现,超声能量对橙皮苷提取效率的影响不显著。由于超声能量存在特定的活性区域,并随传播距离的增加会发生吸收、散射或衰减。Romdhane等[14]同样得到最高的超声能量存在于超声换能器附近且在超声换能器直径为6 cm辐射面以外能量急剧下降的结论。而局部超声场中超声参数对咖啡酸稳定性及抗氧化性的定位研究鲜有报道。
基于超声能量随传播距离的增加而衰减的特性,及整个超声场中超声能量的不均一性,本研究将超声槽从横截面、纵截面、超声位置[15]定位划分,其超声辐射面根据超声活性区域存在于超声换能器附近直径为6 cm的范围而确定[14,16],6 cm的高度称为低超声辐射面,选择高超声辐射面(14 cm高度)与低辐射面作以比较。同时为简化实验,本研究在模拟体系中研究了超声场区域处理对咖啡酸含量及抗氧化性的影响。通过超声场中咖啡酸含量及抗氧化性的变化规律来分析超声参数在不同超声区域的特性,这有助于从根本上优化提取工艺和更有效发挥超声波技术在食品加工中的作用。
1 材料与方法
1.1材料与试剂
甲醇、乙醇、冰乙酸(均为分析纯)成都市科龙化工试剂厂;咖啡酸标准品(纯度≥98%)北京百灵威科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,4,6-反式-2-吡啶基三嗪(1,3,5-tri(2-pyridyl)-2,4,6-triazine,TPTZ)、6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸(Trolox)、2,2'-联氮-二(3-乙基-苯并噻唑啉-6-磺酸)二铵盐(2,2'-amino-di (2-ethyl-benzothiazoline-6-sulphonic acid) ammonium salt,ABTS)、甲醇(色谱级)美国Sigma公司。
1.2仪器与设备
DP-800超声波清洗器上海生析超声仪器有限公司;低温恒温槽宁波天恒仪器厂;FAZ004B电子分析天平上海精密仪器仪表有限公司;Ultimate3000高效液相色谱仪戴安中国有限公司;TTL-DCI氮吹仪北京同泰联科技发展有限公司;TU-1901紫外-可见分光光度计北京普析通用仪器有限责任公司;移液枪大龙兴创实验仪器(北京)有限公司。
1.3方法
1.3.1超声波处理
准确称取2.5 mg咖啡酸标准品,用80%乙醇、100%甲醇两种溶剂分别溶解定容至5 mL容量瓶中,并将以上母液分别稀释至10 .g/mL。用移液枪准确移取8 mL样液(超声槽水位而定)至250 mL的锥形瓶中并用封口膜密封放于事先划定的局部超声槽中(低超声辐射面(6 cm)处的P1、P2、P3、P4、P5;低超声辐射面(14 cm)处的P1、P2、P3、P4、P5,图1),连接低温恒温槽循环系统控制超声槽温度为25 ℃,25 kHz,800 W超声处理60 min,重复3 次。

图1 超声波设备示意图Fig.1 Schematic diagram of the ultrasonic apparatus
1.3.2咖啡酸含量的测定
1.3.2.1标准曲线的制作
采用高效液相色谱(high performance liquid chromatography,HPLC)测定咖啡酸的含量。检测条件:Thermo Fisher色谱柱(4.6 mm×250 mm ,5 μm);柱温30 ℃;流动相:1%冰乙酸-纯甲醇(75∶25,V/V);流速:1 mL/min;进样量:20 μL;波长:320 nm;外标法定量测定。
标准曲线的绘制:准确称取2.5 mg的咖啡酸标准品,纯甲醇溶解并定容至5 mL容量瓶中作为母液,将以上母液稀释至10 .g/mL,按5、10、15、20、30、40 .L的体积梯度进样。以咖啡酸质量浓度为横坐标,峰面积为纵坐标,得到咖啡酸的标准曲线为y=211.86x-0.330 9(R2=0.999 8)。
1.3.2.2HPLC测定
用移液枪准确移取1 mL超声处理液置于氮吹仪上蒸发浓缩至干并用1 mL 50%的甲醇溶解,经0.45 .m滤膜后注入进样瓶中待测备用。
1.3.3酚酸抗氧化性的测定
1.3.3.1DPPH自由基清除能力测定
纯甲醇溶剂配制0.1 mmol/L DPPH溶液。移液枪移取50 .L样品与1.95 mL DPPH溶液混合。同样移取50 .L对应溶剂与1.95 mL DPPH溶液混合作空白对照,暗室静置10 min后,采用TU-1901紫外分光光度计在517 nm波长处测其吸光度[17]。DPPH自由基清除率按以下公式计算。
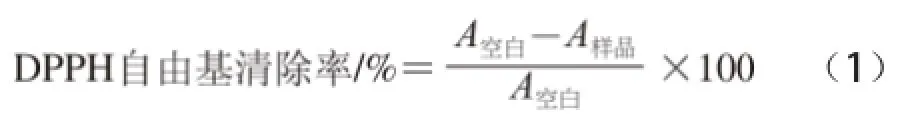
1.3.3.2铁离子还原力(ferric reducing antioxidant potential assay,FRAP)测定
0.1 mL样品与2.45 mL FRAP溶液(0.1 mol/L醋酸缓冲液(pH 3.6)、10 mmol/L TPTZ(溶于40 mmol/L HCl)、20 mmol/L FeCl3以体积比10∶1∶1配制)混合,另取0.1 mL对应溶剂与2.45 mL FRAP溶液混合均匀作空白对照,空白校零,暗反应30 min后,在593 nm波长处测定其最大吸光度[18]。用Trolox溶液制作标准曲线,铁离子还原力用每克样品的Trolox的当量表示。
1.3.3.3ABTS+·清除能力测定
将2.45 mmol/L的过硫酸钾溶液和7 mmol/L的ABTS溶液按体积比0.5∶1混合,避光反应12~16 h。用无水乙醇稀释ABTS溶液至吸光度为0.7±0.02。取3.9 mL ABTS溶液与0.1 mL样品,另取3.9 mL ABTS溶液与0.1 mL 对应溶剂作空白对照,混合反应10 min后于734 nm波长处测其吸光度[19]。以Trolox当量表示抗氧化能力。

式中:A0为空白对照吸光度;At为样品与ABTS溶液反应后的吸光度。
1.4数据分析
数据处理采用Excel和Origin 9.0分析软件,用SPSS 20.0进行方差分析(ANOVA),数据结果表示为±s,P<0.05为差异显著。
2 结果与分析
2.1溶剂类型对咖啡酸稳定性的影响
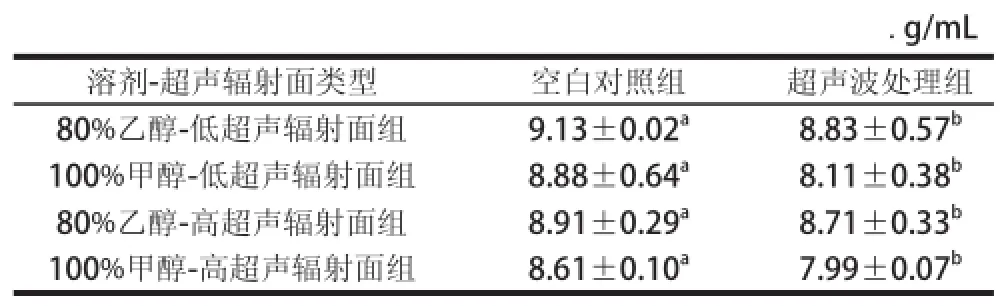
表1 溶剂类型对咖啡酸稳定性的影响Table 1 Effect of solvent type on the stability of caffeic acid
由表1可知,同一超声辐射面,溶剂类型对咖啡酸含量的影响较为显著,咖啡酸在80%乙醇中的稳定性高于100%甲醇。一方面,超声过程中溶剂分子的物理特性(包括表面张力、黏度、蒸汽压等),可能影响咖啡酸的稳定性[20],其中分子的蒸汽压是影响溶剂物理特性的主要因素,溶剂的蒸汽压又正比于其沸点,80%乙醇沸点较高,故咖啡酸在80%乙醇中不易降解;另一方面,不同溶剂分子的亲和力不同[21],80%乙醇溶剂分子中含有水分子氢键,使其亲和力高于100%甲醇,咖啡酸在80%乙醇的稳定性较高。Zhang Qingan等[22]在研究超声处理对没食子酸稳定性的影响中得到没食子酸在乙醇中的降解率最小。但Qiao Liping等[11]在模型实验中研究超声场对自由基酚酸超声化学效应时,得到咖啡酸在80%乙醇中降解率较高,Sun Yujing等[12]在研究咖啡酸的降解动力学中也得出了咖啡酸在80%乙醇中具有最高的超声化学效应,降解率较高,与本实验结果存在一定差异性,需要进一步验证。
由表1可知,不同超声辐射面处理下溶剂对咖啡酸稳定性的影响差异显著(P<0.05)。与空白对照组相比,咖啡酸在100%甲醇-低超声辐射面中与80%乙醇-高超声辐射面中其质量浓度分别下降了8.67%和0.02%,降解较为显著(P<0.05)。这可能由于咖啡酸自身结构特点和超声化学效应协同作用的结果。咖啡酸结构中有两个羟基和碳碳双键,是肉桂酸型酚酸最易降解的一种,在超声场中易发生取代、加成等反应而出现降解[11]。因此,溶剂类型能显著影响咖啡酸的稳定性,80%乙醇是咖啡酸理想的提取溶剂。
2.2超声位置对咖啡酸稳定性的影响

图2 局部超声位置对咖啡酸稳定性的影响Fig.2 Effect of local ultrasonic position on the stability of caffeic acid
由图2可知,局部超声场中超声能量是动态变化的。不同溶剂-超声辐射面处理,咖啡酸质量浓度随超声槽位置的变化具有相似的变化规律,即从P1到P5,咖啡酸质量浓度先增加再减小,P5位置又出现上升趋势,且均在P4位置出现一个极小值。原因在于超声场中存在活性区域,高的超声能量分布仅存在于活性区域的范围,并随超声中心轴距离的增加,超声活性区域随之减弱,相关研究表明超声槽中不同位置的超声能量是不同的[15,23]。此外,咖啡酸的稳定性可能与超声化学作用和提取溶剂的叠加效应有关。低超声辐射面时,超声能量较大,对应的超声化学效应较强,P4位置咖啡酸质量浓度显著降解,尤其是低超声辐射面下降趋势较显著(P<0.05),说明其对咖啡酸稳定性的影响可能大于溶剂类型的影响。同样,溶剂类型可能与不同超声槽位置上超声能量存在交互作用,但需要进一步探讨。以上可知,低超声辐射面-P4可能是本实验中超声槽的活性区域,能显著影响咖啡酸的稳定性。
2.3超声辐射面处理对咖啡酸抗氧化性的影响
2.3.1DPPH自由基清除能力

图3 局部超声位置对DPPH自由基清除能力的影响Fig.3 Effect of local ultrasonic position on DPPH radical scavenging capacity
由图3可知,空白对照组咖啡酸的DPPH自由基清除能力变化不明显,在不同超声槽位置处理咖啡酸,DPPH自由基清除率差异显著(P<0.05)。这是由于超声场是一个能量不均一的区域,不同位置上的超声效应也是动态的[15]。已有研究从芒果叶中超声提取芒果苷并得到最大的提取率与超声槽的位置有关[24]。不同超声辐射面上,低超声辐射面的DPPH自由基清除率整体比高超辐射面低(P5位置除外)。低超辐射面超声能量较大,空穴效应较强,使易于降解的咖啡酸发生不同程度的由自由基介导的降解反应[11-12],咖啡酸表现出较弱的抗氧化能力。P5位置咖啡酸虽显著降解,但可能其降解产物的自由基清除率比咖啡酸本身强,整体表现出较强的DPPH自由基清除率。高超声辐射面在P2位置DPPH自由基的清除率最大,P1、P5位置次之并无显著性差异,且均比空白对照组的DPPH自由基清除率大。原因在于有效的超声处理能提高提取物的抗氧化能力[25]。
2.3.2总还原力

图4 局部超声位置对FRAP值的影响Fig.4 Effect of local ultrasonic position on FRAP value
由图4可知,低超声辐射面上,80%乙醇为提取溶剂时,P5位置上咖啡酸的FRAP值较空白对照组提高了57.87%(P<0.05)。这是由于有效的超声处理提高了咖啡酸的抗氧化性。同一超声辐射面,高超声辐射面上,从P1到P5,80%乙醇为溶剂的咖啡酸的FRAP值高于100%甲醇的。而在低超声辐射面上,则表现出相反的趋势(除P4、P5外)。低超声辐射面上,超声场中的能量较高,具有较强的超声效应,其对咖啡酸抗氧化性的影响占主导作用。这与Romdhane等[26]研究超声装置时得出离超声中心轴3 cm时,超声能量逐渐减小的结论相类似。高超声辐射面上,提取溶剂是影响其抗氧化性的主要因素,80%乙醇有利于咖啡酸的溶出而表现出较强的抗氧化性。
2.3.3ABTS+·清除能力
由图5可知,不同超声位置上,ABTS+·清除率表现出不均一性。低超声辐射面上,P4或P5上咖啡酸抗氧化能力最小,这是由于较强的超声场效应使咖啡酸发生了降解(P<0.05)。不同超声辐射面,空白对照组的抗氧化性均高于超声处理后的,超声处理使不稳定的咖啡酸发生了降解,即咖啡酸的含量与其抗氧化性成正相关[27-29]。此外,超声槽同一位置上,低超声辐射面的咖啡酸抗氧化性均高于高超声辐射面的抗氧化性,这与DPPH法得出的结论存在差异。这可能由于较强的超声能量具有较强的空穴效应,显著增加了咖啡酸降解体系中的抗氧化成分和提高降解产物的抗氧化性(P<0.05)。同一超声辐射面,低超声辐射面上的100%甲醇咖啡酸的抗氧化性随超声位置的变化均比80%乙醇的高。这可能由于100%甲醇为溶剂的咖啡酸的降解产物具有更强的抗氧化性。咖啡酸降解体系中的抗氧化成分及其抗氧化性强弱需要进一步分析。

图5 局部超声位置对ABBTTSS+·清除率的影响Fig.5 Effect of local ultrasonic position on ABTS radical scavenging capacity
3 结 论
本研究结果表明,在低超声辐射面处理咖啡酸比高超声辐射面对咖啡酸稳定性和抗氧化性影响显著。溶剂类型是影响超声提取的重要因素,80%乙醇是提取咖啡酸的理想溶剂,而100%甲醇易造成咖啡酸的降解。咖啡酸含量随超声槽位置的不同而有所差异,其中P4或P5位置可能是本实验超声场中的活性区域。低超声辐射面不同位置上的超声空穴效应与溶剂类型之间存在的叠加作用也显著影响咖啡酸的稳定性和其抗氧化性,这方面的研究有待于进一步的开展。利用3 种方法测定不同超声辐射面处理对咖啡酸抗氧化性的影响,发现3 种方法得到的抗氧化值变化规律存在一定差异。DPPH法与FRAP法同时得到低超声辐射面P5位置上咖啡酸降解产物具有更强的抗氧化能力。ABTS法得到咖啡酸的含量与其抗氧化性成正相关,不同超声位置上,低超声辐射面咖啡酸的抗氧化性高于高超声辐射面的。综上,整个超声区域存在活性区域(低超声辐射面(6 cm)-P4或P5),同时该区域能显著影响咖啡酸等活性物质的稳定性和抗氧化性,这对设计专用超声设备和从根本上优化提取工艺具有一定的参考价值。
[1]SANCHEZ-MALDONADO A F, SCHIEBER A, GAENZLE M G. Structure-function relationships of the antibacterial activity of phenolic acids and their metabolism by lactic acid bacteria[J]. Journal of Applied Microbiology, 2011, 111(5): 1176-1184.
[2]AYAZ F A, HAYIRLIOGLU-AYAZ, ALPAY-KARAOGLU S. Phenolic acid contents of kale (Brassica oleraceae L. var. acephala DC.) extracts and their antioxidant and antibacterial activities[J]. Food Chemistry, 2008, 107(1): 19-25.
[3]ASHIDATE K, KAWAMURA M, MIMURA D. Gentisic acid, an aspirin metabolite, inhibits oxidation of low-density lipoprotein and the formation of cholesterol ester hydroperoxides in human plasma[J]. European Journal of Pharmacology, 2005, 513(3): 173-179.
[4]SHARMA S, KHAN N, SULTANA S. Study on prevention of twostage skin carcinogenesis by Hibiscus rosa sinensis extract and the role of its chemical constituent, gentisic acid, in the inhibition of tumour promotion response and oxidative stress in mice[J]. European Journal of Cancer Prevention, 2004, 13(1): 53-63.
[5]BALAKRISHNAN S, MENON V P, MANOHARAN S. Ferulic acid inhibits 7,12-dimethylbenz[a]anthracene-induced hamster buccal pouch carcinogenesis[J]. Journal of Medicinal Food, 2008,11(4): 693-700.
[6]MOON J K, SHIBAMOTO T. Formation of volatile chemicals from thermal degradation of less volatile coffee components: quinic acid,caffeic acid, and chlorogenic acid[J]. Journal of Agricultural and Food Chemistry, 2010, 58(9): 5465-5470.
[7]JIANG D, PETERSON D G. Role of hydroxycinnamic acids in food flavor: a brief overview[J]. Phytochemistry Reviews, 2009, 9(1): 187-193.
[8]PANIWNYK L, BEAUFOY E, LORIMER J P, et al. The extraction of rutin from flowerbuds of Sophora japonica[J]. Ultrasonics Sonochemistry, 2001, 8(3): 299-301.
[9]MA Yaqin, CHEN Jianchu, LIU Donghong, et al. Simultaneous extraction of phenolic compounds of citrus peel extracts: effect of ultrasound[J]. Ultrasonics Sonochemistry, 2009, 16(1): 57-62.
[10] KHAN M K, ABERT-VIAN M, FABIANO-TIXIER A S, et al. Ultrasound-assisted extraction of polyphenols (flavanone glycosides)from orange (Citrus sinensis L.) peel[J]. Food Chemistry, 2010,119(2): 851-858.
[11] QIAO Liping, YE Xingqian, SUN Yujing, et al. Sonochemical effects on free phenolic acids under ultrasound treatment in a model system[J]. Ultrasonics Sonochemistry, 2013, 20(4): 1017-1025.
[12] SUN Yujing, QIAO Liping, YE Xingqian, et al. The sonodegradation of caffeic acid under ultrasound treatment: relation to stability[J]. Molecules, 2013, 18(1): 561-573.
[13] MA Yaqin, YE Xingqian, HAO Yunbin, et al. Ultrasound-assisted extraction of hesperidin from Penggan (Citrus reticulata) peel[J]. Ultrasonics Sonochemistry, 2008, 15(3): 227-232.
[14] ROMDHANE M, GOURDON C, ROMDHANE M, et al. Investigation in solid-liquid extraction: influence of ultrasound[J]. Chemical Engineering Journal, 2002, 87(1): 11-19.
[15] KANTHALE P M, GOGATE P R, PANDIT A B, et al. Mapping of an ultrasonic horn: link primary and secondary effects of ultrasound[J]. Ultrasonics Sonochemistry, 2003, 10(6): 331-335.
[16] 马亚琴. 超声辅助提取柑橘皮中黄酮、酚酸及其抗氧化能力的研究[D]. 杭州: 浙江大学, 2008: 61-62.
[17] BRAND-WILLIAMS W, CUVELIER M E, BERSET C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology, 1995, 28(95): 25-30.
[18] BENZIE I F, STRAIN J J. The ferric reducing ability of plasma (FRAP)as a measure of “antioxidant power”: the FRAP assay[J]. Analytical Biochemistry, 1996, 239(1): 70-76.
[19] THAIPONG K, BOONPRAKOB U, CROSBY K, et al. Comparison of ABTS, DPPH, FRAP, and ORAC assays for estimating antioxidant activity from guava fruit extracts[J]. Journal of Food Composition & Analysis, 2006, 19(6): 669-675.
[20] SUN Yujing, LIU Donghong, YE Xingqian, et al. Stability of all-transβ-carotene under ultrasound treatment in a model system: effects of different factors, kinetics and newly formed compounds[J]. Ultrasonics Sonochemistry, 2010, 17(4): 654-661.
[21] HEMWIMOL S, PAVASANT P, SHOTIPRUK A. Ultrasound-assisted extraction of anthraquinones from roots of Morinda citrifolia[J]. Ultrasonics Sonochemistry, 2006, 13(6): 543-548.
[22] ZHANG Qingan, SHEN Hui, FAN Xuehui, et al. Changes of gallic acid mediated by ultrasound in a model extraction solution[J]. Ultrasonics Sonochemistry, 2015, 22: 149-154.
[23] RAO M, CHEN Q, SHI H, et al. Normal and shear strain estimation using beam steering on linear-array transducers[J]. Ultrasound in Medicine & Biology, 2007, 33(1): 57-66.
[24] KULKARNI V M, RATHOD V K. Mapping of an ultrasonic bath for ultrasound assisted extraction of mangiferin from Mangifera indica leaves[J]. Ultrasonics Sonochemistry, 2014, 21(2): 606-611.
[25] 马亚琴, 叶兴乾, 吴厚玖, 等. 超声处理对琯溪蜜柚果皮中酚酸含量及抗氧化性的影响[J]. 食品科学, 2011, 32(7): 25-29.
[26] ROMDHANE M, GOUDON C, CASAMATTA G. Local investigation of some ultrasonic devices by means of a thermal sensor[J]. Ultrasonics, 1995, 33(3): 221-227.
[27] SUN Yujing, QIAO Liping, SHEN Yan, et al. Phytochemical profile and antioxidant activity of physiological drop of citrus fruits[J]. Journal of Food Science, 2013, 78(1): C37-C42.
[28] XU Guhua, LIU Donghong, CHEN Jianchu, et al. Juice components and antioxidant capacity of citrus varieties cultivated in China[J]. Food Chemistry, 2008, 106(2): 545-551.
[29] XI Wanpeng, ZHANG Yuanmei, SUN Yujing, et al. Phenolic composition of Chinese wild mandarin (Citrus reticulata Balnco.)pulps and their antioxidant properties[J]. Industrial Crops and Products, 2014, 52(9): 466-474.
Effect of Local Ultrasound on Stability and Antioxidant Capacity of Caffeic Acid in a Model System
ZHU Panpan, MA Yaqin*, DOU Huating*, HAN Zhi, LI Shen
(National Citrus Engineering Research Center, Citrus Research Institute, Southwest University, Chongqing400712, China)
The space of ultrasonic bath was divided according to height and position into high and low ultrasonic irradiation surface each with five sections such as P1, P2, P3, P4 and P5. The effects of ultrasonic-assisted extraction parameters including solvent type and locally ultrasonic positions on the stability and antioxidant capacity of caffeic acid under different ultrasonic irradiation surfaces (at 6 cm and 14 cm high from the bottom) were comparatively analyzed in the present study. The results showed that caffeic acid was markedly degraded in low irradiation surface (P < 0.05). However, ultrasonic energy had no significant impact on the stability of caffeic acid in high irradiation surface. The type of solvent was one of the key factors in determining the stability of caffeic acid and 80% ethanol was the optimal solvent. In the meantime, the ultrasonic energy distribution was uneven and dynamic in the local positions, and the content of caffeic acid was decreased significantly in P4 or P5 of ultrasonic bath (P < 0.05). Moreover, the antioxidant activities of caffeic acid as determined by DPPH, FRAP and ABTS methods exhibited a big difference. Simultaneously, the position of P5 greatly affected antioxidant activity of caffeic acid evaluated by DPPH and FRAP methods, and of its degraded products had much higher antioxidant activity. Additionally, antioxidant capacity of caffeic acid as determined by ABTS method was positively correlated with its content, but DPPH free radical scavenging capacity had a negative correlation. These findings indicated that appropriate ultrasonic energy could change greatly the stability of caffeic acid and simultaneously enhance its antioxidant capacity in low irradiation surface.
ultrasonic irradiation surface; locally ultrasonic position; caffeic acid; antioxidant capacity
TS255.1;TS201.2
A
1002-6630(2015)23-0012-06
10.7506/spkx1002-6630-201523003
2015-05-22
国家自然科学基金青年科学基金项目(31201459);国家现代农业(柑橘)产业技术体系建设专项(CARS-27-05C)
朱攀攀(1990—),女,硕士研究生,研究方向为食品化学与营养。E-mail:zpp2302090137@163.com
马亚琴(1978—),女,副研究员,博士,研究方向为食品科学。E-mail:myaya211@163.com窦华亭(1961—),男,研究员,博士,研究方向为食品科学。E-mail:hdou33880@yahoo.com

