响应面分析法优化植酸合成工艺
刘倩倩
(菏泽学院药物科学与技术系,山东菏泽27400)
响应面分析法优化植酸合成工艺
刘倩倩
(菏泽学院药物科学与技术系,山东菏泽27400)
采用肌醇为原料,以P2O5为磷化剂,通过磷化、合成、脱色、过滤制备植酸。在单因素试验的基础上,根据中心组合(Box-Benhnken)试验设计原理采用三因素三水平的响应面分析法优化植酸合成工艺条件,在分析各个因素的显著性和交互作用后,得到植酸合成最佳工艺条件:H2O与P2O5的反应摩尔比为2.1,合成温度174℃,合成时间3.3 h,其植酸含量最高为80.32%。
肌醇;植酸;合成;响应面分析
植酸的化学名称为肌醇六磷酸酯(Phytic acid),即环己六醇六磷酸酯,磷的含量可以达到50%~80%,分子式是C6H18O24P6,分子量是660.04。植酸是从植物种籽中提取的一种有机磷酸类化合物,其广泛存在于植物种子中,是天然的营养品[1-2]。植酸有着广泛而独特的用途,具有良好的螯合作用和防腐蚀功能;同时植酸在人体内水解产物为肌醇和磷脂(前者具有抗衰老作用,后者是人体细胞重要组成部分),能促进人体新陈代谢、调理人体功能。植酸广泛应用于食品、化学及医药等领域[3-4]。目前植酸的生产方法有生物合成、溶剂萃取法、化学合成3种[5]。溶剂萃取法使用的原材料中植酸的含量很低,投资大,污染严重而且投入产出比低,经济效益差。生物合成法目前技术不成熟;化学合成法的原材料有质量保证,产品收率及纯度高而且节能环保,因此在植酸生产行业有很大的竞争优势[6-7]。本实验就是以肌醇和五氧化磷为原料合成植酸,此方法和传统的提取工艺相比,提高了产品的收率和质量,污染小,有利于植酸的生产规模化。
1试验部分
1.1仪器和试剂
电热恒温鼓风干燥箱:上海森信实验仪器有限公司;紫外分光光度计:北京普析通用仪器有限责任公司;肌醇(BR)、五氧化二磷(AR)、钼酸铵(AR)、偏钒酸胺(AR)。
1.2试验方法
1.2.1试验原理
试验原理如下:
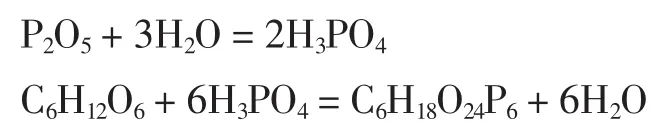
P2O5与水在一定温度下生成H3PO4,然后H3PO4与肌醇在一定温度下反应生成植酸,得到植酸粗品,为黄色的黏稠液体(其中磷酸中的PO43-与肌醇中的6个C原子结合形成对称的六圆环结构),然后用活性炭进行脱色处理,得到透明的黏稠状液体。植酸含量的检测利用紫外分光广度法,该方法快速、简便、准确度较高。
1.2.2单因素试验
实验中对植酸合成时间、合成温度、H2O与P2O5的反应摩尔比3种因素进行单因素考察,选取最佳的反应条件。
1.2.3响应面法优化试验
为了考察各因素间的交互作用并得到最佳的植酸合成条件,在单因素试验的基础上进行响应面优化设计。
2结果与讨论
2.1单因素试验
2.1.1植酸合成时间对植酸含量的影响
实验选定反应温度为175℃,并在此温度下确定了6个时间点,即:1、2、3、4、5、6 h,然后按上述实验步骤反应,所得植酸含量曲线图如图1所示。

图1 合成时间对植酸含量的影响Fig.1Eeffect of Phytic acid content on synthesis time
从图1中可以看出,随着反应时间的延长植酸含量逐渐增加,反应4 h左右为最佳的反应时间,反应时间过短会导致反应不完全,而反应时间过长又会造成副反应的生成。
公路建设破坏原有的生态环境破坏,将会导致生态系统多样性和生物栖息地的退化。生态环境的破坏,导致生物栖息地越来越小甚至丧失,将会直接导致物种种数和数量的减少,导致生物多样性的下降。水土流失导致生态环境恶化,野生物种适宜生境急剧减少,野生物种分布范围日益狭窄。如果土壤侵蚀继续加剧,灭绝的趋势将加速发展。
2.1.2植酸合成温度对植酸含量的影响
试验选定反应时间为3 h,并在固定此时间下确定6个温度点,即:130、145、160、175、190、205℃,然后按上述实验步骤反应。所得到的植酸含量曲线图如图2所示。
从图2中可以看出反应温度在175℃时所得的植酸含量最高,反应温度过高会造成植酸分解。
2.1.3H2O与P2O5摩尔比对植酸含量的影响
按理论计算反应过程中所需的H2O与P2O5的反应摩尔比为3,即:23.43克P2O5和9 mL水,再与10 g肌醇反应,考虑到反应制备植酸时也会生成水,所以反应过程中加入2 g P2O5以加快反应进行。单因素试验过程中分别选取H2O与P2O5反应摩尔比为1、2、3、4、5时进行考察。所得到的植酸含量曲线图如图3所示。

图2 合成温度对植酸含量的影响Fig.2Eeffect of Phytic acid content on synthesis temperature
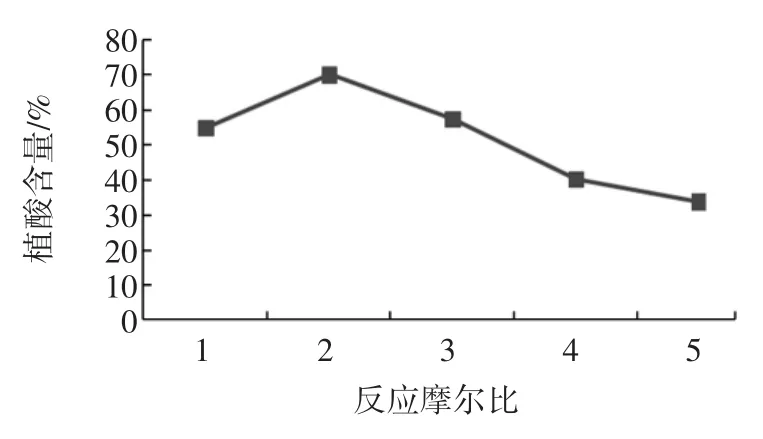
图3 反应摩尔比对植酸含量的影响Fig.3Eeffect of Phytic acid content on reaction ratio
2.2响应面优化合成工艺条件
2.2.1响应面试验设计及结果
根据单因素试验结果选取植酸合成温度、合成时间、H2O与P2O5的反应摩尔比进行考察。采用Design-Expert软件,以A代表温度,B代表时间,C代表H2O与P2O5的反应摩尔比,Y代表植酸含量作为响应指标,由Box-Behnken中心组合进行三因素三水平试验,分析因素与设计见表1。
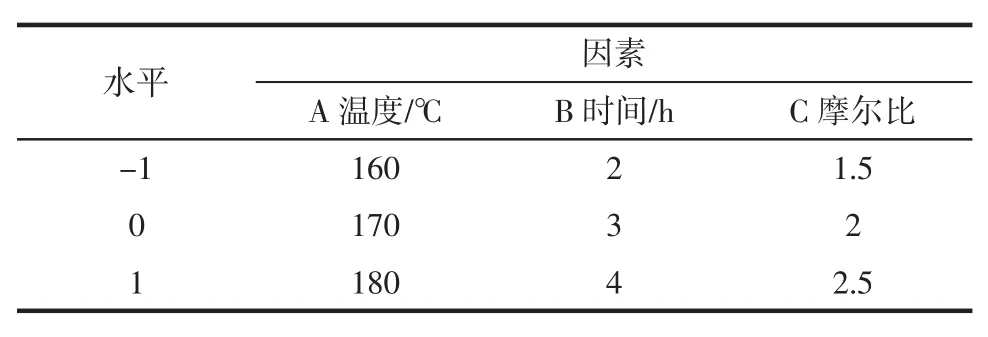
表1 响应面的因素水平表Table 1Factors and levels of response surface experiment
对合成温度、反应时间、反应摩尔比作如下变化:A=(T-170)/10,B=(t-3)/1,C=(Z-2)/0.5,设计试验与结果见表2和表3,由Design-Expert软件处理得到的响应面分析结果见图4~图6,表2设计了17个试验,然后利用统计分析软件Design-Expert对实验结果进行分析,得出产品植酸含量与合成温度(A)、合成时间(B)、H2O与P2O5的反应摩尔比(C)之间的二次多项回归模型方程如下:

表2 Box-Behnken中心组合试验设计及实验结果Table 2Box-Behnken Cenral composite design and experimental results
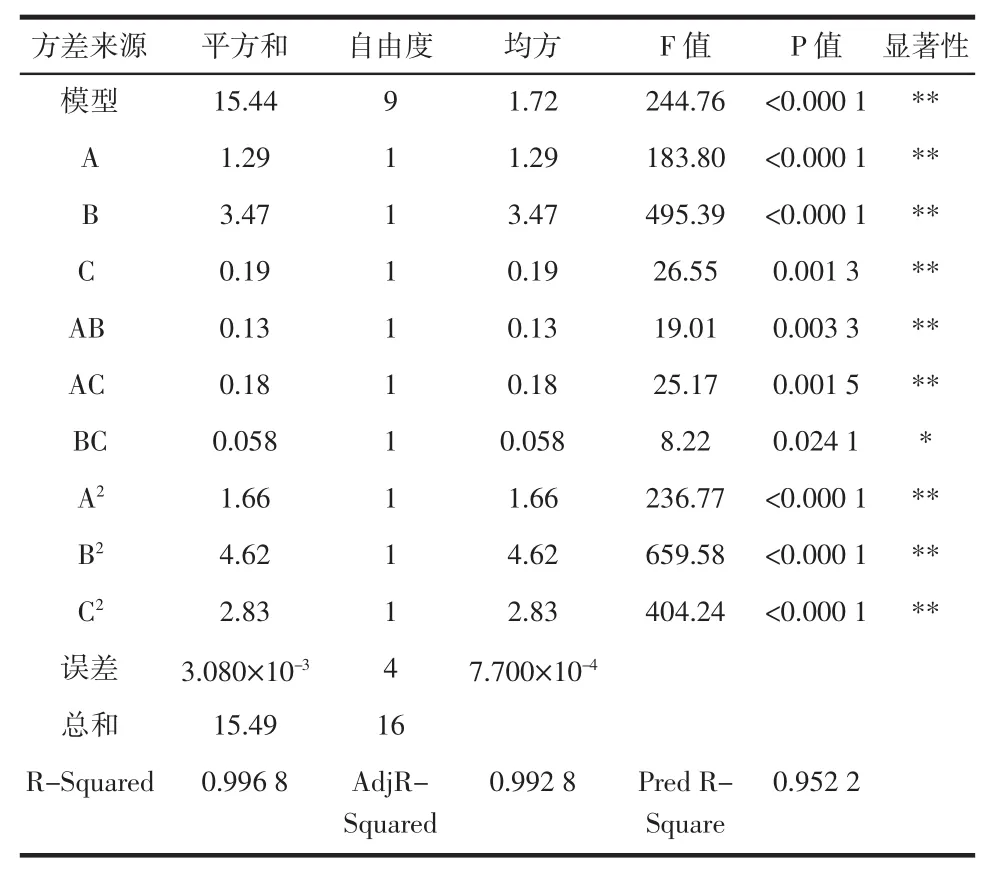
表3 回归模型的方差分析及显著性检验Table 3Analysis of variance and significance test of the regression model
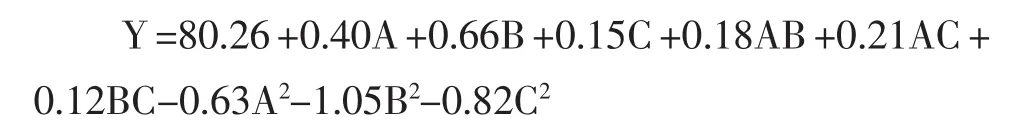
由表3的方差分析结果可知:该数学模型P值<0.000 1,说明该模型极其显著,各因素的一次项A、B、C是极其显著的,二次项A2、B2、C2是极其显著的,交互项A B、A C也是极其显著的,由此可见,各因素对植酸含量的影响不是简单的线性关系,存在因素间的相互作用。线性方程的的相关系数R2=0.996 8,调整系数Adj R2=0.985 0,具有良好的一致性,表明该模型的准确性和适用性较好。因此,回归方程可以很好的描述各因素和响应值之间的真实关系,可以利用该方程确定最佳工艺条件,对回归方程取一阶偏导等于零,整理得:

联立上述三个方程求解得到,A=0.41,B=0.345,C=0.18,由前面的变换方程可以得出:合成温度T= 174℃,合成时间t=3.3 h,H2O与P2O5的反应摩尔比Z=2.1,在此条件下实际测得植酸含量为80.32%.回归模型预测植酸含量理论值可达80.45%,实际测定值比理论预测值低0.16%。说明该数学模型能很好的预测各因素同植酸含量之间的关系。
2.2.2各因素之间的交互作用
根据回归方程,做出响应面分析图,其中对植酸含量影响表现显著和极其显著的交互项(AB、AC、BC)的响应面图如图4所示。
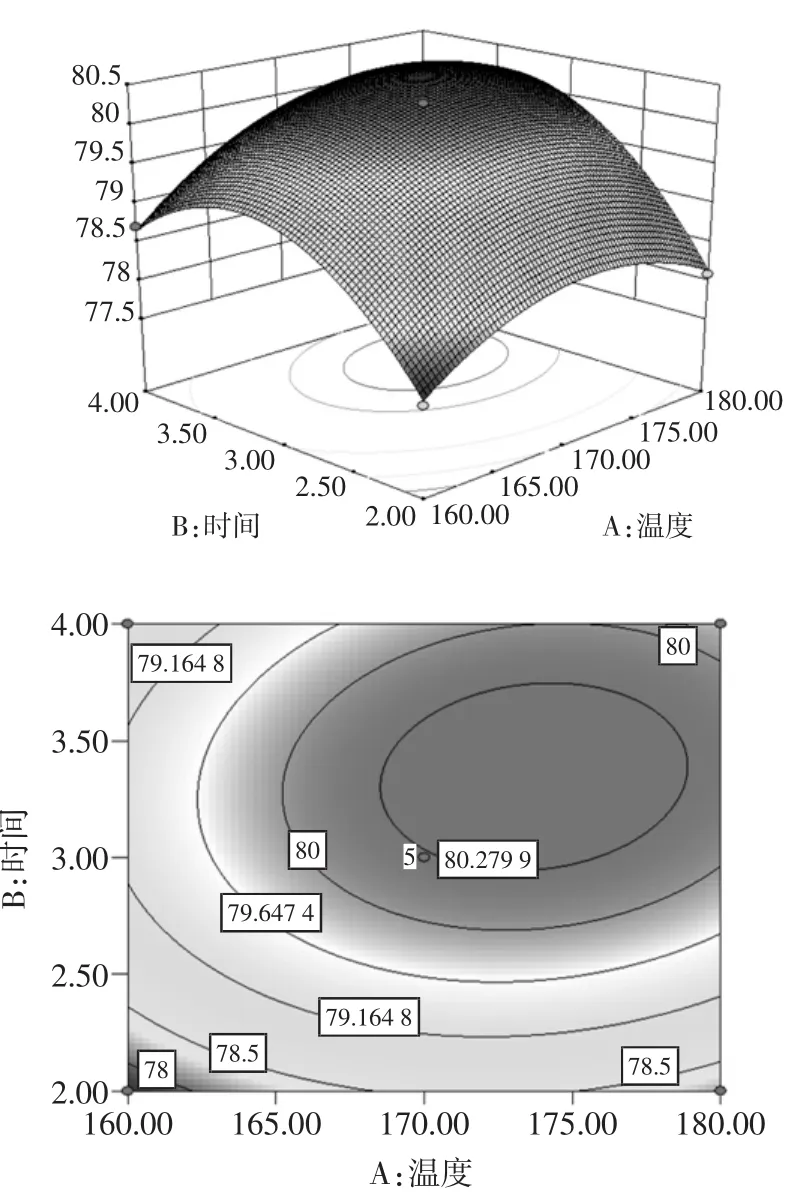
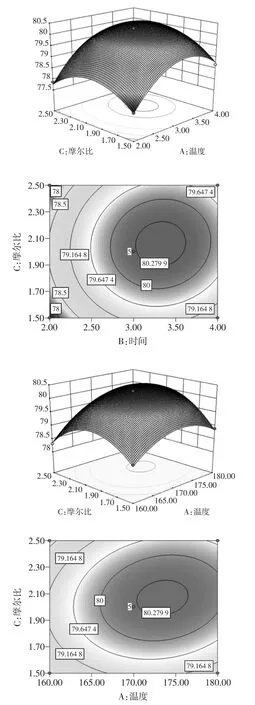
图4 各因素相互作用的响应面与等高线图Fig.4Response surface plots and contour plots of pairwise interactive effects
3结论
通过单因素试验与响应面分析相结合的试验方法来优化植酸合成的工艺,建立了植酸含量的计算模型,得到最佳的合成工艺条件为:H2O与P2O5的反应摩尔比为2.1,合成温度174℃,合成时间3.3 h,其收率最高为80.32%。所得的回归模型的拟合度良好,预测性较好,可用来分析和预测合成植酸的含量。
[1]刘巧茹.由菲汀制取植酸钠及植酸的生产工艺研究[J].河南师范大学学报(自然科学版),2004,32(4):130-132
[2]大山.植酸的生产和应用[J].精细化工原料及中间体,2003(8): 28-30
[3]南怡.植酸开发应用前景广阔[J].科技与开发,化工中间体,2003(2):34-36
[4]靳晓琳,王新坤,杨润强,等.高等植物体中植酸合成代谢及其生理作用[J].植物生理学报,2014,6(50):711-716
[5]Qingchuan Chen.Determination of Phytic Acid and Inositol Pentakisphosphates in Foods by High-Performance Ion Chromatography[J]. Journal of agricultural and food chemistry,2004,52(15):4604-4613
[6]戴传波,李建桥,李健秀.植酸制取的研究进展[J].食品工业科技,2007(2):239-241
[7]Danny A Van Elswijk,Uwe P Schobel,Ephraim P Lansky,etal. Rapid dereplication of estrogenic compounds in pornegranate(Punicag ranatum)using on-line biochemical detection coupled to mass spectrometry[J].Phytochemistry,2004,65(2):233-241
[8]B M Simonet1,F Grasesl,J G.March1.Deter mination of phosphate in urine by sequential injection analysis[J].Frese-nius.Journal of Analytical Chemistry,2001,1(369):247-251
[9]吴澎,田纪春,王凤成.谷物中植酸及其应用的研究进展[J].中国粮油学报,2009,24(3):137-142
[10]陈蓓颖,沈群.小米麸皮植酸的提取及植酸含量初步分析[J].食品工业科技,2013,34(9):202-205
[11]余安.花生粕中植酸的提取及纯化研究[D].武汉:华中农业大学,2010
[12]张君朝,任传英,黄文功.米糠和豆粕中植酸的提取及含量的测定[J].黑龙江农业科学,2009(2):132-134
[13]张奶玲.植酸提取技术改进及其在果蔬保鲜中的应用研究[D].长春:吉林农业大学,2008
[15]Grases F,Simonet B M,Perelló J,et al.Effect of phytate on element bioavailability in the second generation of rats[J].Journal of Trace Elements in Medicine and Biology,2004,17(4):229-234
[16]El S N,Karakaya S,Simsek S.Effect of phytic acid on iron bioavailability in fortified infant cereals[J].Nutrition&Food Science,2010,40(5):485-493
Optimization of Synthesis Process for Phytic Acid by Response Surface Methodology
LIU Qian-qian
(Pharmaceutical Science and Technology Department,Heze University,Heze 27400,Shandong,China)
Phytic acid was synthesized with inositol as raw materal and phosphorus pentoxide as the phosphating agent through phosphorization;synthetise;decolorization and filtration.Based on single factor tests,the optimum synthesis conditions of phytic acid were obtained through Box-Benhnken central combination design and RSM. The results showed that the optimum synthesis conditions of phytic acid were as follows:molar ratio of waterto phosphorus pentoxide 2.1,reaction temperature 174℃,reaction time 3.3 h,the optimized yield of phytic acid was 80.32%.
inositol;phytic acid;synthesis;response surface methodology
10.3969/j.issn.1005-6521.2015.14.021
2014-11-06
刘倩倩(1986—),女(汉),助教,硕士,研究方向:有机合成方向。

