不同有机酸体系中紫薯花色苷热降解稳定性研究
刘海英,邢子毅,王加华,马亚茹,梁 珊
(1.许昌学院食品与生物工程学院,河南许昌461000;2.华南理工大学生物科学与工程学院,广东广州510006;3.暨南大学理工学院,广东广州510632)
不同有机酸体系中紫薯花色苷热降解稳定性研究
刘海英1,邢子毅2,王加华1,马亚茹1,梁珊3
(1.许昌学院食品与生物工程学院,河南许昌461000;2.华南理工大学生物科学与工程学院,广东广州510006;3.暨南大学理工学院,广东广州510632)
研究了紫薯花色苷在乳酸、酒石酸、苹果酸、乙酸、柠檬酸体系中的热降解稳定性,通过建立紫薯花色苷热降解动力学模型,分析紫薯花色苷在不同有机酸体系中的热降解速率常数k、半衰期t1/2及热降解活化能Ea,为提高紫薯花色苷的稳定性提供实验参考和理论依据。结果表明:紫薯花色苷的热降解符合一级反应动力学模型,随着温度的升高,紫薯花色苷降解速率明显加快;在有机酸体系中,紫薯花色苷的热降解活化能Ea及半衰期t1/2较空白组均有所提高,即稳定性增强。有机酸辅色后Ea值分别提高了35.71%(酒石酸)、32.06%(乳酸)、20.61%(苹果酸)、12.60%(乙酸)、45.31%(柠檬酸)。其中柠檬酸、酒石酸、乳酸的作用效果较好,可考虑作为辅色剂。
紫薯花色苷,有机酸,稳定性,热降解动力学,半衰期,热降解活化能
伴随“苏丹红事件”的发生,人们对于人工合成色素的安全性越来越关注,大量研究证明人工合成色素具有潜在健康风险,如影响儿童智力发育[1],具有致泻性、致突性与致癌作用[2-3],世界各国纷纷出台政策禁止或限制人工合成色素的使用。而相对来说,天然食用色素不仅具有色调自然柔和,安全性强的特点,同时不少种类还具有一定的营养和药理作用,对人体健康有利。因此,开发天然食用色素新资源,是食品工业领域中的重要研究课题。
紫薯,旋花科植物甘薯的特有品种,最为突出的特点在于含有大量的水溶性天然色素—紫薯花色苷(purple sweet potato anthocyanin,PSPA),每百克鲜重含量可达30~120mg。PSPA的化学组成以酰化的矢车菊苷和芍药苷为主[4],这是一类具有多项生理保健作用的黄酮类化合物,能够清除人体自由基,延缓动脉粥样硬化、预防高血压、保护肝脏、延缓人体衰老[5-7]等,这些特点赋予紫薯色素优越的开发利用价值。2012年4月,经卫生部批准,紫薯色素作为天然色素的新品种加入了我国食品添加剂的行列[8]。
但是,天然色素普遍具有稳定性差[9]、着色力弱、分离纯化困难等缺点,这些都制约了天然色素在实际生产中的应用,提高天然色素的稳定性也成为了亟待解决的问题之一。本文通过讨论几种有机酸对PSPA的辅色作用,对提高天然色素PSPA的稳定性提供了一定的理论基础和实验依据,进而为紫薯色素制备、贮藏、食品应用的生产实践提供一定的理论参考。
1 材料与方法
1.1材料与仪器
新鲜紫薯仔市售;乳酸、柠檬酸、苹果酸、醋酸、酒石酸、氯化钾、无水乙酸钠、无水乙醇、盐酸均为分析纯。
7200型可见分光光度计尤尼柯(上海)仪器有限公司;TG16-WS型台式高速离心机湖南湘仪实验仪器开发有限公司;DS-1型组织捣碎匀浆机上海比朗仪器有限公司;HH-Z2型电加热恒温水浴锅郑州长城科工贸有限公司;FA1004N型电子分析天平上海菁海仪器有限公司;PHS-3C型精密pH计上海仪电科学仪器股份有限公司;XW-80A型旋涡混合器上海精科实业有限公司;1260型高效液相色谱仪美国安捷伦科技有限公司;SHA-C型恒温水浴振荡器常州普天仪器制造有限公司。
1.2实验方法
1.2.1PSPA样品的制备新鲜紫薯洗净切块,以1∶3的料液比分别与一定浓度的乳酸、酒石酸、苹果酸、冰乙酸、柠檬酸混合打浆,以蒸馏水提取作空白对照,室温振荡提取30min后,10000r/min的转速下离心15min,得到各有机酸PSPA提取液,4℃冷藏备用。
1.2.2PSPA相对含量的测定方法花色苷的含量测定采用pH漂移法,并按公式(1)计算PSPA的相对含量[10]:

式中:n为稀释倍数;M为矢车菊-3-葡萄糖苷(Cy-3Gl)的相对分子质量445.2g/mol;ε为Cy-3Gl的摩尔吸光系数,29600。
1.2.3有机酸浓度对紫薯花色苷热稳定性的影响取15只具塞刻度试管,分为A、B、C三组,每组编号1、2、3、4、5。其中A、B、C各组分别加入20mL用0.01、0.03、0.05mol/L的各有机酸溶液做提取剂提取的PSPA溶液,70℃下热水浴处理5h后,冰水浴急速冷却至室温,按1.2.2方法测热处理前后各样品花色苷的相对含量,计算降解率,平行实验3次,评价有机酸浓度对PSPA热降解稳定性的影响,筛选出最优辅色浓度。
1.2.4PSPA热降解动力学模型的建立植物花色苷在贮藏和加工过程中极易受到光照、pH、热、酶等各种环境因素的影响而降解。采用零级动力学反应模型或一级动力学反应模型分析PSPA的降解,简单来说,零级反应中花色苷降解量与反应时间呈良好的线性关系(式2),而一级反应中,花色苷残留率的对数值与反应时间呈良好的线性关系(式3)。

以上两式中,Ct为t时刻PSPA的相对含量,C0为t= 0时PSPA的相对含量,t为反应时间,k为相应的热降解速率常数。
半衰期t1/2表示的是反应物被消耗一半时所需要的反应时间。由(2)式得,零级反应的半衰期可表示为:

由(3)式得,一级反应的半衰期可表示为:

热降解活化能Ea是反映花色苷热降解稳定性的一个重要参数,对于指定反应,Ea既与反应物质量浓度无关,又与反应温度无关。可根据阿列纽斯(Arrhenius)方程进行计算:

当方程两边同时取对数时,得:

因此可根据热降解速率常数的对数值lnk与绝对温度的1/T做线性回归,由直线的斜率和截距便可求出特定条件下PSPA的Ea和指前因子A。式中:Ea—热降解活化能,kJ/mol;k—热降解速率常数,h-1;R—气体常数,8.314kJ/mol·K;A—指前因子,对于指定的反应,A和反应物含量及温度无关;T—绝对温度,K。
1.2.5PSPA在不同有机酸体系中热降解动力学研究取24只具塞刻度试管,分Ⅰ、Ⅱ、Ⅲ、Ⅳ四组,每组6只,编号为1、2、3、4、5、6。1~5号试管中分别加入20mL的0.05mol/L乳酸、酒石酸、苹果酸、冰乙酸以及柠檬酸的PSPA提取液,6号试管中加入等量蒸馏水提取PSPA液,做空白对照。将Ⅰ、Ⅱ、Ⅲ、Ⅳ组样品分别在60、70、80、90℃四个温度梯度下热水浴处理,热处理时间为6h,期间每隔1h取样,用1.2.1方法计算热处理前后各体系中PSPA相对含量,平行实验3次。分析数据,按照相应的动力学模型计算PSPA降解的热降解速率常数k、半衰期t1/2和热降解活化能Ea,评价不同有机酸对PSPA热降解稳定性的影响。
1.2.6PSPA高效液相色谱分析取0.05mol/L的各有机酸提取PSPA溶液,用0.45μm微孔滤膜过滤,进行高效液相色谱(High Performance Liquid Chromatography,HPLC)分析。流动相A为0.5%甲酸超纯水,流动相B为0.5%甲酸乙腈,柱温25℃,流速0.5mL/min,进样量20μL,检测波长530nm。洗脱梯度:0~5min为90%流动相A与10%流动相B;6~23min为84%流动相A与16%流动相B;24min为82%流动相A与18%流动相B,总洗脱时间35min。
1.3数据处理
数据统计采用SPSS软件进行ANOVA单因素方差分析,并进行Ducan’s多重比较检验(p<0.05),数值以平均值±标准差表示。
2 结果与分析
2.1有机酸浓度对PSPA稳定性的影响
分别用0.01、0.03、0.05mol/L的各有机酸溶液提取花色苷,于70℃热处理5h后PSPA的降解率计算结果如表1所示。由表1可知,在添加有机酸的前提下,PSPA的降解损失显著降低。而且,随着有机酸浓度的增大,花色苷保存率不断提高,表明有机酸浓度增大有利于保持花色苷的稳定性。比较B组与C组实验数据,可以看出酸浓度提高到一定程度后,对PSPA的热降解保护作用趋于平衡,继续增加酸浓度意义不大,故本文选取0.05mol/L的各有机酸体系做进一步探究。

表1 不同浓度有机酸体系中PSPA降解率比较Table 1 The degradation rate of PSPA in different concentrations of organic acids systems
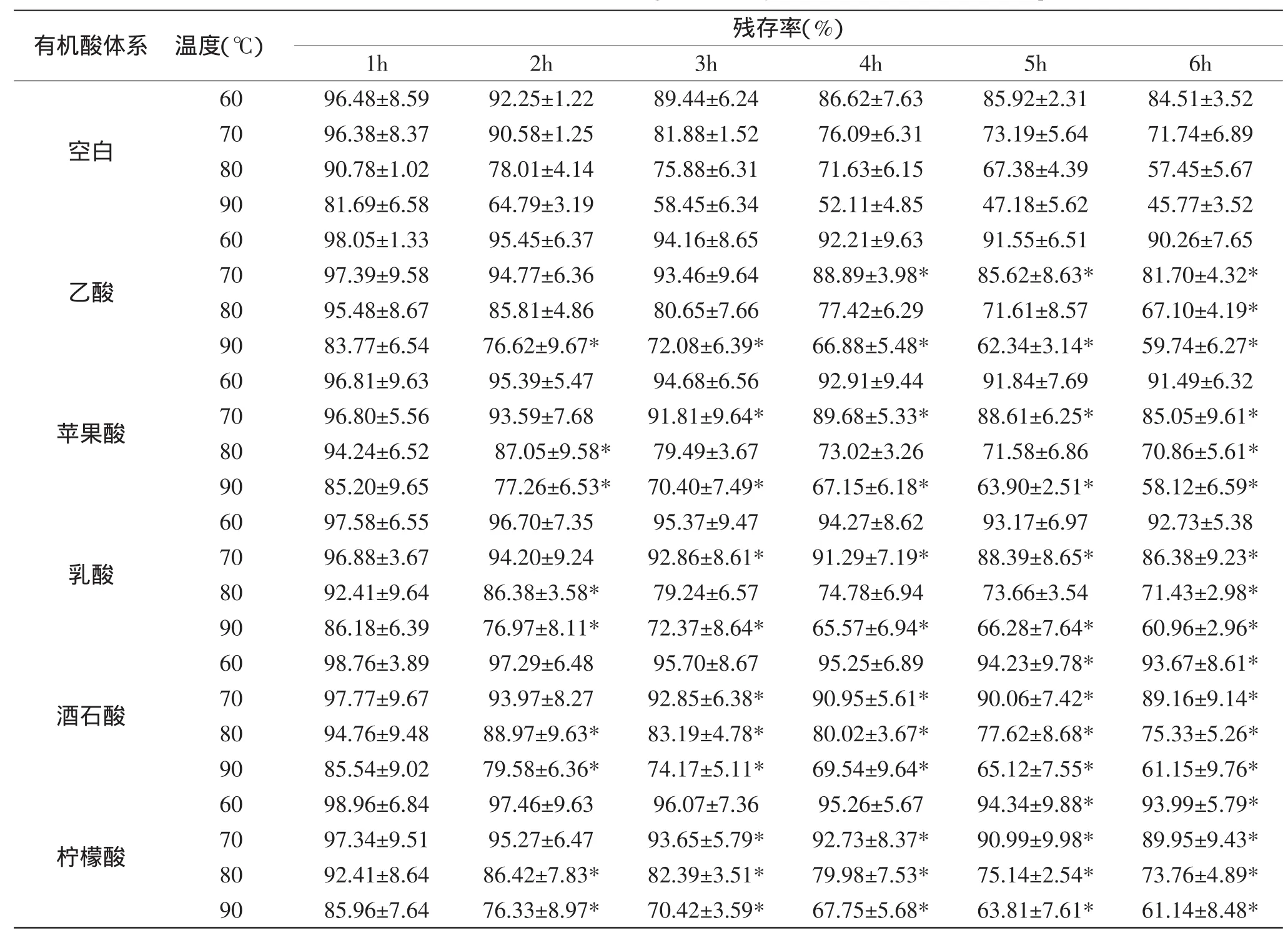
表2 PSPA在不同有机酸体系及热处理温度下的残存率Table 2 The residual rate of PSPA in different organic acid system and heat treatment temperature
2.2PSPA在不同有机酸体系中热降解稳定性比较
表2表示各有机酸体系中不同温度热处理后花色苷残存率随时间的变化情况。由表2可以看出,纯蒸馏水体系中PSPA经热处理后降解损失严重,而且随着热处理温度由低到高逐渐提升,花色苷的降解速度大幅度增加,PSPA残存率显著降低,如90℃处理5h损失率已超过50%。而有机酸体系中经热处理后PSPA残存率均要高于空白组,其中,60℃条件下酒石酸体系和柠檬酸体系在热处理5h和6h后均表现显著性差异;70℃热处理3h后酒石酸、柠檬酸、乳酸、苹果酸四种体系出现显著性差异,4h后五种有机酸种体系均显示出显著性差异;80℃热处理仅2h酒石酸、柠檬酸、乳酸、苹果酸四种体系出现显著性差异,6h后五种食品有机酸体系PSPA的残存率均出现显著性差异;90℃热处理2h五种有机酸体系PSPA残存率就全部出现显著性升高,6h后分别比空白组提高比例为乙酸13.97%、苹果酸12.35%、乳酸15.19%、酒石酸15.38%、柠檬酸15.37%,这说明这些有机酸对PSPA的受热分解均具有一定保护作用。结合各温度条件下具体数据的对比分析可知,不同有机酸对PSPA的保护效果有所不同,总体而言,柠檬酸和酒石酸的护色效果最佳,乳酸次之,其次是苹果酸,乙酸效果则最差。
2.3PSPA热降解反应级数的确定
研究表明,植物花色苷降解基本上符合零级反应动力学或一级反应动力学模型[10-12],二级至多级反应则鲜有报道。按照1.2.4的论述,假设在一定温度下及有机酸体系中PSPA的降解符合零级或一级反应动力学模型。针对乳酸、酒石酸、苹果酸、乙酸、柠檬酸各自不同的花色苷体系,测定计算各时刻花色苷的相对含量,然后以热处理时间t作为横轴、-ln(Ct/C0)做纵轴,利用Excel软件对各温度下及有机酸体系中-ln(Ct/C0)与热处理时间t作线性关系图,得一级反应线性关系;同理,以热处理时间t作为横轴、花色苷降解量C0-Ct做纵轴,利用Excel软件对各温度下及有机酸体系中花色苷降解C0-Ct与热处理时间t作线性关系图,得零级反应线性关系(表3)。

表3 不同条件下PSPA降解的零级和一级反应线性回归系数Table 3 The PSPA degradation rate constant and regression coefficient of the zero-order and first-order reaction under different conditions
在一定温度和pH条件下,通过比较相应反应级数下的反应速率常数k来推断降解反应的快慢,通过比较零级和一级反应的线性回归系数R2来推断反应级数,线性回归系数R2较高的说明反应符合此级数反应[13]。通过比较表3中零级反应和一级反应的线性回归系数R2可知,PSPA热降解一级线性回归系数R2均大于同条件下零级线性回归系数R2,60℃和70℃时,二者相差不大,但是随着温度的升高这种差异性越来越明显,对同一温度条件下R2进行单因素方差分析可知,90℃时零级反应和一级反应的线性回归系数R2表现出显著性的差异。因此,可以确定在不同温度及有机酸体系中花色苷的降解符合一级反应动力学模型。
2.4PSPA热降解动力学参数
按一级反应动力学模型分析热降解速率常数k和半衰期t1/2,再由阿列纽斯方程经线性回归得到不同体系下PSPA的热降解活化能Ea以及指前因子A。结果如表4所示。
由表4可知,在不同温度及有机酸体系中,PSPA的热降解速率常数k、半衰期t1/2及热降解活化能Ea均有所不同。不论在何种体系中热降解速率常数k都随着温度的升高而增大,而半衰期t1/2则相应的减小,说明温度的升高是引起PSPA的稳定性降低的主要原因。而同一温度条件,与空白对照组相比较,各有机酸体系中热降解速率常数k均明显减少,说明有机酸通过延长降解时间而增强了PSPA的热降解稳定性。
一般而言,活化能Ea越高则反应越不易进行,比较各组热降解活化能Ea的大小可以看出,空白组Ea最小即其稳定性低,这与PSPA在纯蒸馏水体系中褪色最快的实验现象相吻合;各有机酸体系中,PSPA热降解Ea由小到大排序依次为乙酸组、苹果酸组、乳酸组、酒石酸组、柠檬酸组,比空白组分别提高了12.60%(乙酸)、20.61%(苹果酸)、32.06%(乳酸)、35.71%(酒石酸)、45.31%(柠檬酸)。表明花色苷在上述体系中的热降解稳定性依次增强,即本实验研究的几种有机酸对PSPA有一定的保护作用。
3 讨论
花色苷在有机酸的辅色作用下会变得更加稳定,且使花色苷呈色更为鲜亮,但是有机酸对花色苷辅色的作用机理目前还尚不清楚。辅色作用主要有分子间辅色和分子内辅色两种,此外还有自聚作用和金属络合作用[14]。结合各种有机酸PSPA提取液高效液相图谱分析(图1),可以看出各种有机酸中PSPA各组分出峰时间和峰型具有很好的一致性,说明本实验中有机酸辅色前后花色苷组分并未发生变化,因此可推测有机酸与PSPA可能是非共价结合的分子间共色作用。这种非共价结合可能有两种方式[15-16],一种是各有机酸与花色苷通过氢键或疏水键结合,提高花色苷的稳定性;另一种是花色苷与各种有机酸通过电子转移或π-π键相互作用形成络合物,避免水分子对2-苯基苯并吡喃阳离子的进攻,防止或减少花色苷形成的无色醇型假碱结构或开放的无色查耳酮结构,进而避免或减少花色苷色泽的损失,最终提高了花色苷的稳定性。这两种非共价结合的辅色方式可能单独作用,也可能同时存在于一种体系中,共同产生辅色作用[17]。

表4 PSPA的热降解动力学参数Table 4 The thermal degradation kinetic parameters of PSPA
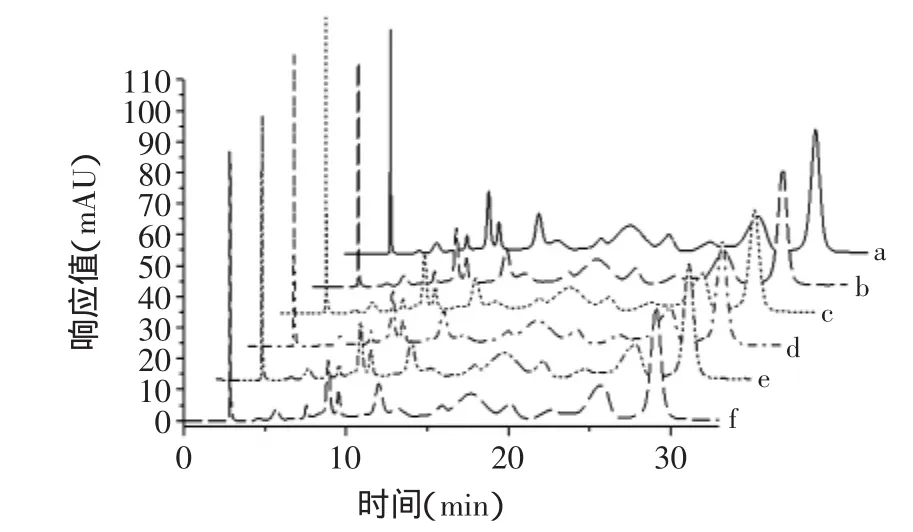
图1 不同有机酸体系中PSPA组分的HPLC比较Fig.1 HPLC comparison of anthocyanin fractions of PSPA in different organic acid systems
对于不同有机酸在相同浓度下的辅色效果不同,则可以从各有机酸的结构进行分析。乳酸、酒石酸、苹果酸、乙酸、柠檬酸各含有不同数目的羧基,因此造成各体系pH的少许差异,而花色苷在不同pH下稳定性不同,因而对PSPA的热稳定性可产生一定影响,这可能是造成辅色效应存在差异的一个因素。
4 结论
4.1PSPA在热处理条件下的降解可认为符合一级反应动力学模型。
4.2PSPA在本文的热处理条件下易发生降解,且随着热处理温度的升高,花色苷的降解速率明显加快。
4.3PSPA在有机酸体系中的热降解稳定性明显要高于单纯蒸馏水提取的花色苷的热降解稳定性,证明本文所研究的几种有机酸对PSPA均具有一定的保护作用。不同的有机酸对PSPA的辅色效果不同,从总体上来看,柠檬酸的辅色效果最佳,其次是酒石酸,再次是乳酸和苹果酸,乙酸的辅色效果则最弱。
[1]水苏.损孩子智力的6种人工色素[J].中国保健营养,2011,22(8):61.
[2]Mpountoukas P,Pantazaki A,Kostareli E,et al.Cytogenetic evaluation and DNA interaction studies of the food colorants amaranth,erythrosine and tartrazine[J].Food and Chemical Toxicology,2010,48(10):2934-2944.
[3]Chequer F,Venâncio V,Bianchi M,et al.Genotoxic and mutagenic effects of erythrosine B,a xanthene food dye,onHepG2 cells[J].Food and Chemical Toxicology,2012,50(10):3447-3451.
[4]曾盈,蔡智鸣,王振,等.胭脂红对3T3细胞DNA损伤的SCGE检测[J].同济大学学报:医学版,2008,29(1):41-44.
[5]Han K H.Anthocyanin-rich purple potato flake extract has antioxidant capacity and improves antioxidant potential in rats[J]. British Journal of Nutrition,2006,96:1125-1133.
[6]蔡花真,王霞.紫甘薯花色苷组分抑制小鼠肝、肾、心、脾脂质过氧化的研究[J].食品工业,2009,26(4):6-8.
[7]明兴加,李坤培,张明,等.紫色甘薯的生理活性及开发应用研究进展[J].食品研究与开发,2007,28(7):144-147.
[8]中华人民共和国卫生部.关于批准紫甘薯色素等9种食品添加剂的公告(卫生部公告2012年第6号)[J].中国食品添加剂,2012,25(6):233.
[9]Rodrigo N.Cavalcanti,Diego T Santos,Maria Angela A Meireles Non-thermal stabilization mechanisms of anthocyanins in model and food systems-An overview[J].Food Research International,2011,44:499-509.
[10]Dangles,Saito,Brouillard.Kinetic and thermodynamic control offlavyliumhydrationinthepelargonidin-cinnamicacid complexation.Origin of the extraordinary flower color diversity of Pharbitis nil[J].J Am Chem Soc,1993,115:3125-3132.
[11]陈伟,方丹,曹少谦.桑葚汁花色苷及其色泽热降解动力学研究[J].食品科技,2011,36(4):152.
[12]孙建霞,张燕,胡小松,等.花色苷的结构稳定性与降解机制研究进展[J].中国农业科学,2009,42(3):996-1008.
[13]郭庆启,张娜,何娇,等.蓝靛果汁花色苷热降解动力学的研究[J].食品与发酵工业,2011,37(9):74-77.
[14]王锋,邓洁红,谭兴和,等.花色苷及其共色作用研究进展[J].食品科学,2008,29(2):472-476.
[15]Gradinaru G,Biliaderis C,Kallithraka S,et al.Thermal stability of Hibiscus sabdariffa L.anthocyanins in solution and in solid state:effects of copigmentation and glass transition[J].Food Chemistry,2003,83(3):423-436.
[16]Brenes C H,Del Pozo-Insfran D,Talcott S T.Stability of copigmented anthocyanins and ascorbic acid in a grape juice model system[J].Journal of Agricultural and Food Chemistry,2005,53(1):49-56.
[17]张丽霞,周剑忠,顾振新,等.不同有机酸对黑莓花色苷辅色效果的影响[J].食品与发酵工业,2013,39(6):105-109.
Study on thermal degradation stability of purple sweet potato anthocyanins in different organic acid systems
LIU Hai-ying1,XING Zi-yi2,WANG Jia-hua1,MA Ya-ru1,LIANG Shan3
(1.School of Food and Biological Engineering,Xuchang University,Xuchang 461000,China;2.School of Bioscience and Bioengineering,South China University of Technology,Guangzhou 510006,China;3.College of Science and Engineering,Ji’nan University,Guangzhou 510632,China)
In order to obtain experimental reference and theoretical basis to improve the stability of purple sweet potato anthocyanins(PSPA),thermal degradation stability of PSPA was studied in different organic acid systems like lactic,tartaric,malic,acetic,and citric acid system.PSPA degradation kinetic model was established to analysis the degradation rate constant(k),the half-life(t1/2)and the thermal degradation activation energy(Ea)of PSPA in different organic acid systems.The results showed that the degradation of PSPA conformed to the first-order reaction kinetic model and the degradation rate of PSPA accelerated obviously with the increase of temperature.Compared with the blank group,the t1/2and Ea of PSPA in organic acid systems were all improved,which indicated that the stability of PSPA had been enhanced.The Ea of PSPA in organic acid systems was increased 35.71%by tartaric acid%,32.06%by lactic acid,20.61%by malic acid,12.60%by acetic acid and 45.31%by citric acid.The copigmentation effect of citric acid,tartaric acid,lactic acid was better,thus they could be considered as auxiliary color agents.
purple sweet potato anthocyanins;organic acid;stability;thermal degradation kinetic;half-life;thermal degradation activation energy
TS218
A
1002-0306(2015)10-0320-06
10.13386/j.issn1002-0306.2015.10.059
2014-12-22
刘海英(1969-),女,博士,讲师,研究方向:功能食品化学与营养。
河南省教育厅科学技术研究重点项目(12B550014);许昌学院校内科研基金项目(2013065)。

